8 Minuten
Neue Laborarbeiten deuten darauf hin, dass wir Karies und Parodontitis eines Tages möglicherweise nicht durch das Abtöten oraler Mikroben reduzieren müssen, sondern durch das Unterbrechen der chemischen Kommunikation, die es schädlichen Arten erlaubt, die Oberhand zu gewinnen. Indem Forschende das Quorum Sensing – die Signalkommunikation, die Bakterien zur Koordination ihres Verhaltens nutzen – anvisieren, zeigen sie, dass es möglich ist, den Zahnbelag in Richtung einer gesünderen Mikrobiom-Zusammensetzung zu steuern.
Wie bakterielle „Plauderei" den Mund formt
Bakterien im Mund agieren nicht isoliert. Sie leben in komplexen Gemeinschaften, sogenannten Biofilmen – Zahnbelag ist das bekannteste Beispiel – und verwenden chemische Signale, um Populationsdichten zu erfassen und die Genexpression zu verändern. Dieser Prozess, bekannt als Quorum Sensing, regelt, wann Bakterien Faktoren für Haftung, Biofilm-Reifung oder Virulenz produzieren.
Eine wichtige Klasse von Signalmolekülen sind N-Acyl-Homoserinlactone (AHLs), die für viele gramnegative Arten zentral im Quorum Sensing sind. Erreichen AHLs eine Schwellenkonzentration, schalten sie genetische Programme ein, die späte Kolonisierer begünstigen – Arten, die häufig mit Parodontitis assoziiert sind, etwa Porphyromonas gingivalis. Demgegenüber unterstützen frühe Kolonisierer wie Streptococcus- und Actinomyces-Arten tendenziell die Mundgesundheit.
Auf molekularer Ebene funktionieren viele AHL-Systeme über Synthase/Rezeptor‑Paare (analog zu LuxI/LuxR-Modulen): eine Enzymkomponente erzeugt das Signalmolekül, ein Rezeptor erkennt es und reguliert dann die Transkription zahlreicher Zielgene. In Biofilmen führt das zu koordinierten Veränderungen in der Bildung extrazellulärer polymerer Substanzen (EPS), in Haftungsproteinen und in Stoffwechselwegen, die das ökologische Gleichgewicht im Plaque verschieben können.
Wichtig für das Verständnis des oralen Mikrobioms ist die Tatsache, dass sich mikrobielle Gemeinschaften räumlich und ökologisch differenzieren. Bereiche mit niedrigem Sauerstoffgehalt (anaerobe Nischen), etwa tiefe Zahnfleischtaschen, bieten Bedingungen, unter denen bestimmte Krankheitserreger florieren. Gleichzeitig ermöglichen chemische Signale Kommunikation über Distanz: Bakterien, die selbst keine AHLs produzieren, können dennoch Signale wahrnehmen und darauf reagieren, ein Phänomen, das zu Fernwirkung und gemeinschaftlicher Umstrukturierung führt.
Was die Studie der University of Minnesota ergab
Ein Team unter Leitung von Forschenden der University of Minnesota kultivierte vereinfachte Modelle von Zahnbelag im Labor, um zu kartieren, wie AHL-basierte Signalübertragung die Zusammensetzung mikrobieller Gemeinschaften beeinflusst. Anstatt breit wirkende Antibiotika einzusetzen, applizierten sie Enzyme, die AHL-Signale zerstören oder inaktivieren – eine Strategie, die als Quorum Quenching bezeichnet wird.
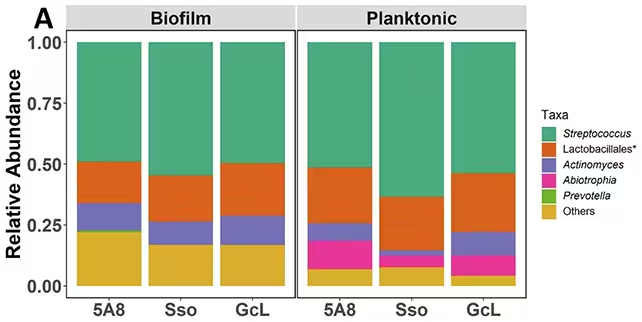
Die Ergebnisse waren bemerkenswert: Durch das Blockieren von AHL-Signalen verschob sich das Gleichgewicht weg von krankheitsassoziierten Bakterien hin zu arten, die mit Mundgesundheit verknüpft sind. Besonders empfindlich reagierten Biofilm‑Gemeinschaften, also die an Oberflächen haftenden Kolonien, während frei schwimmende (planktonische) Bakterien deutlich geringere Veränderungen zeigten. Dies unterstreicht, dass therapeutische Eingriffe in der Regel Biofilm-spezifisch wirken müssen, um effektiv zu sein.
Die Arbeit zeigte außerdem wichtige ökologische Nuancen: Bakterien in anaeroben Nischen – wie tiefe Zahnfleischtaschen – produzieren möglicherweise selbst keine AHLs, können aber Signale aus anderen Bereichen des Mundes wahrnehmen. Diese interzelluläre Kreuzkommunikation erklärt, wie entfernte mikrobielle Populationen sich gegenseitig beeinflussen können und weshalb lokale Interventionen systemische Effekte auf das gesamte orale Mikrobiom haben können.
„Indem man die chemischen Signale stört, die Bakterien zur Kommunikation nutzen, könnte man die Plaque-Gemeinschaft so manipulieren, dass sie im gesundheitsassoziierten Stadium bleibt oder dorthin zurückkehrt,“ sagte Mikael Elias, ein am Projekt beteiligter Biochemiker. Coautor Rakesh Sikdar ergänzte, dass Quorum Sensing wahrscheinlich unterschiedliche Rollen oberhalb und unterhalb des Zahnfleischrandes spielt, was für die Entwicklung zielgerichteter Therapien gegen Parodontitis wichtig sei.
Methodisch umfasste die Studie kontrollierte Gemeinschafts-Kulturen mit definierten Spezies, quantitative Mikrobiomanalysen (16S‑rRNA-Sequenzierung), sowie funktionelle Assays zur Biofilm-Bildung und Virulenzfaktor-Expression. Als Quorum‑Quenching-Enzyme wurden unter anderem AHL‑Lactonasen und AHL‑Acylasen getestet, die unterschiedliche chemische Angriffspunkte an den AHL-Molekülen nutzen. Solche technischen Details stärken die Reproduzierbarkeit und helfen, Mechanismen auf molekularer Ebene zu klären.
Warum das für Mund- und Gesamtgesundheit wichtig ist
Die Perspektive, das orale Mikrobiom zu modulieren statt Mikroben pauschal zu eliminieren, ist attraktiv, weil sie das mikrobielle Gleichgewicht bewahren möchte. Ein ökologisch orientierter Ansatz reduziert den Selektionsdruck für resistente Stämme und erhält schützende Arten, die Besiedlung durch Pathogene verhindern helfen.
Die Mundgesundheit steht in engem Zusammenhang mit systemischen Erkrankungen: Chronische Zahnfleischerkrankungen wurden in zahlreichen Studien mit Herz-Kreislauf-Erkrankungen, Diabetes-Komplikationen und sogar kognitivem Rückgang assoziiert. Zwar sind Kausalzusammenhänge komplex und multifaktoriell, doch eine Verhinderung von Dysbiose – dem Ungleichgewicht mikrobieller Gemeinschaften – könnte einen Beitrag zur Reduktion systemischer Entzündungslast leisten.
Quorum‑Quenching‑Strategien bieten hier das Potenzial für präzisere, gezielte Interventionen im Rahmen vorbeugender Zahnmedizin und mikrobiomanaher Therapien. Indem man gezielt Signale unterbindet, ließe sich möglicherweise die Entwicklung pathogenreicher Biofilme verhindern, ohne die nützlichen Mitglieder des oralen Mikrobioms zu dezimieren.
Therapeutische Wege und technologische Möglichkeiten
- Enzyme, die AHLs abbauen (Quorum Quencher), könnten als Mundspülungen, Lacke, slow‑release‑Gele oder in zahnärztliche Versiegelungen integriert werden. Formulierungen mit mucoadhäsiven Trägern würden längeren Kontakt mit wichtigen Nischen ermöglichen.
- Probiotische Ansätze könnten vorteilhafte frühe Kolonisierer gezielt fördern, möglicherweise kombiniert mit signalblockierenden Molekülen, um eine gesunde Sukzession bei der Plaquebildung zu begünstigen. Synbiotika (Probiotikum + Präbiotikum) sind hier ein denkbares Konzept.
- Kleine Molekülinhibitoren des Quorum Sensing sind ein weiterer Weg, erfordern aber hohe Spezifität, günstige Pharmakokinetik und Sicherheitsprüfungen, um Off‑Target‑Effekte auf das Wirtsgewebe oder nützliche Mikroben zu vermeiden.
- Technologische Träger wie Nanopartikel, Hydrogele oder bioresorbierbare Mikrokapseln können die gezielte Abgabe in schwer zugängliche Regionen (z. B. Zahnfleischtaschen) ermöglichen und so die lokale Wirkung verstärken.
Bei der Formulierungsentwicklung sind Stabilität der Enzyme, Schutz vor Proteolyse, sowie die Verteilung und Penetration in den Biofilm entscheidende Herausforderungen. Zudem muss die Wirkung über die Zeit beobachtet werden: Kurzfristige Umstellungen des Mikrobioms können reversibel sein, wenn die Intervention endet.
Grenzen der Studie und nächste Schritte
Die Studie wurde in vereinfachten Labormodellen durchgeführt; deshalb ist weitere Forschung nötig, um zu bestätigen, dass diese Dynamiken im menschlichen Mund in gleicher Weise ablaufen. Klinische Endpunkte wie Kariesentstehung oder Progression von Parodontitis wurden nicht direkt gemessen. Übersetzungen von Enzymen oder kleinen Molekülen in sichere, wirksame orale Therapien erfordern daher Tierversuche, toxikologische Tests, kontrollierte Humanstudien und genaue Beobachtung, wie Eingriffe das gesamte orale Mikrobiom langfristig verändern.
Weitere offene Fragen sind beispielsweise: Welche Auswirkungen hat langfristiges Quorum Quenching auf mikrobiologische Resilienz und Ökosystemdynamik? Besteht das Risiko, dass sich Ersatzpfade oder alternative Signalmoleküle entwickeln? Wie lassen sich gezielte Wirkstoffträger so gestalten, dass sie in den relevanten Nischen anreichern, ohne die Mundflora insgesamt zu destabilisieren?
Auf methodischer Ebene sind komplexere in vitro‑Modelle (mikrobiomische Flow‑Zellsysteme, orale Organ‑on‑a‑chip‑Modelle) sowie sorgfältig designte Tiermodelle und schließlich randomisierte klinische Studien erforderlich. Standardisierte Endpunkte, quantitative Mikrobiom‑Profiling‑Methoden (z. B. Metagenomik, Metatranskriptomik) und funktionelle Marker (z. B. Enzymaktivität, Biofilm‑Biomasse) werden nötig sein, um Wirksamkeit und Sicherheit belastbar zu belegen.
Fachliche Einschätzung
„Diese Arbeit ist spannend, weil sie Behandlung als ökologische Steuerung statt als mikrobiologischen Krieg neu denkt“, sagte Dr. Laura Kim, eine fiktive Mikrobiom‑Wissenschaftlerin an einem großen Forschungskrankenhaus. „Die Umsetzung in der Praxis wird von der Lieferform abhängen – die Quorum‑Quenching‑Agentien müssen in die richtige Nische gelangen, ohne nützliche Mikroben zu stören – doch das Konzept eröffnet einen neuen Pfad für Präventivzahnmedizin und gezielte Infektionskontrolle.“
Insgesamt liefert die Studie einen Proof‑of‑Principle, dass das Kapern bakterieller Kommunikation ein gangbarer Weg sein könnte, um orale mikrobielle Gemeinschaften in Richtung Gesundheit zu lenken. Unterstützen zukünftige in vivo‑Studien diese Ergebnisse, könnten Zahnärzte und Mikrobiologen neue, differenzierte Werkzeuge erhalten, um Karies und Parodontitis vorzubeugen und gleichzeitig die nützlichen Mitglieder unseres oralen Mikrobioms zu bewahren.
Konkrete nächste Schritte aus Sicht translationaler Forschung umfassen die Identifikation stabiler, sichere Quorum‑Quenching‑Enzyme mit geeigneter Herstellbarkeit, die Entwicklung geeigneter Formulierungen für den oralen Einsatz, sowie die Planung von Studien, die klinische Endpunkte und längerfristige mikrobielle Effekte evaluieren. Regulatorische Anforderungen und die Integration in die zahnärztliche Praxis sind weitere wichtige Aspekte, die parallel zur präklinischen Entwicklung adressiert werden müssen.
Schlüsselbegriffe für weitere Recherche und Entwicklung sind: orales Mikrobiom, Quorum Sensing, Quorum Quenching, AHL‑Lactonase, Biofilm‑Kontrolle, Plaque‑Modulation, Parodontitis‑Prävention, antimikrobielle Resistenz und probiotische Interventionen.
Quelle: sciencealert

Kommentar hinterlassen