6 Minuten
Stammzell-Injektionen kehren Schlaganfallschäden im Mausgehirn um
Forscherinnen und Forscher der Universität Zürich und der University of Southern California berichten, dass transplantierte menschliche Stammzellen geschädigtes Gehirngewebe nach ischämischem Schlaganfall bei Mäusen reparieren können. In einem präklinischen Modell überlebten die injizierten Stammzellen, differenzierten sich zu neuronähnlichen Zellen und bildeten Verbindungen zum Wirtsgewebe. Die in Nature Communications veröffentlichte Studie legt nahe, dass mehrere regenerative Mechanismen gleichzeitig ablaufen: neuronale Differenzierung, vaskuläre Reparatur, reduzierte Entzündung sowie eine gestärkte Integrität der Blut‑Hirn‑Schranke. Begleitend wurden messbare Verbesserungen der Motorik bei behandelten Tieren festgestellt, was ein wichtiges funktionelles Ergebnis darstellt.
Wissenschaftlicher Hintergrund und experimenteller Ansatz
Ein Schlaganfall, ausgelöst durch innere Blutungen oder durch Sauerstoffmangel infolge verstopfter Blutgefäße, führt zum Verlust von Nervenzellen und verursacht häufig dauerhafte Beeinträchtigungen von Sprache, Bewegung und Kognition. Konventionelle Therapien zielen vor allem auf die Begrenzung des akuten Schadens und die anschließende Rehabilitation ab; regenerative Ansätze verfolgen hingegen das Ziel, verlorenes neuronales Gewebe zu ersetzen oder wiederherzustellen. In der vorliegenden Studie verwendeten die Forschenden Mäuse mit durch Schlaganfall verursachten Läsionen und injizierten humane neuronale Stammzellen in die betroffenen Hirnregionen, nachdem die akute Phase stabilisiert war. Der Zeitpunkt der Transplantation ist kritisch: Frühere Arbeiten des Teams zeigten, dass das Gehirn ein spezifisches Stabilisierungsfenster nach dem Insult erreichen muss, damit eine erfolgreiche Engraftment stattfinden kann.
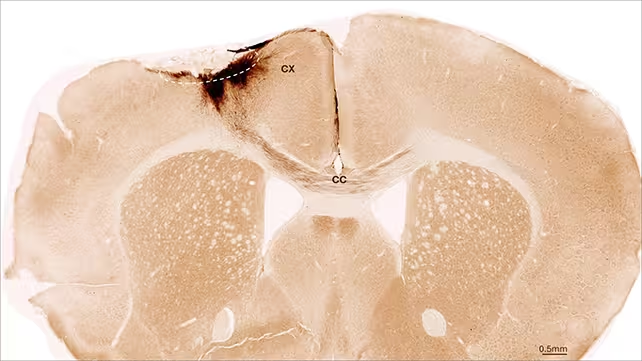
Die Arbeitsgruppe verfolgte die implantierten Zellen über einen Zeitraum von fünf Wochen mithilfe von Immunhistochemie, molekularen Markern und funktionellen Tests. Mehrheitlich blieben die transplantierten Zellen lokalisiert, entwickelten morphologische und molekulare Kennzeichen unreifer Neurone und bildeten ausgedehnte Projektionen, die Kontakt zu den residenten Neuronen und lokalen Netzwerken aufnahmen. Parallel dokumentierten die Forschenden vaskuläres Remodeling: Blutgefäße zeigten Anzeichen autologer Reparatur mit Zeichen erhöhter Durchblutungsdynamik und Gefäßneubildung. Zeitgleich fanden sich reduzierte Entzündungsmarker sowie Verbesserungen in den Eigenschaften der Blut‑Hirn‑Schranke, was zusammengenommen ein Umfeld fördert, das die Regeneration unterstützt und neuronale Integration erleichtert.
Methodisch kombinierten die Untersuchungen strukturelle Analysen (z. B. Marker für Neuronen wie NeuN, Vorläufer‑ und Reifungsmarker wie DCX oder MAP2), vaskuläre Marker (VEGF, CD31) sowie Immunzellmarker (Iba1, CD68) zur Bewertung der entzündlichen Reaktion. Ergänzend wurden elektrophysiologische und Verhaltensassays eingesetzt, um funktionelle Konnektivität und motorische Fähigkeiten zu prüfen. Diese multimodale Herangehensweise stärkt die Aussagekraft der Ergebnisse, weil sie sowohl zelluläre Integration als auch systemische Regenerationsprozesse berücksichtigt.
Zentrale Entdeckungen und Bedeutung für die Schlaganfall‑Erholung
Die wichtigsten Befunde lassen sich in drei Punkten zusammenfassen: Erstens können implantierte humane neuronale Stammzellen in einem geschädigten erwachsenen Gehirn überdauern und sich in neuronähnliche Zellen differenzieren; zweitens sind diese Zellen in der Lage, strukturell zu integrieren und synaptische Kontakte mit dem Wirtsgewebe zu bilden; drittens scheint die Stammzelltransplantation sekundäre regenerative Prozesse wie Angiogenese (Reparatur von Blutgefäßen) und Immunmodulation auszulösen. Funktionell zeigten behandelte Mäuse eine deutlich bessere motorische Leistung gegenüber Kontrollgruppen — ein entscheidender translationaler Hinweis, da motorische Defizite zu den am stärksten einschränkenden Folgen eines Schlaganfalls zählen.
Die Studie hebt hervor, dass reine Zellüberlebensdaten allein nicht ausreichen, um therapeutisches Potenzial zu bewerten. Maßgeblich ist die Frage, ob neue oder differenzierte Zellen tatsächlich synaptisch in bestehende Netzwerke integriert werden und ob dies mit vaskulärer Stabilisierung, verminderter Neuroinflammation und funktioneller Besserstellung korreliert. Solche kombinatorischen Endpunkte sind für die Entwicklung klinischer Strategien zur Neuroregeneration von zentraler Bedeutung.
Die Ergebnisse stützen das Konzept, dass zellbasierte Therapien künftig Funktionen wiederherstellen könnten, die derzeit als irreversibel gelten. Gleichzeitig unterstreichen sie die Notwendigkeit, in präklinischen Studien mehrere Ebenen der Reparatur zu messen: Zellüberleben, neurale Konnektivität, vaskuläre Gesundheit, Entzündungsstatus und Verhalten. Nur ein integrierter Bewertungsansatz kann reale klinische Wirksamkeit und Sicherheit plausibel machen.
Herausforderungen, Sicherheit und Weg zur klinischen Translation
Trotz ermutigender präklinischer Befunde bestehen zahlreiche Hürden bis zur Anwendung am Menschen. Langzeit‑Sicherheitsdaten sind unabdingbar: implantierte Zellen dürfen sich nicht unkontrolliert proliferieren oder in unerwünschte Gewebe wandern. Ebenso müssen optimale Applikationswege, Dosierungen und zeitliche Fenster für die Transplantation noch feinjustiert werden. Die Immunverträglichkeit zwischen menschlichen Spenderzellen und dem Empfänger, mögliche Abstoßungsreaktionen sowie die Unterschiede in Größe und Komplexität zwischen Maus‑ und Menschennervensystem stellen erhebliche translative Herausforderungen dar. Ferner verlangen die regulatorischen Wege für Zelltherapien mehrjährige, strenge Studien zur Sicherheit und Wirksamkeit.
Praktische Fragen, die noch beantwortet werden müssen, umfassen die Standardisierung von Zellproduktionsprozessen (GMP‑konforme Herstellung), Qualitätskontrollen für die Differenzierungsstadien der Zellen, Strategien zur Minimierung von Tumorrisiken sowie die Entwicklung minimalinvasiver, präziser Injektionsverfahren. Auch die Entwicklung von Biomarkern zur Überwachung der engrafteten Zellen im Langzeitverlauf — etwa durch bildgebende Verfahren oder zirkulierende Proteine — ist für den klinischen Fortschritt zentral.
Die Forscherinnen und Forscher mahnen daher zu vorsichtiger, aber fundierter Zuversicht. Den leitenden Wissenschaftlern zufolge geht ihre Analyse über unmittelbare post‑transplantatorische Effekte hinaus und prüft gezielt, ob neu entstandene Zellen auch tatsächlich neurologische Verbindungen ausbilden — ein essentielles Kriterium für sinnvolle funktionelle Wiederherstellung.
Experteneinschätzung
Dr. Maria Alvarez, fiktive Spezialistin für Neuroregeneration, kommentiert: „Diese Studie ist bedeutsam, weil sie nicht nur Zellüberleben dokumentiert, sondern auch Integration und begleitende Gewebereparatur zeigt. Die Kombination aus Neurogenese, vaskulärer Stabilisierung und Immunmodulation könnte für eine nachhaltige funktionelle Erholung entscheidend sein. Dennoch erfordert die Translation in die Klinik Lösungen für Immun‑Reaktionen, Langzeit‑Monitoring und die Sicherstellung, dass die transplantierten Zellen in menschlichen Schaltkreisen funktionell angemessen arbeiten.“
Aus wissenschaftlicher Perspektive betont diese Einschätzung zwei Punkte: Zum einen sind multifaktorielle Reparaturmechanismen wahrscheinlicher erfolgreich als monofokale Ansätze; zum anderen bleibt die Validierung in größeren Tiermodellen und schließlich in gut kontrollierten klinischen Studien Voraussetzung für therapeutische Anwendungen. Internationale Zusammenarbeit, transparente Daten und standardisierte Protokolle tragen entscheidend dazu bei, die Sicherheit und Reproduzierbarkeit solcher Ansätze zu erhöhen.
Schlussfolgerung
Die vorliegende Studie liefert robuste präklinische Evidenz, dass humane neuronale Stammzellen in Schlaganfall‑geschädigten Mausgehirnen engraften, differenzieren und Reparaturprozesse fördern können. Zu den beobachteten Effekten zählen neuronale Integration, vaskuläre Selbstreparatur, reduzierte Entzündung und verbesserte motorische Funktionen. Diese Ergebnisse sind vielversprechend im Hinblick auf künftige Schlaganfalltherapien, doch die Überführung in die klinische Praxis wird umfangreiche Sicherheitsstudien, Optimierung von Zeitfenstern und Lieferwegen sowie sorgfältig konzipierte klinische Prüfungen erfordern. Die Forschung ergänzt ein wachsendes Kapitel in der regenerativen Neurologie und verdeutlicht, wie kombinierte zell‑ und gewebebezogene Reparaturmechanismen eines Tages verlorengegangene Funktionen nach Schlaganfall wiederherstellen könnten.
Aus Sicht von Forschung, Klinik und Gesundheitspolitik sind mehrere Handlungsfelder zentral: die Förderung translationaler Forschung, die Etablierung ethischer und regulatorischer Standards für Zelltherapien sowie die Verbesserung von Diagnose‑ und Überwachungsmethoden, um Patientinnen und Patienten zukünftig eine sichere und effektive Behandlung anbieten zu können. Insgesamt stellt die Studie einen wichtigen Schritt dar, der das Potenzial zellbasierter Therapien für die neuroregenerative Medizin weiter konkretisiert.
Quelle: sciencealert

Kommentar hinterlassen