7 Minuten
Forscher entdecken alternativen wärmeerzeugenden Mechanismus im braunen Fett
Wissenschaftler der Washington University School of Medicine in St. Louis haben einen bislang wenig beachteten zellulären Weg identifiziert, über den braunes Fettgewebe (braunes Fett) Treibstoff verbrennt und Wärme erzeugt. Die in Nature veröffentlichte Studie beschreibt einen peroxisomzentrierten Prozess, der als eine Art "Backup-Heizung" fungieren kann, wenn die klassische mitochondriale Thermogenese gestört ist. Der Signalweg ist abhängig vom Enzym acyl-CoA oxidase 2 (ACOX2) und scheint Stoffwechsel, Insulinsensitivität und Gewichtsregulation auf Ebene des ganzen Organismus bei Mäusen zu beeinflussen.
Braunes Fett unterscheidet sich grundlegend vom weißen Fettgewebe und der Skelettmuskulatur: Seine Hauptfunktion ist die adaptive Thermogenese — also die Umwandlung von Kalorien in Wärme, um bei Kälte die Körpertemperatur zu halten. Jahrzehntelang galt das mitochondriale Entkopplungsprotein 1 (UCP1) als der zentrale molekulare Schalter, der die Energieproduktion der Mitochondrien in Wärme ableitet. Frühere Beobachtungen zeigten jedoch, dass Tiere ohne UCP1 dennoch teilweise in der Lage sind, Wärme zu erzeugen, was auf alternative Thermogenese-Mechanismen hinweist. Diese Befunde warfen Fragen nach redundanten oder komplementären Wegen auf, die Organismen helfen, Energiehaushalt und Temperaturregulation resilient zu halten.
Peroxisomen und ACOX2: ein ergänzender thermogener Weg
Die neue Arbeit rückt Peroxisomen — kleine Organellen, die auf Fettsäuremetabolismus spezialisiert sind — in den Mittelpunkt dieses alternativen Thermogenese-Systems. Die Forscher stellten fest, dass Kälteeinwirkung die Proliferation von Peroxisomen im braunen Fett anregt. Dieser Effekt war bei Mäusen ohne UCP1 noch ausgeprägter, was darauf hindeutet, dass Peroxisomen kompensatorisch aktiv werden können, wenn die mitochondriale Entkopplung reduziert ist.
Lodhi und sein Team konnten die kompensatorische Aktivität auf ein peroxisomales Enzym zurückverfolgen: acyl-CoA oxidase 2 (ACOX2). In Mausmodellen, in denen ACOX2 spezifisch im braunen Fett entfernt wurde, fiel es den Tieren schwer, während Kältereizen eine normale Körpertemperatur zu halten, und sie zeigten eine beeinträchtigte Insulinantwort. Darüber hinaus nahmen diese Mäuse bei fettreicher Ernährung mehr Körpergewicht zu als Kontrolltiere. Diese Kombination aus Temperaturintoleranz und metabolischer Störung spricht dafür, dass ACOX2 eine physiologisch bedeutsame Rolle für die Energiebilanz spielt.
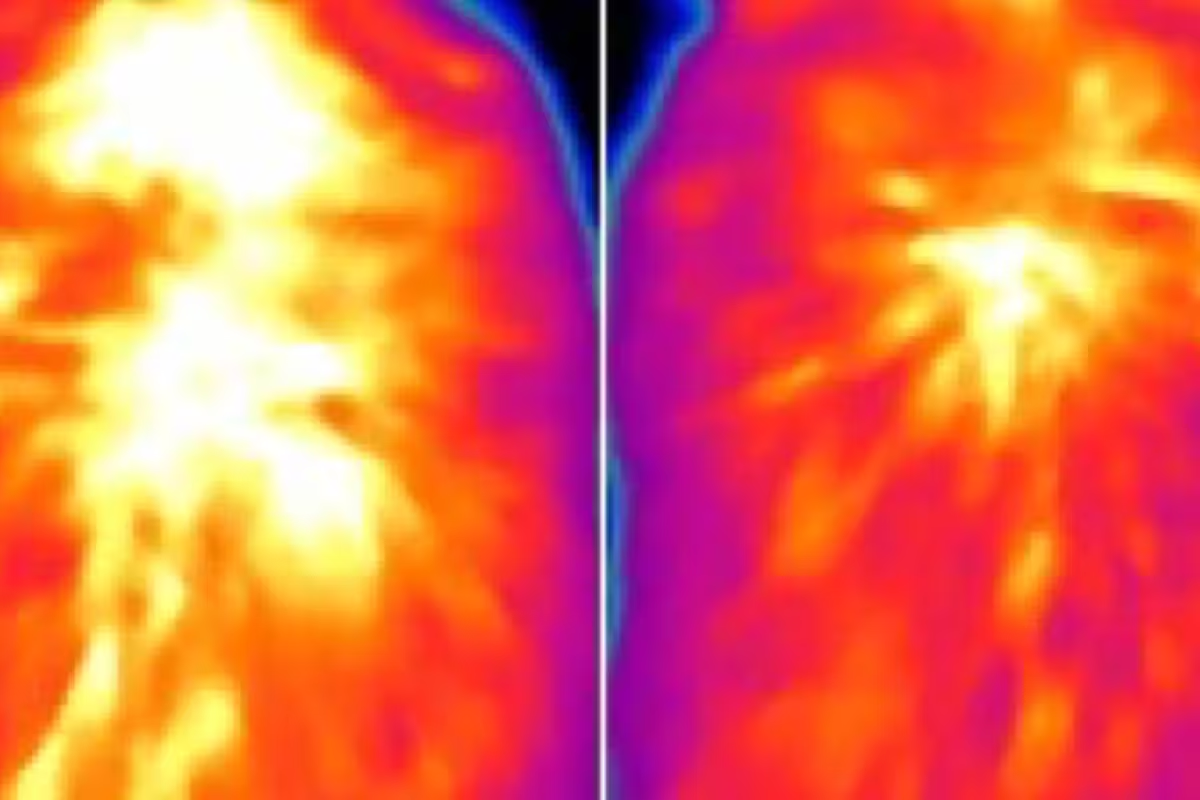
Die von Forschern am WashU Medicine geleitete Studie zeigt mögliche neue Ansätze, braunes Fett für die Behandlung metabolischer Erkrankungen wie Fettleibigkeit nutzbar zu machen. Infrarotaufnahmen deuten auf eine verringerte Wärmeproduktion im braunen Fett einer Maus ohne das Protein ACOX2 (rechts) im Vergleich zu einer Kontrollmaus hin. Eine Wiederherstellung hoher ACOX2-Spiegel im braunen Fett erhöhte die Wärmeproduktion und verbesserte die Gewichtskontrolle, selbst bei Tieren, die eine fettreiche Diät erhielten. Solche bildgebenden Befunde liefern anschauliche, quantitative Hinweise darauf, wie zelluläre Mechanismen auf Gewebe- und Organismusniveau wirken.
Im Gegensatz dazu zeigten Mäuse, die ACOX2 selektiv im braunen Fett überexprimierten, gesteigerte Thermogenese, bessere Kältetoleranz und verbesserte metabolische Parameter — darunter erhöhte Insulinsensitivität und Schutz vor durch Diät induzierter Adipositas. Mithilfe eines für die Studie entwickelten fluoreszenten Hitzesensors konnten die Forscher direkt beobachten, dass ACOX2-abhängiger Metabolismus bestimmter Fettsäuren die intrazelluläre Wärme in braunen Adipozyten erhöhte. Ergänzende Infrarot-Thermografie bestätigte die reduzierte Wärmeabgabe des braunen Fettes bei ACOX2-defizienten Tieren und machte den funktionalen Effekt auf lebenden Tieren sichtbar.
Wissenschaftlicher Hintergrund: Unterschiede zwischen peroxisomaler und mitochondrialer Thermogenese
Mitochondriale Thermogenese über UCP1 funktioniert dadurch, dass Protonen die innere Mitochondrienmembran passieren, ohne die ATP-Synthese anzutreiben; die gespeicherte elektrochemische Energie wird als Wärme freigesetzt. Peroxisomale Thermogenese unterscheidet sich mechanistisch: Peroxisomen oxidieren spezifische Fettsäuren in Reaktionen, die Wärme und nebenläufige Stoffwechselintermediate erzeugen, ohne direkt über das mitochondriale Protonengradient gekoppelt zu sein. ACOX2 katalysiert dabei den ersten Schritt der peroxisomalen Beta-Oxidation bestimmter verzweigter und langkettiger Fettsäuren und fungiert als Schrittmacher für diese Route.
Diese alternative Route führt effektiv dazu, chemische Energie als Wärme zu "vergeuden", wodurch der Ruhe-Energieverbrauch steigt. Aus therapeutischer Perspektive könnte die Förderung peroxisomaler Aktivität im braunen Fett den Tagesumsatz erhöhen, ohne dass dafür zwangsläufig mehr körperliche Aktivität erforderlich wäre — eine potenziell komplementäre Strategie zu Ernährung und Bewegung. Wichtig ist, dass solche Interventionen die Balance zwischen Nutzen (höherer Energieverbrauch) und Risiken (z. B. oxidativer Stress oder unerwünschte Stoffwechselprodukte) sorgfältig abwägen müssen.
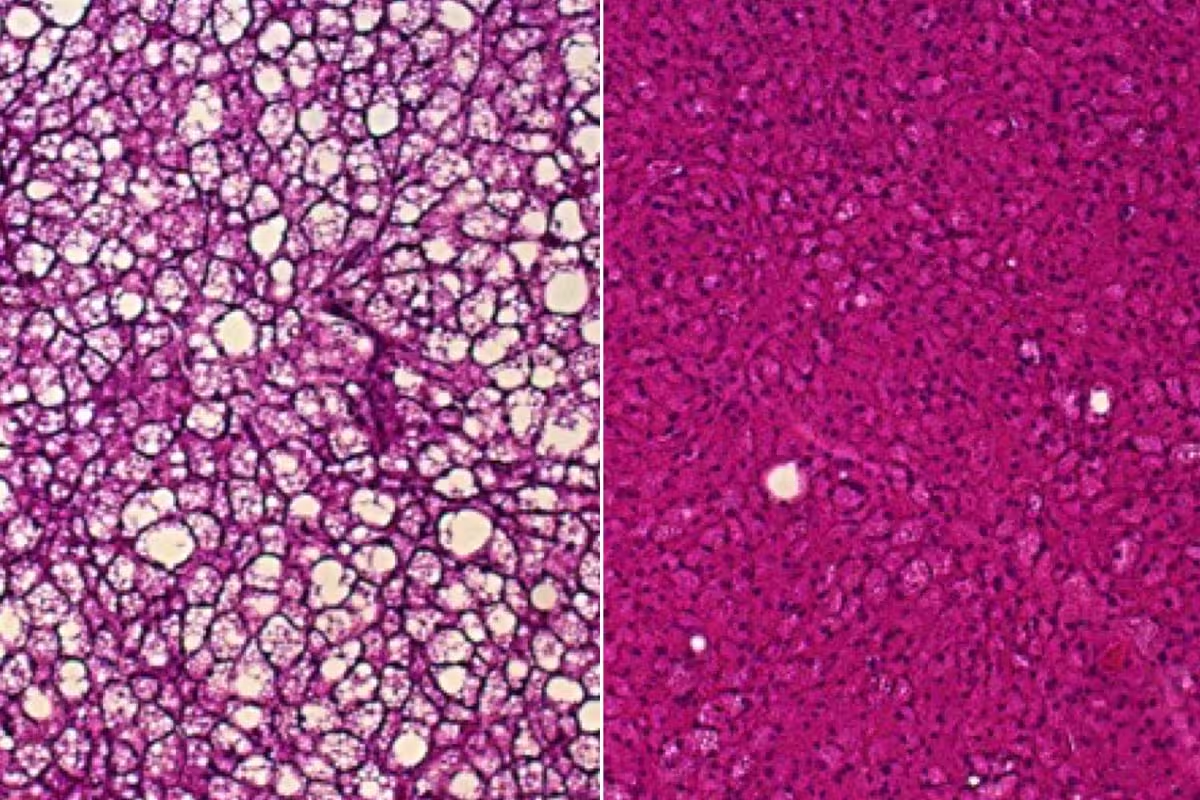
Die Studie am WashU Medicine zeigt weitere mögliche Wege auf, braunes Fett zur Behandlung metabolischer Erkrankungen zu nutzen. Gewebeproben von Mäusen ohne UCP1, die mit einer fettreichen Diät gefüttert wurden, akkumulieren weiße Fetttröpfchen (links) — ein Zeichen beeinträchtigter Wärmeproduktion. In braunem Fett von Mäusen, die zwar ebenfalls UCP1-defizient sind, aber genetisch ungewöhnlich hohe Mengen des Proteins ACOX2 aufweisen, baut sich bei fettreicher Kost kein weißes Fett auf (rechts) und die Wärmeproduktion ist besser erhalten. Solche histologischen Unterschiede liefern wichtige Hinweise auf zelluläre Anpassungen und die Fähigkeit des Gewebes, metabolische Belastungen zu kompensieren.
Auswirkungen auf die menschliche Gesundheit und mögliche Interventionsansätze
Obwohl die aktuellen Experimente an Mäusen durchgeführt wurden, deuten mehrere Indizien darauf hin, dass dieser Weg auch für den Menschen relevant sein könnte. Bestimmte Fettsäuren, die von ACOX2 metabolisiert werden, kommen natürlicherweise in menschlicher Muttermilch und Milchprodukten vor und können zudem durch einige Darmmikroben produziert werden. Beobachtungsstudien haben bereits Zusammenhänge zwischen höheren zirkulierenden Konzentrationen dieser Fettsäuren und einem niedrigeren Body-Mass-Index beim Menschen gefunden; ob hier eine kausale Beziehung besteht, bleibt jedoch offen.
Die Autorinnen und Autoren der Studie schlagen mehrere translationale Ansätze vor: diätetische Strategien zur Erhöhung der Aufnahme oder endogenen Bildung der relevanten Fettsäuren (z. B. durch Präbiotika, Probiotika oder gezielte Lebensmittelbestandteile), nutraceuticale Formulierungen oder kleine Moleküle, die ACOX2 direkt aktivieren oder die Peroxisomenbiogenese in braunen Adipozyten fördern. Jeder dieser Ansätze erfordert strenge präklinische Untersuchungen zur Sicherheit und Wirksamkeit, bevor klinische Studien am Menschen gerechtfertigt sind.
Der leitende Autor Irfan Lodhi, PhD, betonte den therapeutischen Gedankengang: Eine Steigerung peroxisomaler Thermogenese könnte den Ruheenergieverbrauch erhöhen und so das Halten eines Gewichtsverlusts erleichtern. Er wies darauf hin, dass ein solcher Ansatz für manche Personen leichter aufrechtzuerhalten sein könnte als langfristige Kalorieneinschränkung oder intensives Training, weil er den basalen Stoffwechsel moduliert und weniger stark von individualverhaltensbezogenen Änderungen abhängt.
Experimentelle Werkzeuge und eingesetzte Technologien
Zu den zentralen Techniken der Studie gehörten:
- Mouse-Genmodelle mit gewebespezifischem Deletion oder Überexpression von ACOX2 und UCP1, um Ursache-Wirkungs-Beziehungen präzise zu testen.
- Kältereize und standardisierte Kälte-Expositionsprotokolle, die physiologische Thermogenese auslösen.
- Ein fluoreszenter intrazellulärer Hitzesensor, der kleine, lokal begrenzte Temperaturänderungen in braunen Adipozyten nachweist und so direkte Messungen zellulärer Wärmeproduktion erlaubt.
- Infrarot-Thermografie zur Abbildung der Wärmeabgabe aus braunen Fettdepots in lebenden Tieren, was funktionelle Effekte auf Organismusebene sichtbar macht.
- Umfassende metabolische Phänotypisierung, einschließlich Glukose- und Insulintoleranztests sowie Körperzusammensetzungsanalysen unter Hochfettdiätbedingungen.
Diese Methoden ermöglichten es dem Team, molekulare Veränderungen in der Peroxisomenfunktion mit messbaren Effekten auf Energiehaushalt und Glukosestoffwechsel des gesamten Organismus zu verknüpfen. Zusätzlich wurden Kontrollexperimente und Replikate eingesetzt, um die Zuverlässigkeit der Befunde zu erhöhen und mögliche kompensatorische Mechanismen zu prüfen.
Experteneinschätzung
"Diese Forschung fügt unserer Vorstellung von der Plastizität des Fettgewebes eine wichtige Ebene hinzu", sagt Dr. Elena Morales, eine auf Stoffwechselphysiologie spezialisierte Wissenschaftlerin, die nicht an der Studie beteiligt war. "Peroxisomen werden in Diskussionen über Energiebilanz oft übersehen, dabei können sie die zelluläre Brennstoffnutzung nachhaltig umgestalten. Wenn es gelingt, die peroxisomale Aktivität im menschlichen braunen Fett sicher zu modulieren, könnte das einen neuen Weg eröffnen, die metabolische Gesundheit zu unterstützen—und zwar ohne die systemischen Nebenwirkungen, die manche früheren pharmakologischen Interventionen limitiert haben."
Zukünftige Forschungsrichtungen und Herausforderungen
Die Translation dieser Entdeckung in klinisch relevante Ansätze wirft mehrere Fragen auf: Werden menschliche braune Fettdepots ACOX2 in funktionell bedeutsamen Mengen exprimieren? Welche spezifischen diätetischen Fettsäuren oder mikrobiellen Metaboliten aktivieren den Weg am effektivsten? Lassen sich peroxisomenorientierte Therapien gewebespezifisch gestalten, um unerwünschte Effekte etwa in der Leber oder anderen Organen zu vermeiden, in denen peroxisomaler Stoffwechsel essenziell ist?
Um diese Fragen zu beantworten, sind vergleichende Studien an menschlichen Gewebeproben, streng kontrollierte ernährungsinterventionelle Studien und gezielte Medikamentenentwicklung erforderlich, um sichere Aktivatoren von ACOX2 oder Stimulatoren der Peroxisomenbiogenese zu identifizieren. Langfristige Sicherheitsstudien werden besonders wichtig sein, denn eine Veränderung des basalen Energieverbrauchs kann komplexe endokrine und metabolische Folgen nach sich ziehen. Auch mögliche Wechselwirkungen mit anderen Thermogenese-Wegen oder mit systemischen Stressantworten sollten sorgfältig bewertet werden.
Fazit
Die Entdeckung einer ACOX2-abhängigen peroxisomalen Thermogenese im braunen Fett offenbart einen bisher wenig beachteten Mechanismus, durch den Organismen Energie aufwenden und metabolische Gesundheit beeinflussen können. Bei Mäusen verbesserten die Verstärkung dieses Weges Kältetoleranz, Insulinsensitivität und Widerstandsfähigkeit gegen durch Ernährung induzierte Adipositas; der Verlust des Weges zeigte gegenteilige Effekte. Obwohl noch erhebliche Arbeit nötig ist, um das translationale Potenzial für den Menschen zu prüfen, erweitert diese Forschung das Instrumentarium möglicher Interventionen gegen Fettleibigkeit und Stoffwechselkrankheiten. Besonders vielversprechend erscheinen Strategien, die diätisch abgeleitete Fettsäuren, Modulation des Darmmikrobioms oder direkte pharmakologische Aktivierung peroxisomaler Wege nutzen, vorausgesetzt, ihre Sicherheit und Wirksamkeit werden in sorgfältigen Studien bestätigt.
Quelle: scitechdaily


Kommentar hinterlassen