9 Minuten
Neue Analyse verknüpft Blutuntergruppe A1 mit höherem frühem Schlaganfallrisiko
Eine große genetische Analyse, veröffentlicht im Jahr 2022, zeigte, dass Menschen, deren Genom die A1-Blutuntergruppe kodiert, ein leicht erhöhtes Risiko für ischämischen Schlaganfall vor dem 60. Lebensjahr haben. Die Studie fasste Daten aus mehreren internationalen Kohorten zusammen und verglich etwa 17.000 Personen, die zwischen 18 und 59 Jahren einen Schlaganfall erlitten hatten, mit fast 600.000 Schlaganfall-freien Kontrollen. Dabei identifizierten die Forschenden ein reproduzierbares Signal in der Nähe der Gene, die die ABO-Blutgruppen bestimmen, was Hinweise auf einen genetischen Beitrag zur frühen Schlaganfallanfälligkeit liefert.
Studiendesign und wichtigste Ergebnisse
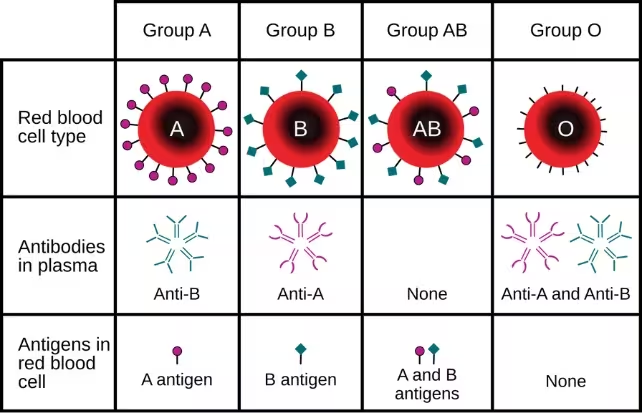
Die Forschenden kombinierten Daten aus 48 genetischen Studien aus Nordamerika, Europa, Japan, Pakistan und Australien. Alle Teilnehmer der Primäranalyse waren zwischen 18 und 59 Jahre alt. Eine genomweite Suche (Genome-Wide Association Study, GWAS) hob zwei genomische Regionen hervor, die mit einem früheren Schlaganfallbeginn assoziiert waren; eine dieser Regionen fällt mit dem ABO-Blutgruppolokus zusammen, der die molekularen Marker auf den roten Blutkörperchen kodiert, mit denen die Typen A, B, AB und O definiert werden. Die Blutgruppe wird teilweise durch die auf den Erythrozyten vorhandenen ABO-Antigene bestimmt.
Gezielte Analysen von ABO-Varianten zeigten, dass Personen, deren DNA die A-Subgruppenvariante A1 anzeigt, ein etwa 16% höheres Risiko hatten, vor dem 60. Lebensjahr einen Schlaganfall zu erleiden, verglichen mit Menschen mit anderen ABO-Genotypen. Im Gegensatz dazu wiesen Träger des O1-Genotyps ein ungefähr 12% geringeres Risiko für frühe Schlaganfälle auf. Die Autorinnen und Autoren betonten, dass diese relativen Risiken moderat sind: In absoluten Zahlen bleibt die erhöhte Wahrscheinlichkeit für eine einzelne Person gering.
Statistisch wurde in der Metaanalyse üblicherweise mit logistischen Regressionsmodellen gearbeitet, wobei Kontrollen für Populationstruktur (z. B. Principal Components), Kohorten-Effekte und relevante Kovariaten vorgenommen wurden, um Verzerrungen zu minimieren. Die Stärke der Untersuchung liegt in der großen Stichprobengröße und der internationalen Zusammensetzung, die es ermöglichte, reproduzierbare Signale zu identifizieren und heterogene Effekte zwischen Kohorten zu prüfen. Dennoch variieren Effektstärken je nach Genotypfrequenz und methodischer Strategie, weshalb eine präzise Quantifizierung mit Konfidenzintervallen und Replikationsanalysen wichtig ist.
Die Forschenden verglichen außerdem genetische Assoziationen bei frühem Schlaganfall (<60 Jahre) mit einem Datensatz von Schlaganfall-Erkrankten über 60 Jahre. Die Beziehung zwischen der A-Subgruppe und Schlaganfall schwächte sich in der Gruppe mit späterem Erkrankungsbeginn ab und wurde statistisch nicht mehr signifikant, was darauf hindeutet, dass für frühe und späte Schlaganfälle unterschiedliche biologische Treiber eine Rolle spielen könnten. Diese Divergenz legt nahe, dass altersabhängige Mechanismen — etwa Gerinnungsneigung versus atherosklerotische Veränderungen — unterschiedlich gewichtet sind.
Darüber hinaus untersuchten die Autorinnen und Autoren mögliche Interaktionen mit bekannten Risikofaktoren. Während die Studie nicht alle potenziellen Moderatorvariablen vollständig aufdecken konnte, ist es plausibel, dass genetische Effekte auf ABO-Basis in Anwesenheit anderer Risiken (z. B. Rauchen, orale Kontrazeption, Adipositas) stärker zum Tragen kommen. Künftige Analysen könnten solche Interaktionen genauer quantifizieren und prüfen, inwieweit ABO-Varianten in Polygenetische Risikomodelle (Polygenic Risk Scores, PRS) integriert werden können.
Biologischer Kontext und mögliche Mechanismen
ABO-Lokus, Gerinnung und Gefäßbiologie
Der ABO-Blutgruppolokus wurde zuvor mit Koronararterienverkalkung, Herzinfarkt und venösen Thromboembolien (Blutgerinnseln in Venen) in Verbindung gebracht. Labor- und epidemiologische Befunde deuten darauf hin, dass ABO-Varianten die zirkulierenden Spiegel von Gerinnungsfaktoren, die Interaktion von Thrombozyten und die Funktion der Endothelzellen, die Blutgefäße auskleiden, beeinflussen können. Insbesondere sind erhöhte Werte von von-Willebrand-Faktor (vWF) und Faktor VIII bei bestimmten ABO-Genotypen beschrieben worden, was die Gerinnungsneigung erhöhen kann. Zudem beeinflussen ABO-Glykosylierungsvarianten die Struktur und den Abbau von Plasmaproteinen, was wiederum Blutfluss, Adhäsion von Zellen und Entzündungsreaktionen modulieren kann.
Auf molekularer Ebene kodiert der ABO-Lokus Glykosyltransferasen, die spezifische Zuckerreste an Proteine und Lipide anhängen. Diese modifizierte Glykosylierung verändert die Halbwertszeit, Bindungseigenschaften und die Clearance bestimmter Plasmaproteine — ein Mechanismus, der plausibel die beobachteten Unterschiede in Gerinnungsmarkern erklärt. Experimentelle Modelle und Proteomik-Studien könnten hier wichtige Einsichten liefern, indem sie zeigen, welche zirkulierenden Proteine durch ABO-abhängige Glykosylierung betroffen sind.
Solche biologischen Pfade sind plausibel, um zu erklären, wie ein A-Typ-Genotyp die Neigung zur Bildung von Blutgerinnseln leicht erhöhen könnte und dadurch das Risiko für einen ischämischen Schlaganfall steigert — insbesondere bei jüngeren Erwachsenen, bei denen atherosklerotische Plaques seltener die primäre Ursache sind. Mechanismen können multifaktoriell sein und genetische Effekte auf Gerinnungsfaktoren, Endothelfunktion und Entzündung umfassen, kombiniert mit Umwelteinflüssen wie Rauchen oder oraler Kontrazeption. Gleichzeitig sind direkte kausale Beweise bislang begrenzt, weshalb funktionelle und experimentelle Studien nötig sind.
Gen-Umwelt-Interaktion und pharmakologische Implikationen
Ein weiterer relevanter Aspekt ist die Frage, ob ABO-assoziierte Risiken durch Verhaltensänderungen oder medikamentöse Maßnahmen modifizierbar sind. Theoretisch könnte eine erhöhte Gerinnungsneigung bei A1-Trägern eine andere Nutzen-Risiko-Bilanz für Antithrombotika nahelegen, doch hierfür existieren derzeit keine direkten randomisierten Daten. Klinische Leitlinien würden solche Empfehlungen nur auf Grundlage robuster Belege, einschließlich prospektiver Interventionsstudien, ändern. Bis dahin bleibt die Priorität, etablierte Risikofaktoren zu kontrollieren.
Beschränkungen, Populationsdiversität und öffentliche Gesundheit
Obwohl die gepoolte Stichprobe groß war, stammten nur etwa 35% der Teilnehmenden aus nicht-europäischer Abstammung. Daher müssen die Ergebnisse in vielfältigeren Populationen repliziert werden, um mögliche genetische Heterogenität und Populationseffekte zu prüfen. Genetische Assoziationen können durch Unterschiede in Allelfrequenzen, Linkage-Disequilibrium-Patterns und Umweltfaktoren variieren, weshalb Replikation in verschiedenen ethnischen Gruppen essenziell ist.
Es besteht zudem die methodische Herausforderung unterschiedlicher Falldefinitionen und Qualitätsunterschiede in der Diagnostik: Einige Kohorten verwendeten bildgebende Bestätigung des Schlaganfalls, andere basierten auf klinischen Befunden oder Krankenhauscodes. Solche Unterschiede können Heterogenität erzeugen und die Vergleichbarkeit beeinträchtigen. Weiterhin ist die Unterscheidung zwischen ischämischem und hämorrhagischem Schlaganfall wichtig, da die biologischen Mechanismen unterschiedlich sind; die hier berichteten Assoziationen beziehen sich auf ischämische Ereignisse.
Die Schlaganfall-Inzidenz ist stark altersabhängig: In den Vereinigten Staaten erleiden jährlich fast 800.000 Menschen einen Schlaganfall, und etwa drei Viertel dieser Ereignisse treten bei Personen im Alter von 65 Jahren und älter auf. Das Schlaganfallrisiko verdoppelt sich grob alle zehn Jahre nach dem 55. Lebensjahr, was die Einordnung eines relativen Anstiegs von etwa 16% bei jüngeren Erwachsenen erleichtert — das absolute Risiko für die meisten Einzelpersonen bleibt weiterhin niedrig. In der klinischen Praxis haben deshalb bekannte Risikofaktoren wie Bluthochdruck, Diabetes, Rauchen, Hyperlipidämie und Vorhofflimmern weiterhin höchste Priorität für Prävention und Management.
Die Studienautorinnen und -autoren raten daher nicht zu zusätzlichen Screenings oder zu einer verstärkten medizinischen Überwachung allein aufgrund des ABO-Blutgruppentyps. Stattdessen fordern sie weitere Forschung, um die Mechanismen zu klären, die ABO-Varianten mit der Gerinnung verbinden, und zu prüfen, ob Blutgruppeninformat ionen jemals die individualisierte Risikoabschätzung neben anderen genetischen und klinischen Markern verfeinern könnten. Solche Untersuchungen sollten funktionelle Studien, Mendelsche Randomisierung und prospektive Kohorten einschließen, um Kausalität und klinische Anwendbarkeit besser zu bewerten.
Aus public-health-Sicht ist es wichtig, genetische Befunde in den Kontext bewährter Präventionsstrategien zu stellen. Selbst wenn ein genetischer Marker das Risiko leicht erhöht, bleibt die effektivste Strategie zur Verringerung des Schlaganfallrisikos weiterhin die Kontrolle modifizierbarer Faktoren und die Stärkung von Präventionsprogrammen in der Allgemeinbevölkerung.
Fachliche Einschätzung
Dr. Maria Santos, Gefäßepidemiologin an einem universitären Medizinzentrum, kommentierte die Bedeutung der Studie: 'Diese Arbeit ist wichtig, weil sie zeigt, wie häufige genetische Variation die Risikoprofile für schwerwiegende Erkrankungen wie Schlaganfall subtil verändern kann. Für Kliniker bleibt die praktische Botschaft unverändert: Der Fokus liegt weiterhin auf der Kontrolle von Blutdruck, Diabetes, Raucherentwöhnung und anderen modifizierbaren Risiken. Für Forschende weist der Befund auf die Gerinnungs- und Gefäßbiologie als Bereiche hin, in denen funktionelle Studien nötig sind, um zu klären, ob gezielte Präventionsstrategien möglich sind.'
Dr. Santos betonte zusätzlich die Bedeutung interdisziplinärer Forschung: 'Um die klinische Relevanz genetischer Marker zu prüfen, brauchen wir integrierte Ansätze — von Genetik über Proteomik bis hin zu klinischen Studien. Nur so lässt sich bestimmen, ob Marker wie ABO den Weg zu einer personalisierteren Prävention ebnen können.' Sie wies auch auf die Bedeutung von Repräsentativität in Genomstudien hin, damit Ergebnisse für alle Bevölkerungsgruppen gelten.
Fazit
Die genetische Metaanalyse von 2022 stärkt die Evidenz dafür, dass vererbliche Variation am ABO-Blutgruppolokus — konkret die A1-Subgruppe — mit einem moderat erhöhten Risiko für ischämischen Schlaganfall vor dem 60. Lebensjahr assoziiert ist, während O1 tendenziell leicht protektiv wirkt. Die Effektgrößen sind klein und rechtfertigen keine Änderungen in der klinischen Diagnostik allein auf Grundlage der Blutgruppe. Zukünftige Studien mit breiterer Abstammungsrepräsentation sowie Laborarbeiten, die biologische Mechanismen testen, sind notwendig, um zu bestimmen, ob der ABO-Genotyp sinnvoll zur personalisierten Schlaganfallprävention beitragen kann.
Letztlich sind diese Ergebnisse ein Baustein in einem komplexen Puzzle: Sie liefern Hinweise auf biologische Pfade, die weiterer Untersuchung bedürfen, aber keine direkte Grundlage für neue klinische Maßnahmen ohne zusätzliche Evidenz. Für die Betroffenen und die medizinische Praxis bleibt die prioritäre Empfehlung unverändert: Maßnahmen zur Kontrolle modifizierbarer Risikofaktoren sind weiterhin der Schlüssel zur Schlaganfallprävention.
Quelle: sciencealert

Kommentar hinterlassen