8 Minuten
Forscher haben eine gemeinsame genetische Architektur identifiziert, die acht wichtige psychiatrische Erkrankungen verbindet. Die Arbeit liefert neue Einsichten, warum diese Erkrankungen oft zusammen auftreten und familiär gehäuft sind, und zeigt genetische Varianten auf, die in verschiedenen Phasen der Gehirnentwicklung und in unterschiedlichen Zelltypen aktiv sind. Solche Erkenntnisse eröffnen Wege zu breit wirkenden Therapieansätzen.
Hintergrund und Studiendesign: Warum diese Untersuchung wichtig ist
Warum das alles zusammenhängt
Psychiatrische Diagnosen überlappen klinisch häufig. Bis zu 70 Prozent der Menschen mit Autismus oder ADHS erfüllen im Verlauf ihres Lebens auch die Kriterien für die jeweils andere Störung. Solche Überschneidungen sind nicht nur klinisch störend, sie weisen darauf hin, dass gemeinsame biologische Mechanismen am Werk sind. Genetische Faktoren können erklären, warum bestimmte Symptome zusammen auftreten oder warum mehrere Familienmitglieder betroffen sind.
Im Zentrum der neuen Studie steht das Prinzip der Pleiotropie: eine einzelne genetische Variante beeinflusst mehrere Merkmale oder Erkrankungen. Anstatt Variationen isoliert zu betrachten, untersuchten die Forschenden, wie pleiotrope Varianten während der Neuroentwicklung wirken, in welchen Zelltypen sie aktiv sind und welche regulatorischen Netzwerke sie beeinflussen. Diese Perspektive verändert die Frage von "Welches Gen verursacht welche Diagnose" hin zu "Welche Netzwerke treiben neuroentwicklungsbedingte Risiken über mehrere Diagnosen hinweg".
Experimenteller Ansatz: Von Genvarianten zu funktionsfähigen Effekten
Das Forscherteam sammelte fast 18 000 genetische Varianten, gewonnen aus bisherigen großangelegten Studien sowohl zu einzelnen Störungen als auch zu gemeinsamen Gen-Sets. Anstatt nur Assoziationen zu berichten, setzten die Wissenschaftlerinnen und Wissenschaftler auf funktionelle Tests: Sie führten diese Varianten in menschliche neuronale Vorläuferzellen ein, also in Zellen, die sich später zu Neuronen differenzieren, und beobachteten, wie sich Genexpression und regulatorische Netzwerke im Verlauf einer simulierten Gehirnentwicklung verändern.
Zusätzlich validierten die Autoren zentrale regulatorische Varianten in entwickelnden Mausneuronen, um zu prüfen, ob die Effekte über Speziesgrenzen hinweg bestehen. Dieser kombinierte Ansatz aus humanen Zellmodellen und tierexperimenteller Bestätigung erhöht die Wahrscheinlichkeit, dass identifizierte Varianten nicht nur statistische Marker, sondern funktional relevant sind.
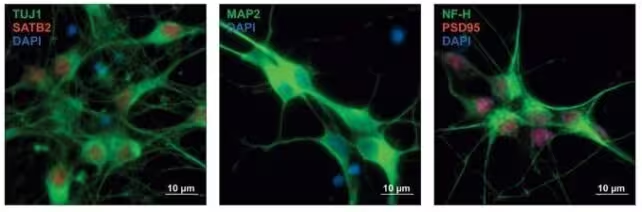
Wesentliche Ergebnisse: Was die Studie entdeckt hat
Die Untersuchung identifizierte 683 Varianten, die die Genregulation in neuronalen Vorläuferzellen verändern. Unter diesen zeigten sich Varianten mit pleiotropen Eigenschaften, die sich in mehreren Merkmalen unterscheiden und erklären helfen, wie eine einzelne genetische Veränderung zu verschiedenen Krankheitsbildern beitragen kann.
- Höhere Vernetzung: Pleiotrope Varianten betreffen Proteine, die deutlich mehr Protein-Protein-Interaktionen eingehen als Varianten, die nur einer Störung zugeordnet sind. Das bedeutet: Eine Veränderung an einem stark vernetzten Protein kann durch das Netzwerk weitreichende Effekte auf viele zelluläre Prozesse haben.
- Breitere Zelltypaktivität: Diese Varianten bleiben in mehreren Gehirnzelltypen aktiv und wirken über längere Entwicklungsfenster. Dadurch steigt die Wahrscheinlichkeit, dass sie aufeinanderfolgende Phasen der Schaltkreisbildung beeinflussen.
- Regulatorische Kaskaden: Pleiotrope Varianten modulieren genregulatorische Mechanismen über verschiedene Entwicklungsstadien. So kann derselbe genetische Effekt je nach Zeitpunkt und Zellkontext zu unterschiedlichen klinischen Erscheinungsbildern führen.
Solche Eigenschaften machen pleiotrope Varianten zu zentralen Hebeln im Netzwerk der neuronalen Entwicklung: Eine Störung an einem Knotenpunkt kann auf mehreren Ebenen sichtbar werden. "Die Proteine, die von diesen Genen produziert werden, sind auch stark mit anderen Proteinen vernetzt", erklärt die Genetikerin Hyejung Won. "Veränderungen an genau diesen Proteinen können durch das gesamte Netzwerk schwingen und möglicherweise weitreichende Folgen für das Gehirn haben."
Technische Details und methodische Stärken
Die Studie kombiniert mehrere methodische Bausteine, die ihre Aussagekraft stärken. Zunächst basiert die Auswahl der Varianten auf umfangreichen genomweiten Assoziationsstudien, wodurch die Kandidatenliste statistisch robust ist. Anschließend wurden die Varianten in gentechnisch manipulierbare menschliche Vorläuferzellen integriert, was direkte Messungen von Genexpression und chromatinbasierten Regulatoren erlaubt. Solche Messungen umfassen unter anderem RNA-Expression, Zugriff auf Chromatin und Bindungsmuster von Transkriptionsfaktoren.
Die Validierung ausgewählter Varianten in Mausmodellen liefert einen zusätzlichen Layer funktionaler Evidenz. Zwar sind tierische Modelle nie vollständig identisch mit dem menschlichen Gehirn, doch über konservierte Entwicklungsprogramme hinweg lassen sich viele Effekte bestätigen. Dadurch reduziert sich das Risiko, dass die in vitro-Beobachtungen rein modellbedingt sind.
Wichtig ist auch das Netzwerkdenken: Die Studie analysiert nicht nur Einzeleffekte, sondern setzt die Varianten in Beziehung zu Protein-Protein-Interaktionsnetzwerken und zu bekannten Signalwegen. Das erlaubt Aussagen darüber, welche Knotenpunkte besonders einflussreich sind und daher potenziell als Therapieziele infrage kommen.
Implikationen für Diagnose, Therapie und Forschung
Die Erkenntnis gemeinsamer genetischer Treiber verändert mehrere Bereiche zugleich. Erstens hat sie Relevanz für die Nosologie, also die klinische Einteilung psychiatrischer Erkrankungen. Wenn unterschiedliche Diagnosen auf gemeinsamen molekularen Pathways beruhen, stellt sich die Frage, ob traditionelle Kategorien immer die beste Grundlage für Forschung und Behandlung sind.
Zweitens eröffnet die Identifikation pleiotroper Varianten therapeutische Chancen. Statt für jede Diagnose völlig unterschiedliche Ziele zu entwickeln, könnten Medikamente oder Interventionen so konzipiert werden, dass sie stabile Netzwerkmechanismen stärken oder fehlgesteuerte regulatorische Kaskaden dämpfen. Solche breit wirksamen Strategien könnten Symptome über mehrere Störungsbilder hinweg lindern.
Drittens hat das große public health-Potenzial: Die Weltgesundheitsorganisation schätzt, dass etwa eine von acht Personen weltweit eine psychiatrische Erkrankung hat, fast eine Milliarde Menschen. Therapieansätze, die gemeinsame Ursachen adressieren, könnten daher eine erhebliche gesundheitsökonomische Wirkung entfalten.
Ein praktisches Beispiel: Wird ein pleiotroper Knotenpunkt identifiziert, der in frühen Entwicklungsphasen die neuronale Konnektivität steuert, könnte eine frühe, zielgerichtete Intervention in der Kindheit das Risiko moderater bis schwerer Verläufe bei mehreren Diagnosen gleichzeitig reduzieren. Solche Interventionen müssten allerdings sehr präzise sein, um unerwünschte Nebenwirkungen im sich entwickelnden Gehirn zu vermeiden.
Limitationen, offene Fragen und nächste Schritte
Trotz der Stärke des integrativen Ansatzes bleiben Fragen offen. Die funktionellen Tests wurden in sich differenzierenden Vorläuferzellen und in Mausneuronen durchgeführt, doch komplexe Verhaltensphänotypen entstehen aus Interaktionen ganzer Netzwerke über lange Zeiträume. Welche Varianten tatsächlich klinisch relevante Effekte bei Menschen haben, muss in weiterführenden, longitudinalen Studien geprüft werden.
Auch die Umwelt bleibt ein entscheidender Faktor. Genetische Varianten können Risiken erhöhen, aber Umweltfaktoren wie frühe Belastungen, Ernährung, Infektionen oder psychosoziale Einflüsse modulieren den Verlauf deutlich. Wie genau Gen-Umwelt-Interaktionen pleiotrope Wirkungen verstärken oder abschwächen, ist eine zentrale Forschungsfrage.
Methodisch gilt es, die Zahl signifikanter Varianten weiter zu reduzieren und diejenigen mit größtem funktionellem Impact zu priorisieren. High-throughput-Funktionsassays, bessere Modelle zur Entwicklung des menschlichen Gehirns und verbesserte Bioinformatik zur Integration von multiomischen Daten werden dabei helfen.
Was das für Kliniker, Forschende und Patienten bedeutet
Für Kliniker ist die Studie ein Hinweis darauf, dass diagnostische Grenzen eventuell fließender sind als gedacht. Behandlungsempfehlungen könnten künftig stärker auf gemeinsamen biologischen Mechanismen basieren und weniger ausschließlich auf symptombasierten Kategorien. Für Forschende bedeutet die Arbeit, dass interdisziplinäre Zusammenarbeit — Genetik, Entwicklungsbiologie, Neurowissenschaft und klinische Forschung — nötig ist, um funktionelle Target-Pfade zu identifizieren und zu prüfen.
Patientinnen und Patienten sowie ihre Familien können Hoffnung schöpfen: Ein besseres Verständnis gemeinsamer biologischer Ursachen kann langfristig zu Therapien führen, die mehrere Symptome gleichzeitig adressieren. Zugleich sollten Erwartungen realistisch bleiben. Translation von genetischer Entdeckung zu sicheren, wirksamen Therapien ist zeitaufwändig und anspruchsvoll.
Die Identifikation pleiotroper Varianten ist ein Meilenstein auf dem Weg zu einer vernetzteren Sicht psychiatrischer Erkrankungen. Indem die Forschung die genetische Basis über Zelltypen und Entwicklungszeiten hinweg entwirrt, entsteht eine detailliertere Landkarte möglicher Eingriffspunkte.
In den kommenden Jahren werden Folgearbeiten notwendig sein, um die Bedeutung einzelner Varianten in verschiedenen Populationen zu überprüfen, mögliche Wirkmechanismen experimentell zu belegen und schließlich therapeutische Konzepte zu entwickeln, die Netzwerke stabilisieren statt nur einzelne Symptome zu behandeln.
Die Studie erweitert somit nicht nur das genetische und entwicklungsbiologische Verständnis verschiedener psychiatrischer Diagnosen. Sie liefert konkrete Ansatzpunkte für funktionelle Studien und legt die Basis für Therapien, die gemeinsame molekulare Pfade modulieren — eine Perspektive, die sowohl Forschung als auch klinische Anwendung nachhaltig beeinflussen kann.
Quelle: sciencealert

Kommentar hinterlassen