10 Minuten
Neue Forschung aus Korea fügt der Debatte um die Darm‑Hirn‑Achse eine überraschende Wendung hinzu: Bakterien, die normalerweise im Mund leben, können den Darm besiedeln, Metaboliten produzieren, die das Gehirn erreichen, und möglicherweise die Parkinson‑Krankheit beschleunigen. Die Studie zeichnet einen biochemischen Weg von oralen Mikroben bis zu neuronalen Schäden nach und zeigt neue Ansatzpunkte für Prävention und Therapie auf.
Die aktuelle Arbeit legt nahe, dass Mikroben, die außerhalb des Gehirns entstehen, die frühesten Stadien neurodegenerativer Erkrankungen beeinflussen können. Indem die Forscher einen biologischen Pfad aufdeckten, der mikrobielle Aktivität mit neuronaler Schädigung verbindet, stellt die Studie traditionelle Vorstellungen zur Entstehung der Parkinson‑Krankheit infrage und erweitert das Verständnis von Risikofaktoren, Biomarkern und möglichen therapeutischen Zielen im Kontext des Darmmikrobioms und der oralen Mikrobiota.
From mouth to gut: how a cavity bug ends up in the brain
Die Parkinson‑Krankheit ist eine progressive neurodegenerative Erkrankung, die sich klinisch durch Tremor, Rigidität, verlangsamte Bewegung (Bradykinesie) sowie durch den zentralen Verlust dopaminproduzierender Neurone im Substantia nigra‑Region des Gehirns auszeichnet. Epidemiologische Untersuchungen haben seit Jahren Unterschiede im Darmmikrobiom von Menschen mit Parkinson im Vergleich zu gesunden Kontrollen gezeigt, doch war es schwierig, kausale Mikroorganismen und zugrundeliegende Mechanismen eindeutig zu identifizieren. Vieles deutet darauf hin, dass nicht nur das Vorhandensein bestimmter Bakterien zählt, sondern auch deren metabolische Aktivität und die Fähigkeit, Moleküle zu produzieren, die systemisch wirken.
In der vorliegenden Studie identifizieren die Autorinnen und Autoren Streptococcus mutans — ein Bakterium, das vielen vor allem durch seine Rolle bei Zahnbelag und Karies bekannt ist — als möglichen Mitverursacher. Die Forschenden fanden erhöhte Konzentrationen von S. mutans im Darm von Parkinson‑Patientinnen und ‑Patienten. Nach der Etablierung im Darm produziert dieser Mikroorganismus ein Enzym namens Urocanat‑Reduktase (UrdA) sowie ein metabolisches Nebenprodukt, das als Imidazolpropionat (ImP) bezeichnet wird. Diese Entdeckung verbindet die orale Mikrobiota direkt mit funktionellen Metaboliten, die systemisch nachweisbar sind.
Die Mechanismen, durch die orale Bakterien im Darm persistieren können, sind vielschichtig: wiederholte orale Verschluckung von Speichel, Änderungen der oralen und intestinalen Ökosysteme durch Antibiotika oder Ernährung, sowie immunologische Nischen im Darm können das Überleben und die Kolonisierung fördern. Zudem können plasmidkodierte Gene oder mobile genetische Elemente die Anpassungsfähigkeit oraler Stämme im intestinalen Milieu erhöhen. Das Zusammenspiel von mikrobieller Besiedelung, metabolischer Aktivität und Wirtsabwehr ist für das Verständnis von Risikofaktoren bei neurodegenerativen Erkrankungen zentral.
A metabolite that crosses borders: ImP and the brain
Imidazolpropionat (ImP) steht im Mittelpunkt der Untersuchung. Die Forscherinnen und Forscher detektierten höhere ImP‑Konzentrationen sowohl im Darm als auch im Blut von Personen mit Parkinson, was auf eine systemische Verteilung dieses Metaboliten hinweist. In kontrollierten Mausmodellen zeigte das Einbringen von S. mutans in den Darm oder die gentechnische Modifikation von Escherichia coli zur Expression von UrdA ebenfalls erhöhte ImP‑Spiegel im Blut und in Gehirngewebe. Diese Experimente etablieren eine Kausalkette: orale Mikroben → Darmkolonisation → UrdA‑vermittelte ImP‑Produktion → systemische Zirkulation und Gehirn‑Akkumulation.
Die biochemischen Veränderungen gingen in den Tiermodellen einher mit Schlüsselmerkmalen der Parkinson‑Pathologie: Verlust dopaminerger Neurone, gesteigerte Neuroinflammation mit erhöhter Mikroglia‑Aktivierung, motorische Defizite in Verhaltensprüfungen sowie vermehrte Aggregation von alpha‑Synuclein — dem Protein, das für die charakteristischen intrazellulären Einschlusskörperchen (Lewy‑Körperchen) in Parkinson‑Gehirnen verantwortlich gemacht wird. Diese Befunde stützen die Hypothese, dass mikrobiell erzeugte Metaboliten neurotoxische Effekte vermitteln können.
Zusätzlich legen metabolomische Analysen nahe, dass ImP in Wechselwirkung mit anderen Stoffwechselwegen steht, die mit Energiestoffwechsel, Proteostase und Entzündungsreaktionen verknüpft sind. Die Frage, wie effektiv ImP die Blut‑Hirn‑Schranke (BHS) überwindet — direkt oder durch Induktion peripherer Entzündungsmediatoren, die wiederum neuroinflammatorische Prozesse anstoßen — bleibt ein zentrales Thema für weitere Studien. In jedem Fall zeigt die Studie, dass ein mikrobiell erzeugter Metabolit eine systemische Spur hinterlassen kann, die bis ins Gehirn nachweisbar ist.
How does ImP harm neurons?
Präklinische Laborbefunde deuten darauf hin, dass die Aktivierung des mTORC1‑Signalkomplexes ein zentraler Schritt in der neurotoxischen Wirkung von ImP sein könnte. mTORC1 (mechanistic target of rapamycin complex 1) ist ein evolutionär konservierter Signalhub, der Zellwachstum, Proteinbiosynthese, Autophagie und Stoffwechsel reguliert. Eine chronische oder fehlregulierte Aktivierung von mTORC1 kann die neuronale Homöostase stören, Autophagie‑Mechanismen hemmen und so die Akkumulation fehlgefalteter Proteine begünstigen — Bedingungen, die die Aggregation von alpha‑Synuclein und damit verbundene neurodegenerative Prozesse fördern.
In den Mausexperimenten führte die pharmakologische Hemmung von mTORC1 zu einer Reduktion neuroinflammatorischer Marker, verringerter Neuronenverluste und einer Verbesserung motorischer Fähigkeiten. Diese Ergebnisse verknüpfen ImP mit einem pharmakologisch angreifbaren Signalweg und bieten einen rationalen Ansatzpunkt für therapeutische Interventionen: entweder upstream (Verringerung von ImP‑Bildung), midstream (Neutralisierung von ImP im Blut), oder downstream (Hemmung von mTORC1 oder Modulation seiner Effektorpfade).
Gleichzeitig ist Vorsicht geboten: mTORC1 reguliert zahlreiche zelluläre Funktionen und eine systemische, langfristige Hemmung kann unerwünschte Effekte haben, darunter Störungen des Stoffwechsels und der Immunantwort. Daher sind gezielte Strategien — beispielsweise brain‑penetrante, aber nur temporär wirkende mTORC1‑Modulatoren, oder interventionsbasierte Ansätze, die spezifisch die ImP‑Produktion blockieren — vielversprechend, müssen aber sorgfältig hinsichtlich Sicherheit und Wirksamkeit geprüft werden.
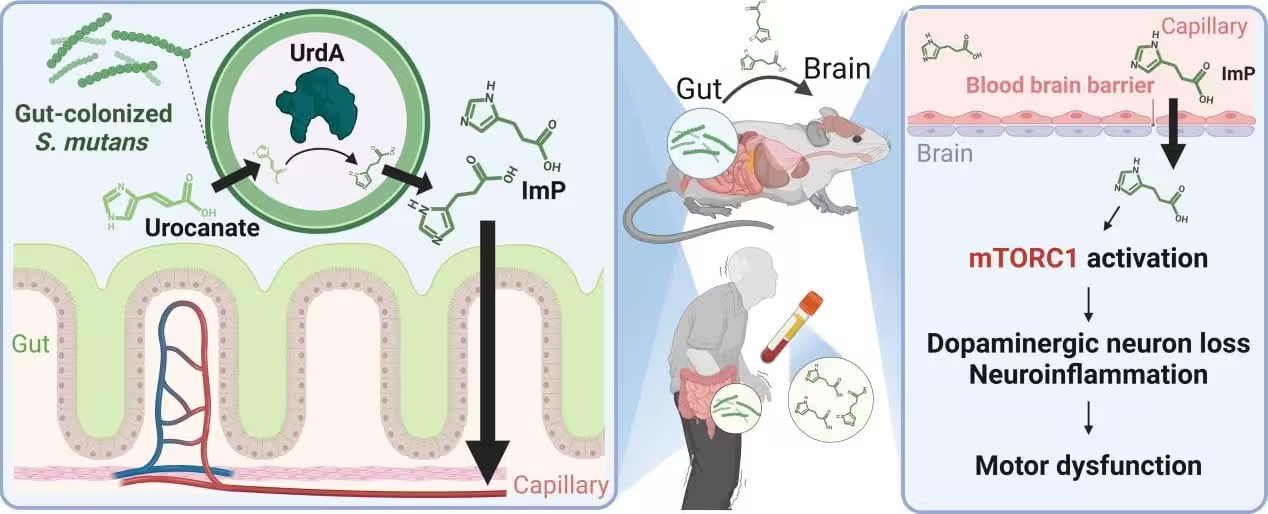
Diagramm zur Anreicherung mikrobieller Metaboliten im Gehirn und zur Induktion parkinsonähnlicher Veränderungen nach Kolonisation des Darms durch orale Bakterien.
What the team did and who led the research
Die Studie ist eine Kooperation unter der Leitung von Professorin Ara Koh und der Doktorandin Hyunji Park aus der Abteilung für Lebenswissenschaften der Pohang University of Science and Technology (POSTECH), mit weiteren Partnern an der Sungkyunkwan University School of Medicine und dem College of Medicine der Seoul National University. Das Forschungsteam kombinierte menschliche Mikrobiom‑Analysen, gezielte und untargeted Metabolomik, molekularbiologische Charakterisierungen und gut kontrollierte Mausmodelle, um den Zusammenhang zwischen oralen Mikroben und Gehirnpathologie experimentell zu verknüpfen. Die vollständigen Ergebnisse wurden in Nature Communications veröffentlicht und durch umfangreiche ergänzende Daten unterstützt, die mikrobiologische Sequenzdaten, Enzymcharakterisierungen von UrdA sowie Verhaltens‑ und Histopathologie in Tiermodellen umfassen.
Methodisch umfasste die Arbeit mehrere Ebenen:
- Analyse klinischer Kohorten: Vergleich des Darm‑ und Blut‑Metaboloms sowie der mikrobiellen Zusammensetzung bei Parkinson‑Patienten und gesunden Kontrollen.
- Molekulare Charakterisierung: Identifizierung und Biochemie der Urocanat‑Reduktase (UrdA) aus S. mutans‑Stämmen sowie die Messung von ImP‑Produktion in vitro.
- Tierexperimentelle Modelle: Orale Verabreichung und intestinale Etablierung von S. mutans in Mäusen sowie gentechnische Expresssion von UrdA in E. coli zur Reproduktion des Phänotyps.
- Pharmakologische Tests: Einsatz von mTORC1‑Inhibitoren zur Bewertung der Reversibilität neuroinflammatorischer und neurodegenerativer Veränderungen.
„Unsere Studie liefert ein mechanistisches Verständnis dafür, wie orale Mikroben im Darm das Gehirn beeinflussen und zur Entstehung der Parkinson‑Krankheit beitragen können“, erklärte Professorin Ara Koh. „Sie unterstreicht das Potenzial, das Darmmikrobiom als therapeutischen Ansatzpunkt zu nutzen und eröffnet neue Richtungen für die Parkinson‑Behandlung.“ Diese Aussage betont sowohl die translationalen Perspektiven als auch die Notwendigkeit weiterer klinischer Validierung.
Implications for prevention and future therapy
Die Implikationen dieser Arbeit sind zweifach und betreffen sowohl Prävention als auch therapeutische Entwicklung. Zum einen könnte eine grundlegende Mundhygiene und Zahngesundheit langfristig wichtiger für die neurologische Gesundheit sein als bisher angenommen — ein einfacher, aber potenziell wirkungsvoller Ansatzpunkt für öffentliche Gesundheitsmaßnahmen. Maßnahmen wie regelmäßige zahnärztliche Kontrolle, Interventionsstrategien gegen Karies und gezielte Aufklärung zur oralen Hygiene könnten, als Teil einer ganzheitlichen Präventionsstrategie, das Risiko mikrobieller Darmbesiedelung reduzieren.
Zum anderen eröffnet die Identifizierung von ImP und des Enzyms UrdA klare therapeutische Optionen, die weiter erforscht werden sollten:
- Prävention der mikrobiellen Kolonisation: Strategien zur Verhinderung der Ansiedlung oraler Stämme im Darm, etwa durch Probiotika, Präbiotika, gezielte antibiotische Strategien oder durch microbiome‑engineering, das competitive exclusion fördert.
- Hemmung von UrdA: Entwicklung kleiner Molekül‑Inhibitoren oder Antikörper, die die Funktion der Urocanat‑Reduktase blockieren und so die ImP‑Bildung direkt reduzieren.
- Neutralisierung von ImP: Einsatz von Bindemitteln, Enzymen oder Antagonisten, die ImP entschärfen oder dessen biologische Aktivität im Blut mindern.
- Modulation von mTORC1: Therapeutische Modulation des mTORC1‑Pfads in einem für das zentrale Nervensystem verträglichen Rahmen, entweder mittels selektiver Inhibitoren oder pathway‑spezifischer Modulatoren, um neuroprotektive Effekte zu erzielen.
Wichtig ist, dass diese Ansätze jeweils Chancen und Risiken bergen. Antibiotische Maßnahmen können das Ökosystem Darm nachhaltig stören; Probiotika und Präbiotika benötigen präzise Charakterisierung, um Effektivität zu gewährleisten; und mTORC1‑Modulation erfordert eine sorgfältige Balance zwischen neuroprotektion und systemischer Sicherheit. Klinische Studien werden erforderlich sein, um Wirksamkeit, Dosierung und Langzeitsicherheit zu klären.
Die Studie hebt zudem die Komplexität der Darm‑Hirn‑Achse hervor: Mikroben, die in einem Körperareal entstehen (Mund), können ein anderes Areal (Darm) besiedeln und Metaboliten produzieren, die systemisch wirken und entfernte Organe wie das Gehirn beeinflussen. Dieses vernetzte Verständnis ist für die Entwicklung integrierter Präventions‑ und Therapieprogramme essenziell, die Zahnmedizin, Mikrobiomforschung und Neurologie zusammenbringen.
Expert Insight
Dr. Lena Rothman, Neuroimmunologin an einem großen medizinischen Zentrum (unabhängig kommentierend), sagte: „Dieses Paper verbindet elegant Kolonisation, Metabolitproduktion und einen definierten Signalkanal. Obwohl Mausmodelle nicht vollständig die menschliche Erkrankung abbilden, geben die Identifizierung von ImP und die Verbindung zu mTORC1 den Forschenden konkrete Ziele — sowohl für Biomarker als auch für therapeutische Interventionen.“
Zukünftige Forschung muss klären, wie verbreitet eine S. mutans‑Kolonisation des Darms in unterschiedlichen Populationen ist, ob ImP‑Spiegel das Erkrankungsrisiko oder den Krankheitsverlauf zuverlässig vorhersagen, und welche Interventionen beim Menschen sicher und effektiv sind. Wichtige offene Fragen sind zudem:
- Gibt es genetische oder umweltbedingte Faktoren, die eine intestinale Etablierung oraler Bakterien begünstigen?
- Welche Rolle spielen Ernährung, Medikation (z. B. Protonenpumpenhemmer), und allgemeine Immunkompetenz bei der Übertragung oraler Stämme in den Darm?
- Lassen sich ImP oder UrdA als Biomarker für Frühstadien oder Progression der Parkinson‑Krankheit validieren?
Während diese Fragen beantwortet werden, erhöht die Studie den Druck, Mundgesundheit, Mikrobiomwissenschaft und Neurologie enger zu verknüpfen — sowohl in der Forschung als auch in der klinischen Praxis. Ein multidisziplinärer Ansatz kann dazu beitragen, neue Präventionsstrategien und Therapien zu entwickeln, die auf mikrobiell vermittelte Mechanismen abzielen, um neurodegenerative Prozesse zu verlangsamen oder zu verhindern.
Quelle: scitechdaily


Kommentar hinterlassen