8 Minuten
Stellen Sie sich einen winzigen molekularen Schalter im Knochenmark vor, der umspringt, wenn Sie gehen, joggen oder eine Einkaufstüte heben — und dieser Umschlag macht Ihre Knochen stärker. Genau das berichten Forschende jetzt: ein Protein, das mechanische Kraft erkennt und Stammzellen dazu lenkt, Knochen statt Fett zu bilden.
Das Protein, Piezo1 genannt, wirkt in knochenmark‑mesenchymalen Stammzellen (BMMSCs), den flexiblen Vorläufern, die sich entweder zu Osteoblasten — den Zellen, die neue Knochenmatrix ablagern — oder zu Adipozyten, Fettzellen, differenzieren können. Wie diese Stammzellen ihr Schicksal wählen, hängt von chemischen Signalen, Hormonen, Entzündungsfaktoren und, entscheidend, von mechanischen Kräften ab. Seit Jahrzehnten ist bekannt, dass körperliche Aktivität BMMSCs zugunsten der Knochenbildung beeinflusst, doch die molekularen Details blieben diffus. Die neue Studie eines Teams unter Leitung der Universität Hongkong identifiziert Piezo1 als einen zentralen Mechanosensor in diesem Prozess und liefert dabei konkrete molekulare Verknüpfungen.
Entfernt man Piezo1 bei Mäusen, kippt das Gleichgewicht. Die Knochen werden dünner, weniger Osteoblasten entstehen, und Fettzellen sammeln sich im Knochenmark an. Bewegung führt dann nicht mehr zur üblichen Zunahme der Knochenmineraldichte. Die in der Studie verwendeten Tiermodelle zeigen: Piezo1 ist kein peripherer Nebendarsteller, der nur leise mitspielt — das Protein ist direkt in Signalkaskaden involviert, die das Zellschicksal bestimmen.
Die Forschenden verfolgten die molekularen Spurenelemente stromabwärts von Piezo1, um die Signalwege zu identifizieren, die mechanische Belastung mit zellulären Entscheidungen verbinden. Wenn Piezo1 aktiv ist, scheint es entzündliche Signalwege zu dämpfen, die andernfalls BMMSCs in Richtung Adipogenese (Fettbildung) umlenken würden. Fehlt Piezo1 oder ist es inaktiv, steigen entzündliche Signale an und das Mark wird aufnahmefähiger für Fettablagerungen, während die Knochenbildung parallel abnimmt. Wichtig: Die Wiederherstellung der Piezo1‑Aktivität oder die Korrektur stromabwärts liegender Signale kehrte diese Veränderungen in den Mausmodellen um.
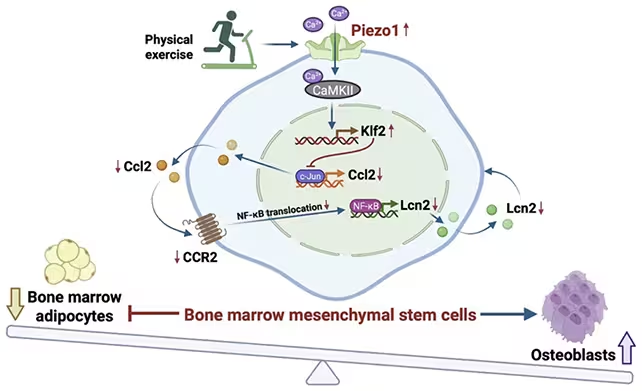
Das Aktivieren von Piezo1 oder seines downstreamen Signalwegs könnte die durch Bewegung ausgelöste Knochenbildung bei Mäusen nachahmen.
Diese Forschungsrichtung eröffnet eine provokante Möglichkeit: Könnte man eines Tages ein "Übungsmimetikum" entwickeln — ein Medikament, das das Knochenmark so täuscht, als stünde der Körper unter mechanischer Belastung, selbst wenn Bewegung eingeschränkt ist? Für ältere Menschen, gebrechliche Patientinnen und Patienten oder Betroffene, die an das Bett gebunden sind, wäre eine Therapie, die einige der molekularen Vorteile von Bewegung reproduziert, transformativ. Der Weg von Maus zu Medizin ist jedoch lang, komplex und mit wissenschaftlichen und regulatorischen Hürden gepflastert.
Was die Experimente zeigten und warum es wichtig ist
Die Forschung nutzte gezielte genetische Manipulationen, um Piezo1 in BMMSCs von Mäusen zu entfernen, und verglich Knochenstruktur, zelluläre Zusammensetzung und Reaktion auf körperliche Aktivität mit Kontrolltieren. Der Verlust von Piezo1 führte zu messbaren Abnahmen der Knochenmineraldichte (BMD) und zu reduzierten Markern der Knochenbildung. Gleichzeitig zeigte das mikroarchitektonische Milieu des Markraums eine vermehrte Zahl an Adipozyten und erhöhte Spiegel entzündlicher Mediatoren.
Methodisch kombinierten die Autorinnen und Autoren histologische Untersuchungen, µCT‑Bildgebung zur Analyse der Mikroarchitektur, Durchflusszytometrie zur Charakterisierung von Zellpopulationen und molekulare Assays (z. B. qPCR, Western Blot) zur Quantifizierung von Differenzierungs‑ und Entzündungsmarkern. Solche multimodalen Ansätze erlauben es, Zusammenhänge zwischen mechanischer Belastung, zellulärer Zusammensetzung und Signalwegaktivität robust darzustellen. Die Autoren berichten weiterhin, dass durch die Re‑Aktivierung von Piezo1‑Signalen die Zusammensetzung des Markraums und die knochenbildenden Antworten wiederhergestellt wurden, was die kausale Rolle von Piezo1 unterstreicht.
Aus molekularer Sicht legt die Studie nahe, dass Piezo1 mechanische Reize in biochemische Signale übersetzt, die mehrere Effektorwege modulieren können: Hemmung pro‑inflammatorischer Pfade (z. B. NF‑κB‑assoziierte Signale), positive Beeinflussung pro‑osteogener Transkriptionsfaktoren (wie RUNX2 und Osterix in der Literatur oft genannt) und möglicherweise Interaktionen mit etablierten Mechanotransduktionsmodulen wie YAP/TAZ oder Wnt/β‑Catenin. Die genaue Reihenfolge und Interaktion dieser Pfade erfordern noch weitere Validierung, doch die Kartierung dieses Netzwerks liefert die molekulare Vokabel, die Wirkstoffentwicklerinnen und ‑entwickler benötigen, um gezielte Interventionen zu entwerfen.
Gleichzeitig stellt Piezo1 eine therapeutische Herausforderung dar: Das Ionenkanalprotein ist nicht ausschließlich im Knochenmark vorhanden. Piezo1 vermittelt Mechanosensitivität auch in Blutgefäßen, Lunge, Haut und anderen Geweben. Daher muss jede pharmakologische Strategie äußerst präzise sein — idealerweise in Form einer Gewebe‑ oder zelltypspezifischen Modulation von Piezo1‑Aktivität oder durch Steuerung nur dieser Signalachsen im Knochenmilieu, um off‑target Effekte zu vermeiden.
Die Studie, erschienen in Signal Transduction and Targeted Therapy, liegt an der Schnittstelle von Mechanobiologie und regenerativer Medizin. Sie rückt Osteoporose — die häufig als Folge hormoneller Dysbalancen oder Kalziumverlusten betrachtet wird — zusätzlich in ein Licht, in dem gestörte mechanische Signalgebung eine zentrale Rolle spielt. Diese Perspektive erweitert das therapeutische Spektrum: Neben systemischen Medikamenten kommen lokal wirkende Biomaterialien, mechanische Stimulationsverfahren oder zielgerichtete Signalmodulatoren als ergänzende Strategien in Frage.
Experteneinschätzung und klinische Perspektive
„Diese Forschung entschlüsselt, wie mechanische Signale im Markraum in zelluläre Entscheidungen übersetzt werden“, sagt Xu Aimin, eine biomedizinische Wissenschaftlerin, die an der Studie beteiligt war. „Piezo1 verhält sich wie ein molekulares Ohr für Bewegung, und nun kennen wir einen Teil der Sprache, die es spricht. Dieses Wissen ist essentiell, wenn wir die Effekte von körperlicher Aktivität auf zellulärer Ebene nachbilden wollen.“
Mechanobiologe Eric Honoré, Letztautor der Studie, ergänzt die klinische Perspektive: „Wenn wir diesen Signalweg sicher ansteuern können, könnten wir Menschen schützen, die nicht trainieren können, vor fortschreitendem Knochenschwund und Frakturen. Das Potenzial ist real, aber Vorsicht ist geboten — Piezo1 erfüllt viele Funktionen im Körper, und unerwünschte Effekte sind eine ernsthafte Sorge.“
Die Translation in die Klinik wird sorgfältige Pharmakologie, gewebespezifische Wirkstoffabgabesysteme und letztlich kontrollierte Humanstudien erfordern. Erste Ansätze könnten auf lokalem Wirkstoffauftrag basieren — etwa Medikamente oder biomimetische Materialien, die in der Nähe von Frakturstätten, Implantaten oder in orthopädischen Verfahren appliziert werden, um systemische Exposition zu minimieren. Andere Strategien zielen darauf ab, Moleküle zu entwickeln, die selektiv Piezo1‑Interaktionen im Knochen stabilisieren oder stattdessen stromabwärts liegende entzündliche Mediatoren modulieren, ohne den Kanal selbst breit zu aktivieren.
Technische und regulatorische Herausforderungen
Mehrere technische Hürden sind zu überwinden: gezielte Wirkstoffabgabe, dosiskontrollierte Aktivierung mechanosensitiver Kanäle, Langzeit‑Sicherheitsdaten und die Vermeidung von Effekten auf Vasculatur oder Atmungsorgane, in denen Piezo1 ebenfalls aktiv ist. Präklinische Studien müssen Sicherheitsprofile in mehreren Tierarten zeigen und potenzielle Interaktionen mit bestehenden Knochenmedikamenten (z. B. Bisphosphonate, Denosumab, Teriparatid) prüfen. Regulatorisch wird die Bewertung eines Übungsmimetikums besondere Aufmerksamkeit erhalten, da hier physiologische Signalwege künstlich moduliert werden.
Außerdem ist die Übersetzbarkeit von Mausmodellen auf den Menschen nie garantiert. Unterschiede in Knochenumbau‑Raten, Immunantworten und der Verteilung von Zelltypen im Knochenmark können Ergebnisse verändern. Klinische Studien müssten daher sorgfältig konzipiert sein, mit sowohl radiologischen Endpunkten (BMD, Mikroarchitektur) als auch funktionellen Ergebnissen (Sturz‑ und Frakturraten, Mobilität) und Biomarkern für Entzündung und Osteoblastenaktivität.
Potentielle therapeutische Ansätze
Konkrete Ansätze, die aus diesen Erkenntnissen abgeleitet werden könnten, umfassen:
- Lokale Aktivatoren: Arzneimittel, die gezielt nahe der betroffenen Knochenregion freigesetzt werden, beispielsweise in Beschichtungen für Implantate oder in injizierbaren Matrices.
- Stromabwärtsmodulatoren: Substanzen, die entzündliche Pfade dämpfen oder osteogene Transkriptionsprogramme fördern, ohne Piezo1 direkt zu aktivieren, um systemische Risiken zu verringern.
- Biomaterialien mit mechanischen Reizen: Implantate oder Matrizes, die physikalische Signale in situ liefern und so Piezo1‑Aktivierung lokal verstärken.
- Gentherapeutische Ansätze: In Zukunft könnten gezielte Gentherapien dafür eingesetzt werden, Piezo1‑Expression in spezifizierten Zellpopulationen zu modulieren, was jedoch umfangreiche Sicherheitsstudien erfordert.
Jeder dieser Pfade bringt spezifische Entwicklungs‑ und Zulassungsherausforderungen mit sich, aber zusammen bilden sie ein diversifiziertes Arsenal an Strategien, um mechanotransduktive Anomalien im Knochen zu adressieren.
Öffentliche Gesundheit, Prävention und Ausblick
Für die öffentliche Gesundheit bleibt die klarste Botschaft unverändert: Körperliche Aktivität ist vorteilhaft für die Knochengesundheit. Regelmäßige Belastung durch Gewichtstraining, Gehen, Treppensteigen oder andere mechanische Reize fördert die Knochenstärke und reduziert das Frakturrisiko. Dennoch ist es ebenso wichtig, die Möglichkeiten für Menschen zu erweitern, die sich nicht ausreichend bewegen können.
Die Kartierung der molekularen Mechanik von Bewegung bietet einen vielversprechenden Umweg: Wenn wir verstehen, welche Signalwege bei mechanischer Belastung aktiviert werden, können wir gezielt Technologien und Therapeutika entwickeln, die diese Effekte teilweise nachahmen. Die Entdeckung von Piezo1 als zentralem Akteur ist eine Kompassnadel in diesem Feld — sie zeigt auf neue therapeutische Ziele, die helfen könnten, das alternde Skelett zu schützen und Frakturrisiken in gefährdeten Gruppen zu senken.
Trotz aller Hoffnungen bleibt viel zu prüfen. Der Schritt von Tiermodellen zu wirksamen und sicheren Humantherapien ist kompliziert. Studien zu Wirkmechanismen, Gewebespezifität, Nebenwirkungsprofilen und Langzeitfolgen sind unerlässlich. Doch der große Vorteil dieser Forschung ist, dass sie nicht nur ein neues Ziel liefert, sondern auch eine systematische Roadmap zur Entwicklung zusätzlicher Strategien: gezielte Medikamente, biomimetische Materialien, lokale Stimulationstechnologien und kombinatorische Therapien mit bereits etablierten Medikamenten.
Das Wissen, wo man suchen muss, verändert vieles — und es könnte der erste Schritt sein, Knochen die Fähigkeit zurückzugeben, auf Bewegung zu „antworten“, selbst wenn der Körper nicht in der Lage ist, diese Bewegung auszuführen.
Quelle: sciencealert

Kommentar hinterlassen