8 Minuten
Nicht jedes Neuron im Gehirn von Alzheimer-Patienten ergibt sich. Einige halten stand. Sie überleben die biochemische Belagerung, während benachbarte Zellen unter der Last fehlgefalteter Proteine zusammenbrechen. Diese Widerstandsfähigkeit war lange eine Kuriosität; nun hat eine CRISPR-gestützte Suche in menschlichen Neuronen ein molekulares Team aufgedeckt, das toxisches Tau aktiv markiert und entfernt, bevor es eine Zelle ersticken kann.
Verborgene Verteidiger in menschlichen Neuronen
Tau-Proteine sind doppelte Agenten. In gesunden Zellen stabilisieren sie Mikrotubuli und helfen beim Transport von Nährstoffen und Organellen entlang der Axone. Verliert Tau jedoch seine korrekte Konformation, haften die Moleküle aneinander und bilden Aggregate, die mit einer zunehmenden Neurodegeneration korrelieren. Das Ausmaß der Tau-Klumpung steht in direktem Zusammenhang mit dem Schweregrad bei Alzheimer, frontotemporaler Demenz und verwandten Erkrankungen.
Um herauszufinden, warum einige Neurone der toxischen Umwandlung von Tau widerstehen, gingen Forscherteams von UCLA Health und UCSF einen ambitionierten Weg: ein genomweites CRISPR-Screening in Neuronen, die aus menschlichen Stammzellen gezüchtet wurden. Dabei handelte es sich nicht um generische Laborneurone. Diese Zellen trugen eine tatsächlich krankheitsverursachende Mutation, MAPT V337M, die bekannt dafür ist, Tau in die schädliche "Alzheimer-Faltung" zu bringen. Das ist wichtig: Zellen mit echtem pathogenetischem Hintergrund zeigen Mechanismen, die mit höherer Wahrscheinlichkeit beim Menschen relevant sind als Ergebnisse aus künstlichen Systemen.
"Wir haben menschliche Neurone verwendet, die eine echte krankheitsverursachende Mutation tragen", erklärte Avi Samelson, Erstautor der Studie und Assistenzprofessor bei UCLA Health. "Diese Zellen weisen von Natur aus Unterschiede in der Tau-Verarbeitung auf, was uns Vertrauen gibt, dass die identifizierten Mechanismen für die menschliche Erkrankung relevant sind."
Wie das Screening funktionierte
Praktisch setzten die Forscher etwa 20.000 Gene nacheinander außer Kraft und beobachteten, welche Veränderungen Tau anfälliger oder resistenter für Aggregation machten. Die Dimension war beachtlich: Über tausend Gene beeinflussten die Tau-Akkumulation, was auf Signalwege hinweist, die in genetischen Assoziationsstudien allein übersehen worden wären. Das ist die Stärke funktioneller Screens — es zählt nicht nur, welche Gene vorhanden sind, sondern was sie in Neuronen tatsächlich bewirken.
Martin Kampmann, Seniorautor der Studie an der UCSF, betonte die Neuheit des Ansatzes: "Zum ersten Mal konnten wir menschliche Neurone daraufhin screenen, welche Gene ihre Resilienz gegenüber Tau bestimmen." Unter diesem funktionalen Blickfeld trat ein unerwarteter Akteur hervor: ein Ubiquitin-Ligase-Komplex, bezeichnet als CRL5SOCS4.
CRL5SOCS4 agiert wie ein Qualitätskontrollvorarbeiter. Es heftet molekulare Markierungen — Ubiquitin-Moleküle — an aberrantes Tau und kennzeichnet die Proteine zur Zerstörung durch das Proteasom, die Recycling-Maschine der Zelle für Proteine. Zellen, die in postmortalen menschlichen Gehirngeweben höhere CRL5SOCS4-Expression zeigten, wiesen im Seattle Alzheimer's Disease Brain Atlas auch eine größere Überlebensrate auf, wodurch die in vitro-Entdeckung wieder mit menschlicher Krankheit verknüpft wurde.
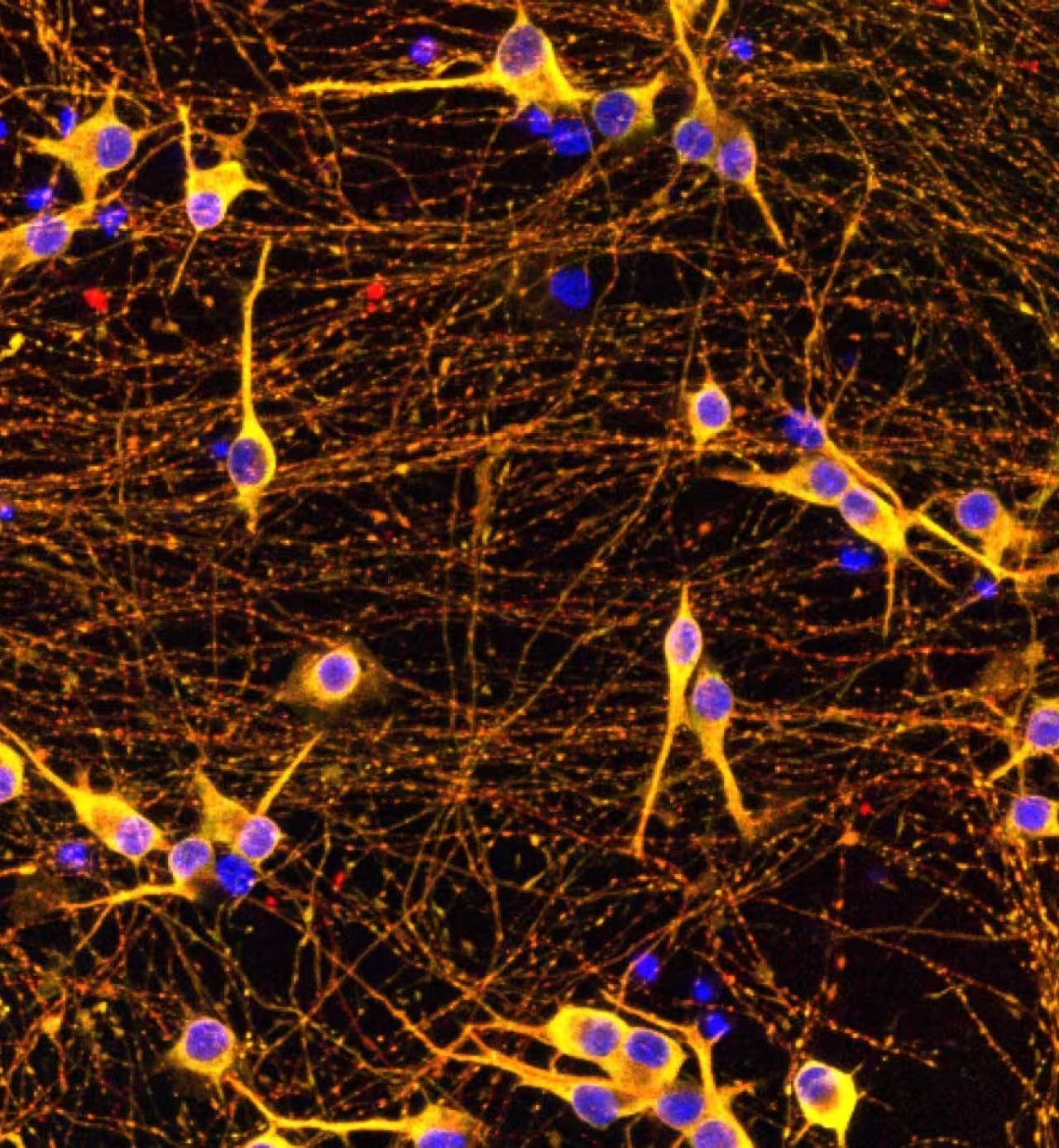
Verbindungen zu Mitochondrien, oxidativem Stress und Biomarkern
Nicht alle Tau-Probleme gehen direkt von den Tau-Genen aus. Das Screening identifizierte auch mitochondriale Gene. Werden mitochondriale Funktionen beeinträchtigt, produzieren Neurone Tau-Fragmente — kleine Stücke des Proteins, die denen ähneln, die im Blut und in der Liquorflüssigkeit von Patientinnen und Patienten als sensitive Biomarker für Alzheimer gemessen werden. Warum ist das so? Defekte Mitochondrien erhöhen während der Energieproduktion oxidativen Stress; oxidativer Schaden scheint Tau anfälliger für Brüche und Aggregation zu machen.
Man kann sich Proteasomen wie den Aktenvernichter in einer Fabrik vorstellen. Wenn dieser Schredder durch oxidativen Stress überhitzt oder blockiert, stapeln sich markierte Proteine. Die Studie zeigte, dass Proteasom-Dysfunktion ein handhabbares Problem in eine Kaskade verwandelt: fehlverarbeitete Tau-Fragmente akkumulieren, wirken als Keime für Aggregate und beschleunigen neuronalen Schaden.
Über die Bestätigung bekannter Pfade hinaus deckte das Screening überraschende Regulatoren der Tau-Level auf — molekulare Straßen, die Forscher detailliert entschlüsseln müssen, um genau zu verstehen, wie sie die Aggregation modulieren. Die Ergebnisse verweben mehrere Fäden: genetische Anfälligkeit, Proteinhomöostase (Proteostasis), Energiestoffwechsel und die zelluläre Reaktion auf oxidativen Stress.
Technisch betrachtet liefert das Finden mitochondrialspezifischer Gene zusätzliche Mechanismen, die erklären, weshalb systemische Metabolismusstörungen oder altersbedingte Mitochondrien‑Defizite das Risiko für neurodegenerative Erkrankungen erhöhen können. Klinische Biomarker wie Phospho‑Tau (pTau) und bestimmte Tau‑Fragmente im Serum oder Liquor spiegeln diese zellulären Prozesse wider und gewinnen damit an diagnostischem und prognostischem Wert.
Therapeutische Möglichkeiten und praktische Hürden
Die unmittelbare therapeutische Idee ist naheliegend: die körpereigene Gefahrstofftruppe stärken. Ein Weg ist, die Aktivität von CRL5SOCS4 zu erhöhen, sodass Tau ubiquitiniert und zum Proteasom geleitet wird, bevor es toxische Klumpen bildet. Ein anderer Ansatz zielt darauf ab, Proteasomen vor oxidativem Schaden zu schützen, sodass das zelluläre Entsorgungssystem auch unter Stress weiterarbeitet.
Wie könnte das in der Praxis funktionieren? Kleine Moleküle, die die Interaktion zwischen CRL5SOCS4 und Tau stabilisieren, könnten die Clearance von Tau erhöhen. Antioxidative Strategien, die gezielt Proteasomen schützen, oder mitochondriale Therapien, die die Produktion reaktiver Sauerstoffspezies (ROS) reduzieren, könnten die Entstehung aggregationsfreudiger Tau-Fragmente vermindern. Beide Strategien bringen jedoch erhebliche Herausforderungen mit sich: Spezifität gegenüber dem Zielprotein, effiziente Verabreichung über die Blut‑Hirn‑Schranke und die Vermeidung unerwünschter Auswirkungen auf den allgemeinen Proteinumsatz.
Zusätzlich zur medikamentösen Stabilisierung von E3‑Ligase‑Komplexen wie CRL5SOCS4 sind biologische Ansätze denkbar, etwa gerichtete Proteinspezifische Ubiquitin‑Ligase‑Modulatoren oder PROTAC‑ähnliche Moleküle (Proteolysis Targeting Chimeras), die Tau selektiv an das zelluläre Abbausystem koppeln. Solche Strategien müssen jedoch strikt reguliert werden, um Off‑Target‑Degradation zu vermeiden, die gesundes Proteinfunktionsnetzwerk stören könnte.
Ein weiterer praktischer Hinderungsgrund ist die Heterogenität der Tau‑Pathologie: verschiedene Tau‑Isoformen, post‑translationalen Modifikationen (z. B. Phosphorylierung, Acetylierung) und unterschiedliche Faltungskonformationen erfordern möglicherweise kombinatorische Therapien. Die Optimierung einer Therapie, die nicht nur ein Aggregat entfernt, sondern die proteostatischen Kapazitäten der Zelle stärkt, ist komplex, aber vielversprechend.
Die Studie betont eine weitergehende Lehre: Die menschliche Biologie kodiert oft bereits elegante Verteidigungsmechanismen. Anstatt komplett neue Maschinen zu erfinden, könnte man therapeutisch das verstärken, was die Evolution hinterlassen hat — gezielt, subtil und potenziell verträglicher.
Experteneinschätzung
"Dieses Paper verbindet ein leistungsstarkes funktionales Screening mit krankheitsrelevanten menschlichen Zellen", bemerkt Dr. Elena Ruiz, Neurobiologin an einem großen Forschungskrankenhaus, die nicht an der Studie beteiligt war. "Der translationale Schritt — also vom Gen‑Hit hin zu kleinen Molekülen, die CRL5SOCS4 verstärken oder Proteasomen schützen — wird schwierig sein, aber er ist fokussierter als zu versuchen, jedes Aggregate nach seiner Bildung wieder zu entfernen."
Es besteht natürlich Dringlichkeit. Die Alterung der Bevölkerung macht wirksame Interventionen gegen Demenz zu einer vorrangigen öffentlichen Gesundheitsaufgabe. Forschung ist ein Prozess des Siebens: Welche molekularen Hebel bewegen die Nadel in einem Maße, das pharmakologisch adressierbar ist, ohne unerwünschte Nebeneffekte? Dieses Screening weist auf mehrere vielversprechende Hebel hin. Die nun folgende Arbeit muss diese Hebel in sichere, zielgerichtete Interventionen übersetzen und in präklinischen Modellen sowie klinischen Studien testen, ob das Verstärken natürlicher Resilienzen den klinischen Abbau verzögern oder verhindern kann.
Zusätzlich sind Langzeitfolgen und Sicherheit zentral: Die Modulation von Ubiquitin‑Systemen oder Proteasomen darf nicht zur Dysregulation zellulärer Protein‑Homeostase führen. Deshalb sind robuste Biomarker, pharmakokinetische Optimierung und zielgerichtete Lieferplattformen (z. B. Nanotechnologie, virale Vektoren mit neuronaler Spezifität) notwendig, um den therapeutischen Index zu maximieren.
Schließlich liefert die Studie auch einen methodischen Mehrwert: Das kombinierte Verwenden von CRISPR‑Screens in humanen, krankheitsrelevanten Zellen schafft einen Wegweiser für zukünftige funktionelle Genomik‑Projekte zur Alzheimer‑Forschung, Parkinson‑Erkrankung und anderen Proteopathien. Indem man Gene identifiziert, die Resilienz vermitteln, öffnet man die Tür zu Präventionsstrategien — nicht nur zu reaktiven Behandlungen.
Zusammengefasst bieten diese Ergebnisse eine Blaupause: systematische funktionelle Genomik in relevanten menschlichen Zelltypen kann unerkannte Schutzmechanismen enthüllen, die sich pharmakologisch nutzbar machen lassen. Zu den nächsten Schritten gehören die Validierung der Hits in In-vivo‑Modellen, die Strukturaufklärung von CRL5SOCS4‑Tau‑Interaktionen und die Entwicklung sicherer Moleküle, die diese Interaktionen modulieren. Wenn diese Wege erfolgreich sind, könnten sie neue therapeutische Ansätze gegen Alzheimer und verwandte Tauopathien eröffnen — Ansätze, die weniger auf das Entfernen bestehender Aggregate abzielen als darauf, die natürliche Fähigkeit der Zelle zur Prävention von Aggregate‑Bildung zu stärken.
Quelle: sciencealert

Kommentar hinterlassen