8 Minuten
Eine kleine klinische Studie in den USA deutet darauf hin, dass zwei wiederverwendete Medikamente — ein Diabetespräparat und ein intranasal appliziertes Insulinspray — möglicherweise sicher Indikatoren für die Gehirngesundheit bei Menschen mit Risiko für die Alzheimer-Krankheit verbessern können. Die Studie konzentrierte sich auf metabolische und neurovaskuläre Messgrößen, die mit frühem kognitiven Abbau verknüpft sind, und lieferte ermutigende Signale, die größere und längere Studien rechtfertigen.
Warum Forschende Stoffwechsel und Durchblutung anvisierten
Alzheimer und verwandte Demenzen sind biologisch komplex; eine erfolgreiche Therapie wird wahrscheinlich mehrere komplementäre Strategien erfordern. Anstatt ausschließlich späte Merkmale wie ausgeprägte Amyloidablagerungen anzugreifen, testete die Studie Interventionen, die den zellulären Stoffwechsel, Entzündungsprozesse und die zerebrale Durchblutung beeinflussen — Prozesse, die weiter stromaufwärts liegen und die Widerstandsfähigkeit von Neuronen erhöhen können.
Die Fokussierung auf Metabolismus und neurovaskuläre Gesundheit folgt dem zunehmenden Verständnis, dass Insulinresistenz im Gehirn, gestörte Glukoseversorgung, mitochondrialer Stress und vaskuläre Dysregulation frühe Treiber der Neurodegeneration sein können. Durch gezielte Modulation dieser Pfade ließe sich die synaptische Funktion erhalten, die Energieeffizienz steigern und schädliche entzündliche Reaktionen begrenzen — Ansätze, die komplementär zu amyloid- oder tauzentrierten Therapien wirken könnten.
Die beiden getesteten Interventionen und ihre Wirkprinzipien
Die beiden untersuchten Interventionen waren Empagliflozin, ein etabliertes Medikament aus der Klasse der SGLT2-Inhibitoren, das primär zur Behandlung von Typ-2-Diabetes und kardiovaskulären Erkrankungen eingesetzt wird, sowie ein intranasales Insulinspray, das Insulin direkt in das zentrale Nervensystem bringen soll. Beide Substanzen verfolgen unterschiedliche, potenziell synergetische Mechanismen.
Empagliflozin vermindert die Rückresorption von Glukose und Natrium in den Nieren, was zu einer Reduktion des systemischen Glukosestoffwechsels, einer Senkung des Zellstresslevels und einer Abschwächung entzündlicher Signalwege führen kann. Zusätzlich gibt es Hinweise darauf, dass SGLT2-Inhibitoren metabolische Anpassungen wie eine verstärkte Ketonkörperbildung und eine Verbesserung der mitochondrialen Effizienz fördern, was für neuronale Energieversorgung vorteilhaft sein kann.
Intranasal verabreichtes Insulin zielt darauf ab, zerebrale Insulinresistenz zu überwinden — ein zunehmend diskutierter Faktor beim kognitiven Abbau. Durch die direkte Abgabe über die Nasenschleimhaut kann Insulin schneller und zielgerichteter das Gehirn erreichen, ohne systemische Hypoglykämierisiken deutlich zu erhöhen. Im Zentralnervensystem unterstützt Insulin synaptische Plastizität, Glukoseaufnahme in Neuronen, die Regulation von Neuroinflammation und die Aufrechterhaltung normaler vaskulärer Funktionen.
Aufbau der Studie und Teilnehmer
Die Phase-II-Sicherheitsstudie rekrutierte 47 Erwachsene im Alter von 55 bis 85 Jahren; 42 Teilnehmende schlossen das vierwöchige Protokoll ab. Einschlusskriterien umfassten Personen mit leichter kognitiver Beeinträchtigung (MCI) oder leichter Demenz sowie kognitiv normale Freiwillige, die auf Biomarker-Ebene molekulare Hinweise auf Alzheimer aufwiesen (z. B. veränderte CSF- oder Blutmarker).
Die Probanden wurden randomisiert auf vier Gruppen verteilt: alleinige Behandlung mit Empagliflozin, alleinige Anwendung des intranasalen Insulinsprays, kombinierte Therapie beider Interventionen oder Placebo. Da das primäre Ziel dieser frühen Studie die Beurteilung von Sicherheit und Verträglichkeit über einen kurzen Zeitraum war, war sie nicht darauf ausgelegt, eindeutige Wirksamkeitseffekte nachzuweisen. Dennoch sammelten die Forschenden ein breites Spektrum an Biomarkern und Bildgebungsergebnissen, um frühe Trends zu identifizieren.
Zu den erhobenen Parametern zählten Liquoruntersuchungen (CSF-Assays für Tau-Proteine, phosphoryliertes Tau, Amyloid-β), neuropsychologische Tests (Gedächtnis, exekutive Funktionen), strukturelle und funktionelle MRT-Analysen (z. B. weiße Substanz-Konnektivität mittels DTI), Messungen der zerebralen Durchblutung (ASL-MRT), sowie Serumwerte zu Lipiden, Cholesterin und Entzündungsmarkern (z. B. CRP, Interleukine).
Zentrale Ergebnisse: Signale bei Tau, Kognition und Durchblutung
Obwohl die Unterschiede zwischen den Behandlungsarmen angesichts der geringen Stichprobengröße und der kurzen Behandlungsdauer statistisch nicht in allen Fällen signifikant waren, ergaben sich mehrere auffällige Muster. Teilnehmerinnen und Teilnehmer, die nur Empagliflozin erhielten, zeigten tendenzielle Verringerungen der CSF-Tau-Werte — eines Proteins, das sich im Verlauf der Alzheimer-Krankheit zu toxischen Fibrillen und Neurofibrillenverwicklungen anreichern kann — sowie Verbesserungen in Durchblutungsmessungen und bestimmten Lipidparametern, die mit Demenzrisiken verknüpft sind.
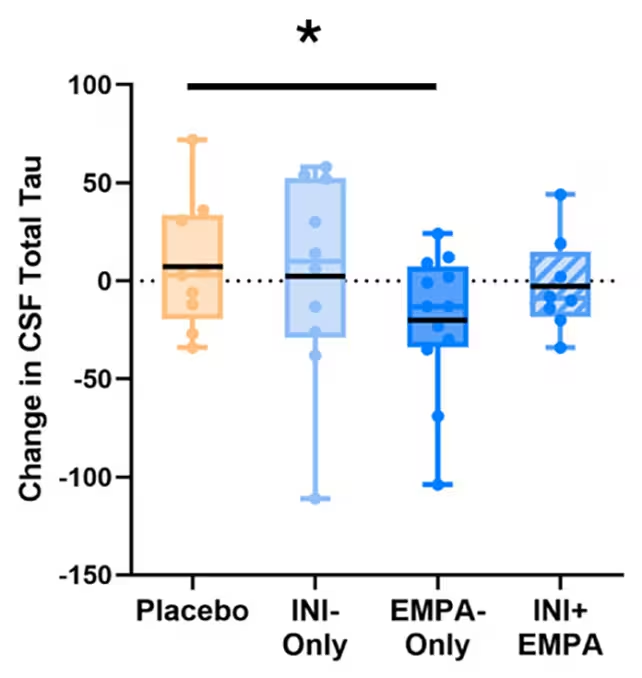
Einer der beobachteten Vorteile unter Empagliflozin (EMPA-Only) war ein Hinweis auf weniger Tau-Anreicherung im Liquor (CSF). (Erichsen et al., A&D, 2025)
Die Probanden, die intranasales Insulin erhielten, erzielten bessere Werte in Gedächtnis- und exekutiven Funktionstests über den kurzen Beobachtungszeitraum. Bildgebende Befunde dieser Gruppe zeigten zudem verbesserte Integrität der weißen Substanz und erhöhte Perfusion in Hirnarealen, die an Gedächtnisprozessen beteiligt sind. Diese Ergebnisse stehen im Einklang mit früheren Studien, die eine Verbindung zwischen Insulinsignalgebung, synaptischer Funktion und neurovaskulärer Gesundheit nahelegen.
In der kombinierten Behandlungsgruppe wurden in einigen Messungen synergetische Trends beobachtet, z. B. kombinierte Verbesserung von Metabolitprofilen, moderatem Rückgang proinflammatorischer Marker und positiven Veränderungen in funktionellen Konnektivitätsmaßen. Solche Signale sind jedoch vorläufig und als Hypothesenbildend zu verstehen.
Wie die Medikamente zusammenwirken könnten
Die Ergebnisse unterstützen ein Modell, in dem die Modulation des systemischen Stoffwechsels und gezielte neuroendokrine Unterstützung komplementäre Wirkungen entfalten. Empagliflozin reduziert offenbar systemische Entzündungsreaktionen und zellulären Stress, was Prozesse verlangsamen könnte, die die Tau-Pathologie fördern. Gleichzeitig scheint intranasales Insulin direkt neuronalen Stoffwechsel, synaptische Funktion und immunregulatorische Mechanismen im Gehirn zu unterstützen.
Zusammen könnten beide Interventionen ein Gleichgewicht herstellen: einerseits das Anheben schützender zellulärer Reaktionen (z. B. bessere Energieversorgung, reduzierte oxidative Schäden) und andererseits das Vermeiden schädlicher neuroinflammatorischer Überreaktionen. Mechanistisch lässt sich dies durch Effekte auf mitochondriale Effizienz, Ketone als alternative Energiequelle, Modulation von Mikroglia-Aktivität und verbesserte vaskuläre Autoregulation erklären.
Aus Sicht der Therapieentwicklung ist die Kombinationstherapie besonders attraktiv, weil sie mehrere pathophysiologische Achsen gleichzeitig adressiert: metabolische Dysregulation (Glukosestoffwechsel, Insulinsignalgebung), vaskuläre Komponenten (zerebrale Perfusion, endotheliale Funktion) und immunologische Aspekte (chronische low-grade Entzündung). Solche Mehrfachansätze können in frühen Krankheitsstadien sinnvoller sein als Monotherapien, die nur einen Biomarker angreifen.
Sicherheit, Verträglichkeit und methodische Grenzen
In dieser kurzen Studie wurden keine schwerwiegenden unerwünschten Ereignisse berichtet, und beide Behandlungsformen wurden über alle Altersgruppen und klinischen Subtypen hinweg toleriert. Die intranasale Insulinapplikation zeigte keine relevanten systemischen Hypoglykämien in der untersuchten Population, und Empagliflozin entsprach erwartungsgemäß dem bekannten Sicherheitsprofil der Substanzklasse.
Die Autoren betonen jedoch mehrere Limitationen: die geringe Stichprobengröße, die kurze Beobachtungszeit von nur vier Wochen und die explorative Natur zahlreicher Biomarkerendpunkte. Solche Einschränkungen reduzieren die Aussagekraft bezüglich klinischer Wirksamkeit; die Ergebnisse müssen daher als vorläufige Signale interpretiert werden. Statistisch robuste Schlussfolgerungen zu kognitiven Endpunkten, Verlängerung der Zeit bis zur manifesten Demenz oder krankheitsmodifizierenden Effekten erfordern deutlich größere und länger angelegte randomisierte Studien.
Weitere methodische Fragen betreffen die externe Validität (z. B. Repräsentativität der Kohorte hinsichtlich Komorbiditäten, Ethnizität und medikamentöser Vorbehandlung), die Wahl und Standardisierung von Biomarkern (p-Tau181 vs. p-Tau217, Aβ42/40-Verhältnis) sowie die Sensitivität bildgebender Verfahren zur Detektion früher Veränderungen. All diese Aspekte sollten in Folgeuntersuchungen berücksichtigt werden.
Nächste Schritte: Vergrößerung der Studien und Kombinationsansätze
Die Untersuchenden planen, diese Therapien in größeren Kohorten mit längerer Nachbeobachtung zu testen, um Effekte auf Kognition, funktionellen Abbau und validierte Biomarker der Alzheimer-Krankheit quantifizieren zu können. Ziel wären randomisierte, placebokontrollierte Phase-IIb/III-Studien mit ausreichender Power, längeren Behandlungs- und Beobachtungszeiträumen sowie vordefinierten klinischen Endpunkten.
Die Perspektive, ein zugelassenes Diabetesmedikament und ein zielgerichtetes Insulin-Delivery-Device für die Neurodegenerationsforschung zu repurposen, ist attraktiv: Beide Interventionen haben bereits etablierte Sicherheitsdaten, was die klinische Entwicklung beschleunigen könnte, sofern die Wirksamkeit in späteren Studien bestätigt wird. Pragmatismus der Medikamentenentwicklung (Repurposing) und die Nutzung bestehender Zulassungsdaten können unter gewissen Voraussetzungen die Zeit bis zur patientennahen Anwendung verkürzen.
Wichtig sind außerdem Biomarker-gestützte Selektionskriterien für Teilnehmende (z. B. Kombination aus positiver Amyloid- bzw. Tau-Biomarkerlage und vaskulären Risikofaktoren), adaptive Studiendesigns zur Effizienzsteigerung und die Integration digitaler Outcome-Maße zur sensitiven Erfassung kognitiver Veränderungen im Alltag.
Fachliche Einschätzung
Dr. Maria Alvarez, Neurologin und klinische Forscherin, die nicht an der Studie beteiligt war, kommentierte: "Diese Studie ist ein Beispiel für pragmatische, mechanismusgetriebene Forschung. Frühes Anvisieren von Stoffwechsel- und Gefäßgesundheit ist physiologisch gut begründet. Die Signale sind moderat, aber konsistent genug, um größere Studien zu rechtfertigen, die den realen Nutzen prüfen können."
In der Gesamtschau unterstreichen die Ergebnisse Stoffwechsel- und neurovaskuläre Gesundheit als handlungsfähige Felder im Kampf gegen Alzheimer und eröffnen einen Weg für Kombinationstherapien, die früher in der Krankheitskaskade intervenieren. Entscheidende nächste Schritte sind die Replikation dieser Befunde in unabhängigen Kohorten, die längere Behandlung und bessere Stratifizierung von Patientengruppen, um Subpopulationen mit dem größten potenziellen Nutzen zu identifizieren.
Für Forschende, Klinikerinnen und politische Entscheidungsträger bleibt die Balance zwischen Innovationsdrang und methodischer Strenge zentral: Nur robuste, gut designte klinische Studien können zeigen, ob modulierende Ansätze des Stoffwechsels und gezielte Insulinlokalisation tatsächlich die Prävalenz und den Verlauf der Alzheimer-Krankheit beeinflussen können. Bis dahin sind diese Ergebnisse ein vielversprechender, aber vorläufiger Schritt in Richtung neuer therapeutischer Strategien.
Quelle: sciencealert

Kommentar hinterlassen