8 Minuten
Rheumatoide Arthritis (RA) kann sich bereits lange vor der sichtbaren, schmerzhaften Gelenkschwellung ankündigen. Neue Forschungen zeigen, dass charakteristische Veränderungen des Immunsystems — nachweisbar im Blut Jahre vor dem Auftreten klinischer Synovitis — eine stille Phase markieren, in der autoimmunologische Aktivität allmählich zunimmt. Das frühzeitige Erkennen dieser Biomarker könnte Vorhersagen verbessern, eine frühere Behandlung ermöglichen und so das gelenkzerstörende Fortschreiten verhindern, das RA definiert.
Hintergrund: stille Autoimmunität und ACPAs
Die rheumatoide Arthritis ist eine Autoimmunerkrankung, bei der das Immunsystem Strukturen in und um die Gelenke angreift. Dies führt zu chronischer Entzündung, Schmerzen und fortschreitender Gelenkzerstörung, die langfristig Funktion und Lebensqualität stark beeinträchtigen kann. Klinisch erkennbare Gelenkentzündung wird als Synovitis bezeichnet. Bevor eine Synovitis jedoch klinisch auffällt, tragen manche Menschen bereits spezifische Autoantikörper im Blut, die als anticitrullinierte Proteinantikörper (ACPAs) bekannt sind.
ACPA-Positivität erhöht das Risiko für die Entwicklung einer RA deutlich, doch nicht alle ACPA-positiven Personen bekommen unmittelbar eine aktive Erkrankung. Die biologischen Zwischenschritte, die aus einer zunächst „stillen“ Autoimmunität eine manifeste rheumatoide Arthritis machen, blieben bislang unklar. Deshalb ist die Identifizierung früher, vorhersehbarer Immunzeichen wichtig: Sie würde nicht nur das Verständnis der Pathogenese vertiefen, sondern auch die Grundlage für präventive klinische Studien liefern.
Biologisch gesehen deuten ACPAs auf eine fehlgeleitete B-Zell-Antwort hin, die citrullinierte Selbstproteine erkennt. Diese Antikörper allein erklären aber nicht vollständig, warum bei einigen Menschen eine progressive Entzündung entsteht. Zusätzliche Faktoren wie genetische Prädisposition (z. B. HLA-DRB1-„shared epitope“), Umwelteinflüsse (Rauchen, Mikrobiomveränderungen) und systemische Entzündungssignale scheinen die Übergangsphase zur klinischen RA zu steuern.
Studienaufbau und Methoden
Ein US-amerikanisches Forschungsteam unter Beteiligung des Allen Institute for Immunology, der University of California San Diego und der University of Colorado Anschutz verfolgte eine Kohorte ACPA-positiver Personen, um die zeitliche Abfolge immunologischer Veränderungen vor der Manifestation der RA zu kartieren. Die untersuchte Kohorte umfasste 45 als „gefährdet“ eingestufte Personen aufgrund vorhandener ACPAs im Blut; 16 von ihnen entwickelten später eine klinisch diagnostizierte RA. Vergleichsdaten gesunder Kontrollen lieferten Referenzpunkte.
Die Forscher kombinierten mehrere Analyseebenen: Blutproteomik zur quantitativen Messung entzündlicher Proteine, zelluläres Profiling von Immunzellen (Flow-Zytometrie, Mass-Cytometry/ CyTOF oder Single-Cell-Ansätze je nach Probe) sowie funktionelle Tests von B- und T-Lymphozyten. Dieser Multi-Omics-Ansatz ermöglichte es, nicht nur einzelne Marker, sondern ganze Aktivierungsmuster und Signalnetzwerke zu identifizieren und so eine zeitliche Abfolge immunologischer Aktivierung in der Risiko- oder Präklinischen Phase zu erstellen.
Technisch beinhaltete die Proteomik breit angelegte, gezielte Immunoassays und Massenspektrometrie-basierte Messungen, um Zytokine, Chemokine und andere Entzündungsmediatoren mit hoher Sensitivität zu quantifizieren. Parallel dazu gaben Phänotypisierungen der B- und T-Zellen Aufschluss über Reifungsstadien, Aktivierungsmarker (z. B. CD69, HLA-DR), Kostimulatorische Moleküle sowie die Expression regulatorischer Marker. Funktionelle Tests bewerteten Antikörperproduktion, Antigenpräsentation und T-Zell-Helferfunktionen ex vivo.
Die Kombination dieser Datensätze erlaubte eine robuste zeitliche Zuordnung: Welche Signale zuerst ansteigen, welche Zelltypen „vorgeladen“ sind und welche Moleküle als frühe Prädiktoren für den Übergang zur klinischen RA in Frage kommen.
Wesentliche Entdeckungen
Die Studie entdeckte einen klaren Anstieg entzündlicher Proteine und eine gesteigerte immunologische Aktivität bei ACPA-positiven Teilnehmern im Vergleich zu Kontrollen. Dabei waren besonders Proteine, die sowohl angeborene als auch adaptive Immunantworten vermitteln, vermehrt vorhanden und biologisch aktiver. Dies schloss klassische Entzündungsmediatoren ein, aber auch Typ-I-Interferon-assoziierte Signaturen und verschiedene Chemokine, die Zellrekrutierung ins Gewebe unterstützen.
Das zelluläre Profil zeigte, dass sowohl B-Zellen (die Antikörper produzieren) als auch T-Zellen (die B-Zell-Antworten unterstützen und regulieren) zu einem stärker „vorbereiteten“ oder aktivierbaren Zustand verschoben waren. Konkret nahm die Frequenz von T- und B-Zellen mit proinflammatorischem Potenzial zu, während Zellen mit antiinflammatorischen oder regulativen Phänotypen teilweise abnahmen oder funktionell beeinträchtigt erschienen. Bemerkenswert war, dass manche T-Zell-Subpopulationen, die normalerweise weniger entzündlich sind, in Richtung einer entzündungsfördernden Rolle umprogrammiert wurden.
Diese Veränderungen traten schrittweise auf und verstärkten sich, je näher eine Person dem Zeitpunkt der klinischen Diagnose kam. Das heißt: Die immunologischen Vorzeichen waren messbar und zwar oftmals Jahre vor dem Auftreten offensichtlicher Gelenkentzündung. Interessanterweise gab es Überschneidungen zwischen Personen, die später RA entwickelten, und jenen, die nicht konvertierten — ein Hinweis darauf, dass mehrere Faktoren (quantitativ und qualitativ) zusammenkommen müssen, damit die Krankheit klinisch manifest wird.
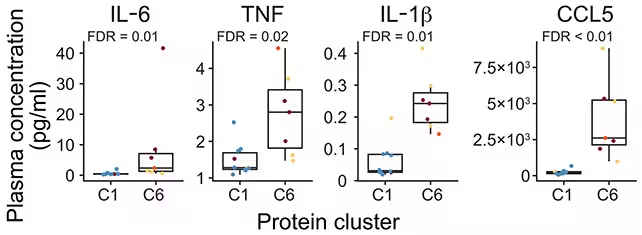
Entzündungsproteine waren in einer Gruppe (vorwiegend Personen mit erhöhtem Arthritisrisiko, Cluster C6) in höherer Konzentration vorhanden. (He et al., Sci. Transl. Med., 2025)
Die herausgearbeitete Signatur klärt, wie die Risiko-Phase biologisch in die klinische Erkrankung überführt werden kann: Ein Netzwerk aus erhöhten Entzündungsmediatoren, veränderten B- und T-Zell-Phänotypen und verstärkter zellulärer Kommunikation erzeugt eine anfällige Umgebung, in der Schutzmechanismen versagen und Synovitis entsteht. Die Autoren fassen zusammen, dass ‚unsere Ergebnisse das Konzept stützen, dass die inflammatorische Erkrankung der RA lange vor dem Auftreten aktiver Synovitis beginnt, früher als klinisch bisher angenommen.‘
Folgen für Diagnose und Therapie
Die Erkenntnis, welche immunologischen Signale einen Fortschritt zur RA ankündigen, eröffnet mehrere praktische Möglichkeiten. Erstens könnten Panels aus entzündungsassoziierten Proteinen und immunzellulären Markern die Risikostratifizierung bei ACPA-positiven Personen deutlich verfeinern. Statt allein auf Antikörperstatus zu vertrauen, lassen sich Kombinationen aus Biomarkern entwickeln, die die Vorhersagegenauigkeit erhöhen und helfen, Patienten für präventive Studien auszuwählen.
Zweitens eröffnet die Identifizierung einer therapeutischen ‚Präklinik‘ ein Zeitfenster, in dem gezielte Interventionen Synovitis und irreversible Gelenkschäden möglicherweise verhindern oder zumindest verzögern könnten. Ein Beispiel ist Abatacept, ein Immunmodulator, der bereits in bestimmten Hochrisiko-Szenarien eingesetzt wird und Hinweise darauf liefert, dass Aspekte der in dieser Studie beschriebenen Immunaktivierung umkehrbar sein können. Abatacept wirkt als CTLA-4-Ig-Fusionsprotein, das die kostimulatorische Aktivierung von T-Zellen über CD80/CD86 blockiert — ein Mechanismus, der primär frühe T-Zell-vermittelte Schritte dämpft und so downstream B-Zell-Aktivierung und Antikörperbildung reduzieren kann.
Präventive Therapieansätze werfen jedoch komplexe Fragen auf: Wer soll behandelt werden, mit welchem Risiko-Nutzen-Verhältnis und über welchen Zeitraum? Die neuen Biomarker könnten hier als Entscheidungsgrundlage dienen. Zudem könnten zielgerichtete Therapien, etwa gegen spezifische Zytokine oder Signalpfade, die in der Proteomik als früh erhöht erkannt wurden, noch selektiver und mit weniger Nebenwirkungen als breit wirkende Immunsuppressiva eingesetzt werden.
Darüber hinaus bieten die Befunde Chancen für die Entwicklung nicht-pharmakologischer Präventionsstrategien. Lifestyle-Faktoren wie Rauchstopp, Anpassungen des Mikrobioms oder gezielte Impf- bzw. Ernährungsinterventionen könnten synergistisch mit biomarkergesteuerten Ansätzen wirken und das individuelle Risiko reduzieren.
Kevin Deane, Rheumatologe an der CU Anschutz, wird in den Studienberichten mit der Einschätzung zitiert, dass diese Ergebnisse ‚weitere Studien unterstützen könnten, um besser vorherzusagen, wer RA entwickeln wird, mögliche biologische Zielstrukturen zur Prävention zu identifizieren und Wege zur Verbesserung bestehender Therapien aufzuzeigen.‘ Solche Folgestudien sind essenziell, um prädiktive Modelle zu validieren und Therapiealgorithmen für die präklinische Phase zu etablieren.
Limitationen und offene Fragen
Trotz der Stärken dieser Multi-Omics-Studie gibt es wichtige Einschränkungen: Die Fallzahl ist relativ begrenzt, und die Kohorte stammte aus spezifischen Forschungszentren, was die Übertragbarkeit der Ergebnisse auf andere Populationen mit unterschiedlicher genetischer oder umweltbedingter Zusammensetzung einschränken kann. Ebenso sind die beobachteten Signaturen zwar statistisch signifikant und biologisch plausibel, müssen jedoch in größeren, unabhängigen Kohorten reproduziert werden, bevor sie in klinische Routinen überführt werden können.
Ein weiterer Punkt betrifft Kausalität: Assoziationen zwischen Biomarkern und Krankheitsprogression beweisen noch nicht, dass jene Marker ursächlich für die Entstehung der RA sind. Interventionelle Studien, in denen gezielt in die entdeckten Signalwege eingegriffen wird, sind notwendig, um kausale Zusammenhänge zu prüfen.
Zudem bleibt die Frage offen, wie präzise die Vorhersage für einzelne Patienten sein kann. Während gruppenbasierte Signaturen wertvoll sind, erfordert die klinische Anwendung prädiktiver Tests für einzelne Personen hohe Sensitivität und Spezifität, um Überbehandlung zu vermeiden und Patienten korrekt zu identifizieren.
Ausblick
Die Studie legt ein solides Fundament für die Weiterentwicklung präklinischer RA-Diagnostik und präventiver Strategien. Zukünftige Arbeiten sollten größere, ethnisch diverse Kohorten einschließen, longitudinale Proben über längere Zeiträume sammeln und noch engere Integration von Proteomik, Genetik, Transkriptomik und Immunzell-Phänotypisierung anstreben. Solche integrierten Modelle könnten Resilienz- versus Progressionsfaktoren besser unterscheiden und personalisierte Risikoprofile ermöglichen.
Auf therapeutischer Ebene sind randomisierte, kontrollierte Studien notwendig, um zu testen, ob frühzeitige, biomarker-getriebene Interventionen das Fortschreiten zur Synovitis und irreversiblem Gelenkschaden tatsächlich verhindern. Gleichzeitig ist die Entwicklung standardisierter, kosteneffizienter Tests für die klinische Routine ein praktisches Ziel, damit Erkenntnisse aus der Forschung auch realweltlich zugänglich werden.
Fazit
Diese Forschung skizziert eine präklinische Phase der rheumatoiden Arthritis, die durch steigende entzündliche Proteine und zunehmend aktivierte B- und T-Zellen charakterisiert ist. Obwohl therapeutische Entscheidungen auf Grundlage dieser Biomarker weitere randomisierte Studien erfordern, verschiebt die Identifizierung messbarer Frühzeichen das Feld hin zu proaktiven, präventiven Strategien. Solche Ansätze könnten langfristig dazu beitragen, die Schmerzen, Funktionseinschränkungen und Behinderungen, die mit RA verbunden sind, deutlich zu reduzieren.
Quelle: sciencealert

Kommentar hinterlassen