9 Minuten
Forscherinnen und Forscher des Institute for Neurosciences (IN), einem gemeinsamen Zentrum des spanischen Nationalen Forschungsrats (CSIC) und der Universidad Miguel Hernández de Elche (UMH), berichten, dass der Körper zwei molekular unterschiedliche Systeme zur Erkennung von Kälte verwendet. Die Haut verlässt sich überwiegend auf den Ionenkanal TRPM8, während innere Organe wie Lunge und Magen primär auf TRPA1 angewiesen sind. Diese Aufteilung erklärt, warum eine kalte Brise, eisige Atemluft und ein sehr kaltes Getränk so unterschiedliche Empfindungen auslösen.
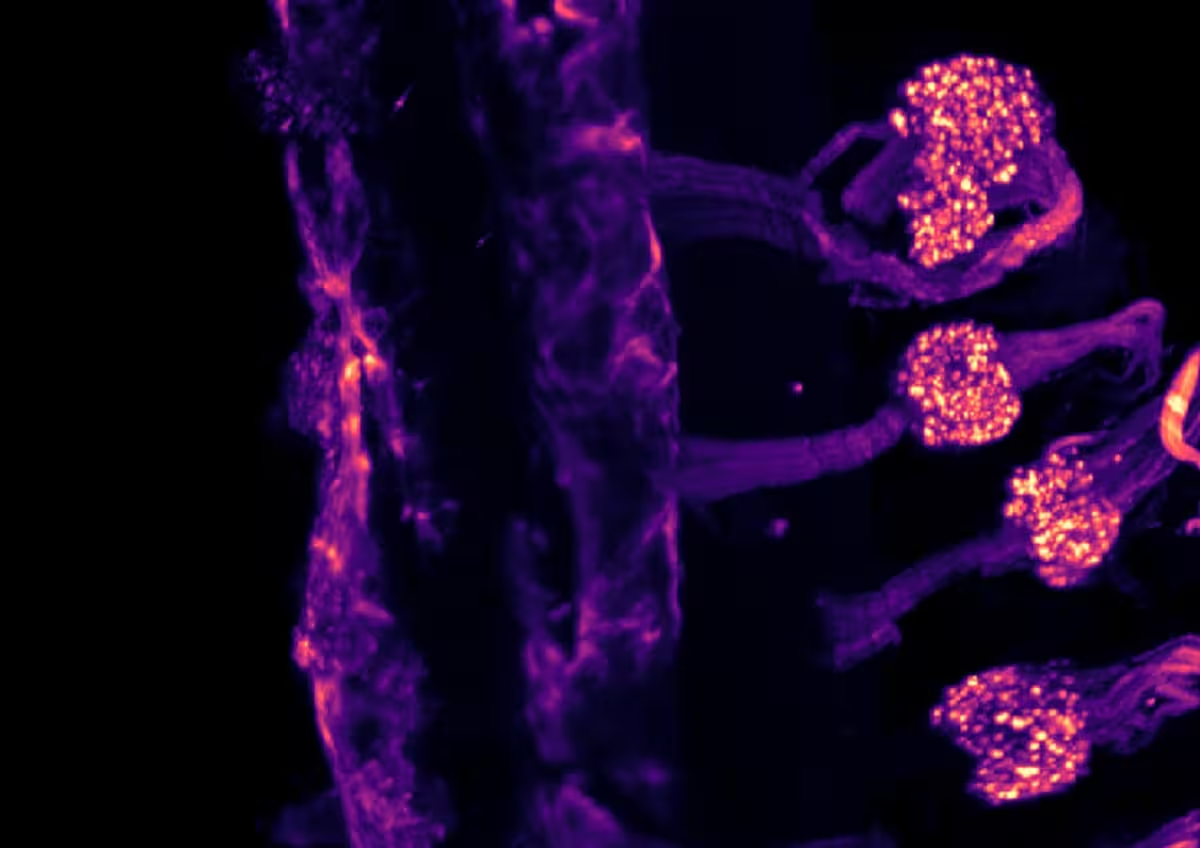
Light-sheet-Mikroskopie-Aufnahme, die die Expression des Ionenkanals TRPM8 in den sensorischen Ganglien einer Maus während der Embryonalentwicklung zeigt, nach Gewebeaufhellung mit der iDISCO-Technik.
Zwei Sensoren, zwei Erfahrungen von Kälte
Die sensorische Biologie hat lange Zeit die Kälteerkennung als einen einheitlichen Signalweg betrachtet. Die neue Studie differenziert dieses vereinfachte Bild: In der Haut fungiert TRPM8 als dominanter Transducer für Umweltkälte; dieser Kanal ist fein justiert, um moderate Temperaturabsenkungen zu detektieren und Schutzreaktionen wie Wärmesuche, Muskelzittern oder Verhaltensanpassungen auszulösen. In viszeralen Geweben hingegen übernehmen die Forscherinnen und Forscher eine führende Rolle von TRPA1 bei der Registrierung von Kälte.
Diese Trennung bedeutet, dass Nervenimpulse, die von einem kalten Fingerspitzenreiz erzeugt werden, anders geleitet und kodiert werden als Signale, die entstehen, wenn eiskalte Luft die Lunge erreicht oder ein kaltes Getränk den Rachen berührt. Die unterschiedliche Kanalnutzung führt zu separaten Erzeugungs- und Verarbeitungswegen in den sensorischen Ganglien und im zentralen Nervensystem, wodurch die Wahrnehmung von Kälte je nach Gewebe qualitativ verschieden ausfällt.
Für die Thermorezeption und die allgemeine Kältewahrnehmung hat diese Unterscheidung weitreichende Bedeutung: Sie hilft zu erklären, weshalb Kälte als unangenehm, schmerzhaft oder neutral empfunden werden kann, abhängig davon, welche sensorischen Rezeptoren und Nervenbahnen beteiligt sind. Wichtige Keywords in diesem Kontext sind TRPM8, TRPA1, Kältesensoren, thermorezeption und kälteempfindlichkeit, die die molekulare Grundlage der unterschiedlichen sensorischen Erfahrungen beschreiben.

Eva Quintero, Pablo Hernández-Ortego, Ana Gómez del Campo, Félix Viana und Katharina Gers-Barlag, IN CSIC-UMH-Forscherinnen und -Forscher.
Wie das Team die getrennten Kältewege nachgewiesen hat
Die Arbeitsgruppe kombinierte mehrere etablierte und moderne Techniken, um die Aktivität sensorischer Neurone bei Abkühlung sichtbar zu machen. Dazu gehörten Live-Cell-Calcium-Imaging, bei dem intrazelluläre Calciumdynamiken als Proxy für neuronale Aktivität erfasst werden, sowie elektrophysiologische Aufzeichnungen (Patch-Clamp), die elektrische Antwortmuster einzelner Neurone charakterisieren. Solche Verfahren erlauben es, Reaktionskinetik, Schwellenwerte und Adaptationsverhalten von Neuronen unter kontrollierten Temperaturveränderungen präzise zu messen.
Ein zentraler Aspekt der Studie war der Vergleich von Neuronen aus unterschiedlichen sensorischen Ganglien: dem Trigeminusganglion, das Empfindungen von Gesicht und Kopfhaut vermittelt, gegenüber den Vagusganglien, die Eingänge aus inneren Organen wie Lunge, Herz und Magen-Darm-Trakt weiterleiten. Durch den direkten Vergleich konnten die Forschenden zeigen, dass die Kälteantworten in diesen Ganglien unterschiedliche pharmakologische Profile und Aktivierungsmuster aufwiesen.
Pharmakologische Blocker mit hoher Selektivität für TRPM8 oder TRPA1 wurden eingesetzt, um die Kanäle gezielt zu hemmen und so deren jeweilige Beiträge zu isolieren. Ergänzend verstärkten genetische Experimente die Befunde: Knockout-Mäuse ohne TRPM8 zeigten stark reduzierte Kaltantworten in hautassoziierten Neuronen, während Mäuse ohne TRPA1 eine verminderte Kältesensitivität in viszeralen Afferenzen aufwiesen.
Die Kombination aus funktionellen Messungen und genetischer Manipulation erzeugt eine konsistente Evidenzkette: Die molekulare Präsenz der Ionenkanäle, nachgewiesen durch Genexpressionsanalysen (z. B. qPCR, RNA-Seq, In-situ-Hybridisierung), korreliert mit den physiologischen Kältereaktionen einzelner Neuronentypen. Solche Multi-Modalitätsdaten stärken die Zuordnung von Kanaltyp zu Gewebe- und Funktionsspezifität.
Warum verschiedene Gewebe unterschiedliche Kältesensoren brauchen
Die funktionale Differenzierung folgt der jeweiligen biologischen Aufgabe: Die Haut dient primär der Wahrnehmung externer Bedingungen und muss rasch Verhaltensänderungen auslösen, die das Überleben sichern. TRPM8 ist auf diese Funktion optimiert, weil er auf für die Umwelt relevante Temperaturabsenkungen empfindlich reagiert und so schnelle Schutzmechanismen in Gang setzt.
Innere Organe hingegen unterliegen anderen regulatorischen Anforderungen. Die Detektion von Kälte in Atemwegen oder Magen-Darm-Trakt kann physiologische Prozesse beeinflussen wie Atemmuster, bronchiale Reflexe, Durchblutung, Magenmotilität und Verdauungsfunktionen. Solche Reaktionen dienen eher der Aufrechterhaltung der internen Homöostase als der unmittelbaren Fluchtreaktion. Deshalb ist ein anderer molekularer Sensor, TRPA1, in viszeralen Pfaden vorherrschend, vermutlich weil dieser Kanal andere Aktivierungsmechanismen, Sensitivitätsbereiche und Vernetzungen im zentralen Nervensystem besitzt.
Funktionelle Spezialisierung lässt sich auch evolutionär plausibel erklären: Tiere, die in unterschiedlichen Umgebungen leben — von kalten Habitaten bis zu thermisch instabilen Ökosystemen — müssen sowohl äußere Kältereize als auch interne Temperaturveränderungen zuverlässig unterscheiden. Die Aufteilung auf mehrere Rezeptorsysteme erhöht die Robustheit der Thermosensation und erlaubt eine differenzierte physiologische Anpassung an Umweltbedingungen.
Félix Viana, Co-Direktor des Labors für Sensory Transduction and Nociception am IN, fasst es so zusammen: „Die Haut ist mit spezifischen Sensoren ausgestattet, die es uns erlauben, Umgebungs‑Kälte zu erkennen und defensive Verhaltensweisen anzupassen. Im Gegensatz dazu scheint die Kältewahrnehmung innerhalb des Körpers auf andere sensorische Schaltkreise und molekulare Rezeptoren angewiesen zu sein, was seine tiefere physiologische Rolle in der internen Regulation widerspiegelt.“
Folgen für Medizin und Grundlagenforschung
Die Erkenntnis, dass TRPM8 und TRPA1 gewebespezifische Aufgaben erfüllen, eröffnet neue therapeutische und diagnostische Perspektiven für Erkrankungen mit gestörter Kältewahrnehmung. Neuropathien, diabetische Nervenschäden, Chemotherapie-induzierte Neuropathie und andere Erkrankungen können zu pathologischer Kälteempfindlichkeit führen — beispielsweise zu schmerzhafter Kältemechanotransduktion (kälteinduzierte Allodynie) oder umgekehrt zu vermindertem Schutz vor Unterkühlung.
Zielgerichtete Therapien, die selektiv den in einem betroffenen Gewebe dominanten Ionenkanal modulieren, könnten die Effektivität erhöhen und unerwünschte systemische Nebenwirkungen reduzieren. Praktische Ansätze reichen von lokalen Kanalblockern, peptidbasierten Inhibitoren und kleinen Molekülen bis zu gentechnischen Strategien oder nanopartikelbasierten Wirkstoffträgern, die eine präzise Distribution in Haut oder viszerale Gewebe ermöglichen.
Klinisch relevant sind auch diagnostische Tests, die zwischen TRPM8- und TRPA1-abhängigen Störungen unterscheiden. Solche differentiellen Tests könnten temperaturabhängige Stimulationsprotokolle, pharmakologische Provokationstests mit Kanalagonisten/-antagonisten oder molekulare Biomarker-Analysen kombinieren, um Ursache und Lokalisation von Kältestörungen besser zu bestimmen.
Katharina Gers-Barlag, Erstautorin der Studie, kommentierte: „Unsere Ergebnisse zeigen eine komplexere und nuanciertere Sicht darauf, wie sensorische Systeme in unterschiedlichen Geweben thermische Informationen kodieren. Das eröffnet neue Wege, um zu untersuchen, wie diese Signale integriert werden und wie sie sich in pathologischen Zuständen verändern — etwa bei bestimmten Neuropathien, in denen die Kälteempfindlichkeit gestört ist.“
Die Studie ist Teil eines größeren internationalen Forschungsprogramms, das vom Human Frontier Science Program gefördert wird und Unterstützung durch Spaniens Nationalen Plan für wissenschaftliche und technische Forschung und Innovation, das Severo-Ochoa-Programm für Zentren exzellenten Forschungs und die Regierung der Valencianischen Gemeinschaft erhält. Ziel dieser Kooperationen ist es, die molekularen Grundlagen der Kältewahrnehmung über verschiedene Arten hinweg nachzuzeichnen — von Tieren, die in extrem kalten Habitaten leben, bis hin zu solchen, die thermische Stressfaktoren auf andere Weise begegnen. Damit wird eine Brücke zwischen molekularer Neurowissenschaft, Ökologie und Evolutionsbiologie geschlagen.
Technische Details, Limitationen und methodische Ergänzungen
Die Untersuchung stützt sich auf mehrere technische Säulen, deren Kombination die Aussagekraft erhöht: Gewebeaufbereitung mit iDISCO und anschließende Lichtblattmikroskopie erlauben eine volumetrische Darstellung der Kanalverteilung in entwicklungsbiologischen Kontexten; Calcium-Imaging misst Populationen von Neuronen in Echtzeit; Patch-Clamp liefert quantitative Daten zu Ionendurchflüssen und Aktivationsschwellen; Genexpressionsanalysen (RNA-Seq, qPCR, in situ) bestimmen die molekulare Signatur der Ganglien.
Trotz der robusten Methodik gibt es Grenzen: Tiermodelle (Maus) lassen sich nicht eins zu eins auf den Menschen übertragen, und die physiologische Komplexität—etwa modulierte Sensitivität durch Inflammationsmarker, Metaboliten oder Neuromodulatoren—erfordert weitere Untersuchungen. Auch die Rolle weiterer Ionenkanäle und Signalwege, die mit TRPM8 und TRPA1 interagieren könnten (z. B. andere TRP-Kanäle, K+-Kanäle, G-Protein-gekoppelte Rezeptoren), bleibt ein offenes Forschungsfeld.
Zukünftige Experimente sollten die zeitliche Dynamik der Kanalexpression bei Entzündung, chronischer Schmerzentwicklung oder metabolischem Stress untersuchen, sowie translationsrelevante Studien an humanen Geweben und iPSC-abgeleiteten sensorischen Neuronen beinhalten. Multimodale Bildgebung in Kombination mit Single-Cell-Transkriptomik kann dabei helfen, Subtypen von Kaltrezeptorneuronen noch feiner zu unterscheiden und deren Schaltkreise im Rückenmark und Thalamus zu kartieren.
Expertinnen- und Experteneinschätzungen
Dr. Maria Torres, eine nicht an der Studie beteiligte sensorische Neurowissenschaftlerin, erläutert, warum der Befund über die Grundlagenbiologie hinaus relevant ist: „Diese Forschung erklärt, warum Kälte so unterschiedlich empfunden wird. Klinikerinnen und Kliniker sehen häufig Patientinnen und Patienten, deren Kälteempfindlichkeit auf einen Körperbereich beschränkt ist. Wenn man berücksichtigt, dass verschiedene Nerven und Kanäle Kälte für unterschiedliche Gewebe kodieren, wird es leichter, gezielte diagnostische Verfahren und Therapien zu entwickeln. Die Unterscheidung zwischen TRPM8 und TRPA1 ist ein wichtiger Baustein dieses Puzzles.“
Andere Fachleute weisen darauf hin, dass das Verständnis der molekularen Spezifizität auch für die Entwicklung von Wearables und therapeutischen Anwendungen von Bedeutung ist: Sensorische Technologien, die Temperaturreize erfassen und differenziell bewerten, könnten künftig in Rehabilitation, Schmerztherapie oder Umgebungsüberwachung eingesetzt werden.
Fazit und Ausblick
Der Nachweis, dass Haut und innere Organe unterschiedliche molekulare Sensoren für Kälte nutzen, verändert unser Verständnis der thermischen Wahrnehmung und bietet konkrete Ansatzpunkte für die Behandlung sensorischer Störungen. Die Kartierung der Verteilung und Funktion von TRPM8 und TRPA1 in sensorischen Ganglien liefert ein klareres Bild davon, wie das Nervensystem Temperatur registriert und darauf reagiert.
Wesentliche Fragen für kommende Arbeiten sind, wie diese getrennten Bahnen bei komplexen, gleichzeitigen Reizen interagieren — etwa wenn eine Person kalte Luft einatmet und gleichzeitig eine kalte Oberfläche berührt — und inwieweit eine gezielte Modulation dieser Kanäle pathologische Kälteempfindlichkeit lindern kann. Aus klinischer Sicht sind differentialdiagnostische Tests und gewebsspezifische Therapien vielversprechende Ziele, die von diesen molekularen Erkenntnissen profitieren dürften.
Quelle: scitechdaily


Kommentar hinterlassen