7 Minuten
Forscher haben eine zell‑engineering Methode entwickelt, die die Menge an viralem Vektor, die zur Herstellung von CAR‑ausgestatteten, induzierten natürlichen Killerzellen (iNK‑Zellen) benötigt wird, dramatisch reduziert. Dieser Fortschritt verspricht, die Kosten zu senken und die Skalierbarkeit für CAR‑basierte Immuntherapien zu verbessern, ohne die potente antitumorale Aktivität in präklinischen Modellen zu beeinträchtigen. Die Studie adressiert zentrale Herausforderungen in der Herstellung von Zelltherapien wie Produktionskosten, Sicherheitsanforderungen und Reproduzierbarkeit und bietet einen möglichen Weg zu wirtschaftlicheren, breiter verfügbareren CAR‑NK‑Plattformen.
Wie die neue Technik den Bedarf an viralen Vektoren drastisch reduziert
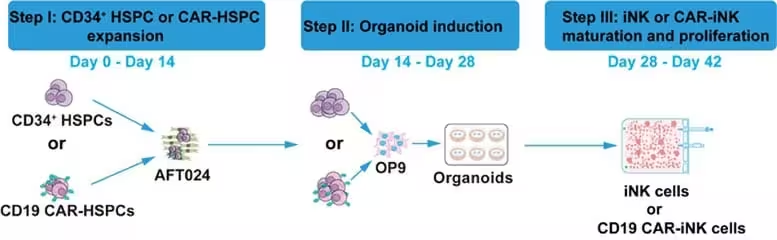
Traditionelle CAR‑Modifikation reifer natürlicher Killerzellen erfordert in der Regel erhebliche Mengen an viralem Vektor, um das Rezeptorgen effizient einzubringen. Die hier beschriebene Methode nutzt einen Eingriff während der Induktion von iNK‑Zellen und verändert damit den Zeitraum und den zellulären Kontext der Transduktion. Durch diesen zeitlich und biologisch optimierten Zugang konnten die Forschenden den Vektor‑Input im Vergleich zu Standardprotokollen um enorm große Faktoren reduzieren — ungefähr im Bereich von 1:140.000 in der sechsten Kultivierungswoche und bis hin zu etwa 1:600.000 in der siebten Woche. Anders ausgedrückt: Für vergleichbare CAR‑Expression wurde nur ein winziger Bruchteil des sonst benötigten viralen Materials verwendet.
Mechanistisch beruht der Effekt vermutlich auf mehreren Faktoren, die zusammen die Transduktionsökonomie verbessern: eine erhöhte Teilungsaktivität und damit verbundene Empfänglichkeit bestimmter Vorläuferstadien während der iNK‑Induktion; ein veränderter Zellmembran‑ und Rezeptormilieu, das die Aufnahme von viralen Partikeln erleichtert; sowie optimierte Kulturbedingungen (z. B. Zytokin‑Support wie IL‑15/IL‑2, spezialisiert ausgewählte Adhäsionsoberflächen und serumarme Medien), welche die Lebensfähigkeit und Ausbeute der Zielzellen steigern. Darüber hinaus können technische Maßnahmen wie verbesserte Pseudotypisierung des Vektors und niedrigere, aber hochwirksame Multiplikatoren der Infektion (MOI) kombiniert worden sein, um das Verhältnis von benötigtem Vektor zu resultierender CAR‑Expression zu verbessern.
Aus Sicht der gentechnischen Herstellung ist die Reduktion des Vektorbedarfs besonders relevant, weil virale Vektoren — insbesondere lentivirale oder retrovirale Systeme — teuer und in der Produktion ressourcenintensiv sind. Die Kosten für die Generierung klinischer Chargen mit hoher Titrierung, die Herstellung unter GMP‑Bedingungen sowie die Validierung auf fehlende Replikationskompetenz tragen erheblich zu den Gesamtpreisen von Zelltherapien bei. Eine methodische Strategie, die die benötigte Vektormenge um mehrere Größenordnungen senkt, kann diese Kostenstruktur grundlegend verändern und erlaubt, dass Herstellungskapazitäten effizienter genutzt werden. Gleichzeitig reduziert die geringere Vektorlast mögliche Risiken durch zufällige Integrationsevents und verringert regulatorische Aufwände im Zusammenhang mit der Handhabung großer Vektorvolumina.
Funktionelle Tests: Tumorkontrolle in Leukämiemodellen
Eine bloße Einsparung an viralen Partikeln wäre ohne erhaltene Funktionalität der resultierenden Zellen wertlos. In einer Reihe von präklinischen Tests zeigten sowohl nicht modifizierte iNK‑Zellen als auch CAR‑modifizierte iNK‑Zellen (CAR‑iNK) starke zytotoxische Aktivität gegen tumoröse Zielzellen. In vitro‑Assays belegten robuste Zielerkennung, Freisetzung von Zytotoxinen (wie Perforin und Granzym B) sowie sekretorische Reaktionen mit interferon‑γ‑Produktion nach Antigenerkennung. Diese funktionellen Parameter sind präklinische Korrelate für antitumorale Effektivität und essentielle Qualitätsmerkmale in der Entwicklung von Immunzellen.
In vivo wurden die Effekte in Mausmodellen untersucht, darunter sowohl cell line‑derived xenografts (CDX) als auch patientenabgeleitete Xenografts (PDX) der humanen B‑Zell akuten lymphoblastischen Leukämie (B‑ALL). CD19‑gerichtete CAR‑iNK‑Zellen verlangsamten dort das Tumorwachstum und verlängerten das Überleben der Tiere gegenüber Kontrollgruppen. Solche Ergebnisse deuten darauf hin, dass die reduzierte Vektorverwendung nicht zulasten der Effektfunktion geht und dass die CAR‑iNK‑Plattform tumorantigen‑spezifische Erkennung und Eliminierung in vivo bewahrt.
Wesentlich ist auch die Beobachtung der Persistenz und der Sicherheit in diesen Modellen: CAR‑iNK‑Zellen zeigen typischerweise eine andere Persistenz‑ und Verteilungsdynamik als CAR‑T‑Zellen, oft mit kürzerer Langzeitpersistenz, jedoch mit einem günstigen Sicherheitsprofil (z. B. geringeres Risiko für schwere Zytokinfreisetzungssyndrome). In den hier berichteten präklinischen Versuchen blieb die antitumorale Aktivität ausreichend, um signifikante Tumorkontrolle zu erreichen, während Nebenwirkungen in den gewählten Modellen eingeschränkt blieben. Zusätzlich wurden sowohl CDX‑ als auch PDX‑Modelle eingesetzt, um sowohl standardisierte Zelllinienantworten als auch patientennahes, heterogenes Tumorverhalten zu erfassen — ein wichtiger Schritt zur Abschätzung klinischer Relevanz.
Warum das für die Entwicklung von Zelltherapien wichtig ist
Virale Vektoren zählen zu den teuersten und am strengsten regulierten Komponenten in der CAR‑Zellherstellung. Eine Reduktion des benötigten Vektorinputs um mehrere Größenordnungen hat zwei unmittelbare Vorteile: niedrigere Produktionskosten und geringere biosicherheits‑bezogene Aufwände beim Hochskalieren. Niedrigere Kosten senken Barrieren für die Translation von Laborforschung in klinische Studien und erhöhen die Attraktivität für industrielle Partner, die GMP‑Herstellungskapazitäten bereitstellen. Ein reduzierter biosicherheitsrelevanter Fußabdruck vereinfacht zudem logistische Aspekte bei der Produktion, Lagerung und beim Transport.
Für die klinische Entwicklung von NK‑Zelltherapien ist Skalierbarkeit ein zentrales Kriterium. Herkömmliche autologe Ansätze (patienteneigene Zellen) sind oft zeitaufwendig, kostenintensiv und variabel. Allogene, vorgefertigte „off‑the‑shelf“ Plattformen auf Basis von iNK‑Zellen bieten das Potenzial, standardisierte Chargen mit konsistenter Qualität bereitzustellen. Wenn sich die hier beschriebene Vektor‑Senkung mit robusten Qualitäts‑ und Potenzkennzahlen kombinieren lässt, kann dies die Erschwinglichkeit und Verfügbarkeit von CAR‑NK‑Therapien deutlich verbessern.
Zusätzlich spricht die Reduktion von Vektormaterial für eine bessere Umwelt‑ und Arbeitsplatzsicherheit in Produktionsstätten sowie für potenzielle regulatorische Vereinfachungen. Weniger viralen Input bedeutet auch weniger Aufwand in Hinblick auf Tests auf Replikationskompetenz, Kontaminationskontrollen und aufwändige Validierungsprotokolle. Solche Effekte sind besonders relevant für Unternehmen und akademische Produktionszentren, die mehrere Indikationen parallel entwickeln möchten.
Folgen, offene Fragen und nächste Schritte
Obwohl die Ergebnisse präklinisch sind, zeigen sie einen vielversprechenden Weg zu effizienterer CAR‑Modifikation, die therapeutische Potenz beibehält. Die nächsten Schritte umfassen mehrere Forschungslinien: Reproduzierbarkeit der Methode in anderen Labors und unter GMP‑nahen Bedingungen, detaillierte Sicherheitsanalysen (etwa zu Integrationsmustern, Genomstabilität und möglicher Off‑Target‑Aktivität) sowie Langzeitbeobachtungen zur Persistenz und Funktion von CAR‑iNK‑Zellen.
Wichtig sind größere vorklinische Studien in relevanten Tiermodellen, möglicherweise auch nicht‑menschlichen Primaten, um Immunantworten, Verteilung und Toxizität umfassender zu bewerten. Parallel dazu müssen Herstellungsprozesse skaliert und validiert werden: Definition von kritischen Qualitätsattributen (CQAs), Entwicklung robuster Potenz‑Assays, Standardisierung von Kryokonservierungsprotokollen und Etablierung stabiler Lieferketten für Medium, Zytokine und Hilfsstoffe unter GMP‑Bedingungen.
Regulatorisch erwarten die Aufsichtsbehörden (z. B. EMA, FDA) überzeugende Daten zu Sicherheit, Konsistenz der Produktion und Wirksamkeit. Frühphase‑Studien am Menschen (Phase‑I‑Studien) würden primär Toxizität und Verträglichkeit prüfen, gefolgt von Dosis‑Findungs‑ und Wirksamkeitsstudien. Sollte die Technologie diese Hürden nehmen, könnte eine kostengünstigere, standardisierte, „off‑the‑shelf“ NK‑Zellplattform bereitstehen, die CD19 und potenziell weitere Tumorantigene adressiert. Insbesondere für B‑Zell Malignome wie B‑ALL wäre eine zusätzliche, sicherere Allokation von therapeutischen Optionen von großem klinischem Wert.
Offene wissenschaftliche Fragen betreffen weiterhin die Optimierung von CAR‑Designs für NK‑Zellen (z. B. Auswahl von Kostimulatoren, Domänen, Signalpeptiden), die Kombination mit unterstützenden Zytokinen (z. B. Membran‑gebundenes IL‑15) für verbesserte Persistenz, sowie die potenzielle Kombination mit anderen Immuntherapien wie Checkpoint‑Inhibitoren oder gezielter Strahlentherapie, um synergistische Effekte zu erreichen. Auch die Frage nach Antigenverlustvarianten beim Tumor und Strategien zur Vermeidung von Immunescape (z. B. duale CARs oder Kombinationstargeting) bleibt zentral.
Zusammenfassend eröffnet die beschriebene Methode für die CAR‑Herstellung an iNK‑Zellen einen praktikablen Weg, Kosten und regulatorischen Aufwand zu reduzieren, während die antitumorale Wirksamkeit erhalten bleibt. Die weitere Validierung in vorklinischen und klinischen Studien wird zeigen, ob diese Strategie tatsächlich als robustes, skalierbares und klinisch nutzbares Verfahren für die nächste Generation von NK‑Zelltherapien etabliert werden kann.
Quelle: scitechdaily

Kommentar hinterlassen