7 Minuten
Forscher haben eine überraschende neue Methode gefunden, um insulinproduzierende Zellen zu erzeugen: durch Reprogrammierung von menschlichem Magengewebe. Mit im Labor gezüchteten Magenorganoiden und einem genetischen "Schalter" wandelten Wissenschaftler gastrische Zellen in beta-ähnliche Zellen um, die Insulin sekretieren und den Blutzucker bei diabetischen Mäusen mitregulieren können.
Von Magenorganoiden zu Insulinfabriken
Der Typ‑1‑Diabetes entsteht, wenn die Bauchspeicheldrüse die spezialisierten Beta‑Zellen verliert oder sie zerstört werden — die Zellen, die Insulin produzieren. Betroffene sind daher auf lebenslange Insulininjektionen und kontinuierliche Blutzuckerkontrolle angewiesen. Um verlorene Beta‑Zellen zu ersetzen, untersuchen Wissenschaftler verschiedene Ansätze: von Stammzell‑abgeleiteten Inseln (Islets) über Spendertransplantationen bis hin zu zellulären Reprogrammierungsstrategien. Jeder Ansatz hat jedoch Herausforderungen, etwa Immunreaktionen gegen fremdes Gewebe, begrenzte Verfügbarkeit von Spendergewebe und komplexe Herstellungsprozesse.
Ein internationales Team unter Leitung von Xiaofeng Huang (Weill Cornell Medicine, USA) und Qing Xia (Peking University, China) verfolgte nun eine clevere Alternative: die Zellen nutzen, die bereits im Körper vorhanden sind. Aufbauend auf früheren Experimenten an Mäusen kultivierten die Forschenden miniature menschliche Magenmodelle, sogenannte Magenorganoide, die wichtige Merkmale des Magenschleimhautgewebes nachbilden. Anschließend führten sie ein programmierbares Set genetischer Faktoren ein — effektiv einen Schalter — der die Magenzellen beim Aktivieren dazu bringen kann, eine beta‑ähnliche Identität anzunehmen.
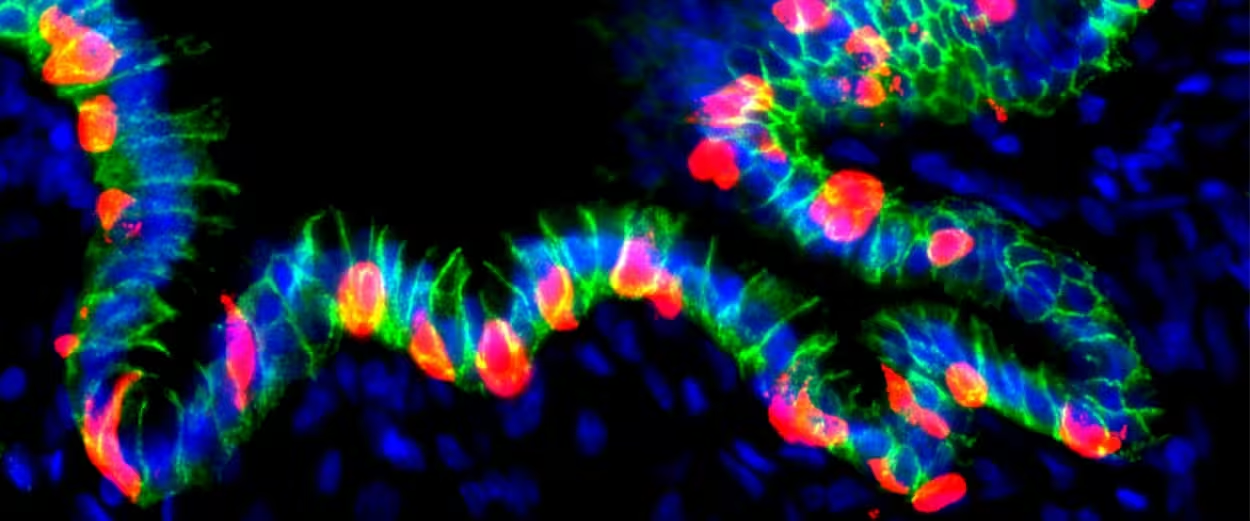
Transplantierte hGO‑NPM erzeugt insulinpositive Zellen
Wie die Reprogrammierung funktionierte
- Das Team kultivierte menschliche Magenorganoide in vitro, um eine erneuerbare Zellquelle zu erhalten.
- Die Organoide wurden mit einem kontrollierbaren genetischen Programm ausgestattet, das Beta‑Zell‑Gene und die entsprechende Proteinexpression anstoßen kann.
- Nach der Transplantation dieser genetisch modifizierten Organoide in die Bauchhöhle von Mäusen integrierten sich die Gewebe in die lokale Gefäßstruktur und überlebten über Monate.
- Wurde der Schalter aktiviert, begannen die menschlich stammenden Magenzellen Insulin zu produzieren und zeigten genetische sowie proteinbiochemische Marker, die denen von Pankreas‑Beta‑Zellen ähneln.
Technisch basiert dieser Ansatz auf gezielter Umschaltung von Transkriptionsprogrammen. In ähnlichen Reprogrammierungsstudien werden häufig Transkriptionsfaktoren wie PDX1, NKX6.1 oder MAFA genannt, die charakteristische beta‑zelltypische Genexpression initiieren; in diesem Kontext dient der "Schalter" dazu, solche Programme kontrollierbar zu aktivieren, zu modulieren und wieder zu deaktivieren. Die Forschenden prüften Funktionsfähigkeit und Identität der umprogrammierten Zellen durch molekulare Marker, Proteinexpression und funktionelle Tests wie die Insulinfreisetzung als Reaktion auf Glukose.
Zudem ist die vaskuläre Integration ein zentraler Punkt: Nur wenn die umgewandelten Zellen gut durchblutet werden, können sie schnell auf Blutzuckerschwankungen reagieren und Insulin direkt in den Kreislauf abgeben. In den Mäuseexperimenten zeigte sich, dass die transplantierten Organoide an lokale Blutgefäße anknüpfen und physiologisch relevante Mengen an menschlichem Insulin freisetzen konnten, was eine Verbesserung der glykämischen Kontrolle bewirkte.
Warum das für Typ‑1‑Diabetes wichtig ist
In den Tiermodellen regulierte das von den umprogrammierten menschlichen Magenzellen freigesetzte Insulin den Blutzucker und verbesserte diabetesbezogene Symptome — ein wichtiges Proof‑of‑Concept. Ein entscheidender praktischer Vorteil dieses Ansatzes ist die Zugänglichkeit des Magengewebes: Die Magenschleimhaut lässt sich über minimalinvasive Verfahren wie die Endoskopie erreichen. Das eröffnet die Möglichkeit, patienteneigene (autologe) Zellen direkt vor Ort zu reprogrammieren, wodurch Probleme wie Spendenknappheit und die Notwendigkeit einer lebenslangen immunsuppressiven Therapie reduziert werden könnten.
Autologe Reprogrammierung würde potenziell die Immunverträglichkeit verbessern, weil die neu erzeugten Insulinproduzenten aus dem eigenen Gewebe des Patienten stammen. Das verringert das Risiko von Abstoßungsreaktionen gegenüber fremdem Spendergewebe und könnte die Notwendigkeit systemischer Immunsuppression abschwächen. Zusätzlich könnten lokal angewendete, kontrollierbare genetische Schalter eine feinere Steuerung des Umwandlungsprozesses erlauben und die dynamische Anpassung an individuelle Bedürfnisse ermöglichen.
Dennoch bleiben beträchtliche Hürden. Die Autorinnen und Autoren berichten ihre Ergebnisse in Stem Cell Reports (6. November), betonen aber, dass Sicherheit, Langlebigkeit und dauerhafte Funktionalität vor klinischen Studien nachgewiesen werden müssen. Zu klärende Fragen sind etwa die präzise Steuerung der Reprogrammierung, das Verhindern unerwünschter Zellverhalten (beispielsweise unerwünschte Differenzierung oder Proliferation) sowie der Schutz der neuen Insulin produzierenden Zellen vor der Autoimmunreaktion, die dem Typ‑1‑Diabetes zugrunde liegt.
Nächste Schritte: Wege und Herausforderungen
Zukünftige Forschung wird sich darauf konzentrieren, den genetischen Schalter zu verfeinern, die Langzeitüberlebensfähigkeit und Funktion der umprogrammierten Zellen zu testen und Strategien zu entwickeln, die umgewandelten Zellen vor autoimmunen Angriffen zu schützen. Mögliche technische Lösungen umfassen:
- Optimierung der Induktionselemente für präzise, dosisabhängige Aktivierung und Abschaltung von Reprogrammierungsgenen.
- Entwicklung von gezielten Liefermethoden, etwa endoskopischer Applikation oder lokal wirkender Vektoren, um off‑target Effekte zu minimieren.
- Einbindung von Kapselungstechnologien (Encapsulation) oder physikalischen Barrieren, die Zellen immunologisch isolieren, ohne die Glukose‑ und Insulin‑Diffusion zu beeinträchtigen.
- Kombination mit immuntoleranzfördernden Ansätzen, zum Beispiel gezielter Immunsuppression, Peptid‑Toleranzinduktion oder regulatorischen T‑Zelltherapien, um autoimmune Zerstörung zu vermeiden.
- Validierung in größeren präklinischen Modellen und Standardisierung von Herstellungsprozessen (GMP‑konforme Produktion) zur Vorbereitung klinischer Studien.
Ein weiterer zentraler Punkt ist die Sicherheitsbewertung: Die Reprogrammierung darf nicht zu unkontrollierter Zellproliferation, Tumorbildung oder zu Funktionsstörungen in anderen Gewebearten führen. Deshalb sind umfassende Langzeitstudien nötig, die neben molekularen Analysen auch physiologische Tests über Monate bis Jahre einschließen.
Wirtschaftliche und regulatorische Aspekte spielen ebenfalls eine Rolle. Für eine breite klinische Anwendung müssen Verfahren skalierbar, reproduzierbar und kosteneffizient sein. Zulassungsbehörden werden umfangreiche Daten zur Wirksamkeit, Sicherheit und Herstellungsqualität verlangen. Die interdisziplinäre Zusammenarbeit zwischen Zellbiologen, Klinikern, Immunologen, Bioingenieuren und Regulierungsbehörden ist für die Translation dieser Forschung in die Klinik unverzichtbar.
Falls sich die Technik in weiteren Studien bewähren sollte, könnte die Magenreprogrammierung Teil eines größeren Instrumentariums regenerativer Strategien zur Wiederherstellung physiologischer Insulinproduktion werden — neben Stammzell‑abgeleiteten Inseln, kapselnden Implantaten und gentechnischen Modifikationen. Jede dieser Strategien hat eigene Vorteile und Einschränkungen; eine Kombination könnte die erfolgreichste Lösung bieten, etwa autologe Reprogrammierung kombiniert mit lokaler Immunmodulation und biotechnologischer Absicherung durch Encapsulation.
Fürs Erste liefert diese Studie ein faszinierendes Proof‑of‑Concept: Der Magen, normalerweise nicht in die Blutzuckerregulation eingebunden, lässt sich zu einer Insulinquelle umfunktionieren. Diese Perspektivverschiebung öffnet neue Möglichkeiten für zellbasierte Therapien bei Diabetes und unterstreicht die kreativen Wege, mit denen Forschende chronischen Krankheiten begegnen.
Wichtig ist, dass die kommunikative Darstellung solcher Fortschritte realistisch bleibt: Während die Ergebnisse Hoffnung geben, handelt es sich um vorläufige präklinische Daten. Patientinnen und Patienten sollten nicht davon ausgehen, dass solche Therapien kurzfristig verfügbar sind; umfangreiche Prüfungen sind notwendig, bevor sichere und wirksame klinische Anwendungen möglich sind.
Zusammenfassend zeigt die Arbeit das Potenzial der regenerativen Medizin, etablierte Annahmen über Organzuordnung und Funktion zu hinterfragen. Indem man vorhandene, leicht zugängliche Zelltypen nutzt und mit präzisen genetischen Werkzeugen neu programmiert, lassen sich therapeutische Optionen entwickeln, die auf Autologie, Sicherheit und praktikabler klinischer Umsetzbarkeit abzielen — zentrale Faktoren für eine erfolgreiche Behandlung des Typ‑1‑Diabetes.
Quelle: scitechdaily

Kommentar hinterlassen