7 Minuten
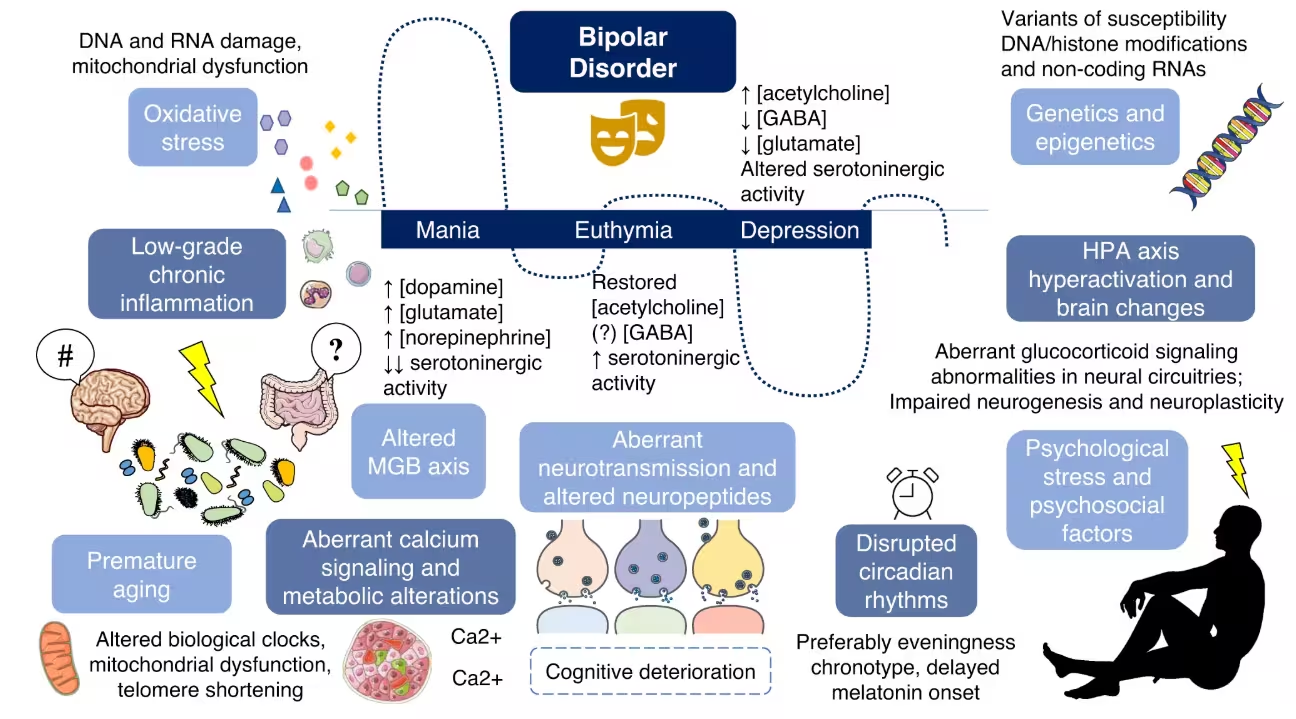
Neue Forschungsergebnisse deuten darauf hin, dass ein Ungleichgewicht der Darmbakterien die Verschaltung im Gehirn umformen und depressionsähnliches Verhalten hervorrufen kann, das mit bipolarer Störung in Verbindung gebracht wird – zumindest bei Mäusen. Durch die Transplantation von fäkaler Mikrobiota aus Personen in einer depressiven Phase der bipolaren Erkrankung auf Versuchstiere gelang es Forschenden, sowohl Verhaltensänderungen als auch neuronale Merkmale zu reproduzieren, die mit der Erkrankung assoziiert werden. Diese Arbeit liefert Beweise dafür, dass das Mikrobiom die Hirnfunktion auf messbare Weise beeinflussen kann und damit potenziell eine Rolle bei Stimmungsschwankungen spielt.
How the mouse experiment worked — and why it matters
Wissenschaftler der Zhejiang University übertrugen Stuhlproben von Freiwilligen mit diagnostizierter bipolarer Störung (während einer depressiven Episode) auf Labormäuse. Das Team kombinierte umfangreiche Verhaltensprüfungen, bildgebende Verfahren des Gehirns und genetische Sequenzierung, um die Veränderungen nach der Transplantation systematisch zu verfolgen. Im Vergleich zu Mäusen, die Bakterien von gesunden Spendern erhielten, bewegten sich die Empfänger der bipolar-abgeleiteten Mikrobiota weniger, zeigten geringeres Interesse an Belohnungen und offenbarten weitere klassische Verhaltensmerkmale, die in Tiermodellen von Depression verwendet werden, wie verminderte Explorationsfreude und geringere soziale Interaktion.
Warum ist das relevant? Tiermodelle erlauben es Forschenden, einzelne Variablen isoliert zu verändern; hier war die manipulierte Variable das Darmmikrobiom. Dass sich das Verhalten ausschließlich bei jenen Mäusen änderte, die Mikrobiota von bipolaren Spendern erhalten hatten, stärkt die Kausalitätsannahme zwischen mikrobiellen Gemeinschaften und stimmungsrelevanter Gehirnfunktion. Solche Befunde sind wichtig, um biologische Mechanismen zu identifizieren, die auch klinisch relevant sein könnten – etwa als Biomarker oder als neue Therapieansätze in der Behandlung der bipolaren Störung und assoziierter depressiver Episoden.
What brain scans and cell-level tests revealed
Die Gehirne der betroffenen Mäuse zeigten spezifische Veränderungen im medialen präfrontalen Kortex (mPFC), einer Hirnregion, die zentral für Entscheidungsfindung, Emotionsregulation und die Verarbeitung von Belohnungen ist. Die Studie berichtete über eine reduzierte Dichte von Synapsen — die physischen Verbindungen zwischen Nervenzellen — sowie abgeschwächte funktionelle und strukturelle Konnektivität zwischen dem mPFC und Netzwerken, die an der Belohnungsverarbeitung beteiligt sind. Kurz gesagt: Das Belohnungssystem des Gehirns schien funktionell entkoppelt, ein Befund, der mit Kernmerkmalen depressiven Verhaltens wie Anhedonie (verminderte Fähigkeit, Freude zu empfinden) übereinstimmt.
Auf zellulärer Ebene zeigten elektrophysiologische Messungen und immunhistochemische Befunde Veränderungen in der synaptischen Übertragung und in Markern neuronaler Aktivität. Diese Detaildaten deuten darauf hin, dass nicht nur die Anzahl der Verbindungen abnimmt, sondern auch die Effizienz der Signalübertragung beeinträchtigt ist. Solche synaptischen Defizite können langfristige Auswirkungen auf Netzwerkdynamik und Verhalten haben, insbesondere in Hirnarealen, die für die Stimmungssteuerung verantwortlich sind.
Die genetische Sequenzierung des transplantierten Mikrobioms fand erhöhte Anteile bakterieller Gattungen, die bereits in früheren Studien mit negativen gesundheitlichen Ergebnissen assoziiert wurden, darunter Klebsiella und Alistipes. Beide Gattungen wurden in mehreren Studien diskutiert in Zusammenhang mit Entzündungssignaturen, Stoffwechselveränderungen und möglichen stimmungsrelevanten Effekten. Die Autoren betonen jedoch, dass weitere Arbeit erforderlich ist, um Ursache und Wirkung bis auf die Ebene einzelner Spezies oder Stämme zu klären und um zu verstehen, welche mikrobiellen Metaboliten oder molekularen Signale die neuronalen Veränderungen vermitteln.
Why lithium, not fluoxetine, produced improvement
Um zu prüfen, ob die induzierte Depression spezifisch der bipolaren Depression ähnelt, testeten die Forschenden zwei Medikamente: Fluoxetin (ein SSRI, das häufig bei Major Depression eingesetzt wird) und Lithium (ein etablierter Stimmungsstabilisator erster Wahl bei bipolarer Störung). Fluoxetin konnte das normale Verhalten nicht wiederherstellen, während Lithium eine deutliche Verhaltensverbesserung bewirkte und viele der depressionsähnlichen Anzeichen abschwächte.
Dieses Muster spiegelt klinische Erfahrungen wider: Depressive Episoden bei bipolaren Patienten sprechen oft anders auf Antidepressiva an als unipolare Depressionen. Lithium hat bekannte Wirkungen auf Dopamin-Signalwege, neuronale Erregbarkeit und intrazelluläre Signaltransduktion — Effekte, die plausibel die Reaktivierung oder Stabilisierung von Belohnungsnetzwerken erklären könnten, die durch das veränderte Mikrobiom gestört wurden. Darüber hinaus besitzt Lithium neuroprotektive Eigenschaften und kann synaptische Plastizität beeinflussen, was helfen könnte, die beobachteten synaptischen Defizite zu remediieren.
Die unterschiedliche Reaktion auf Fluoxetin versus Lithium liefert epidemiologische und therapeutische Hinweise: Wenn mikrobiell vermittelte Effekte spezifisch mit den neuronal-biochemischen Pfaden zusammenhängen, auf die Lithium wirkt, könnte das die Basis für gezielte Behandlungsentscheidungen sein und helfen, Fehldiagnosen zwischen unipolarer und bipolarer Depression zu reduzieren.
Bigger picture: gut microbes as one piece of a complex puzzle
Die Autorinnen und Autoren der Studie sowie unabhängige Expertinnen und Experten warnen davor, die Darmbakterien als alleinige Ursache der bipolaren Störung zu betrachten. Die Erkrankung entsteht vielmehr aus einem komplexen Zusammenspiel genetischer Prädispositionen, Umweltfaktoren, Lebensstil und neurobiologischer Vulnerabilität — wobei die Mikrobiom–Darm–Hirn-(MGB-)Achse eine zusätzliche, aber wichtige Ebene darstellt. Dennoch stützen die Ergebnisse ein Modell, in dem mikrobielle Dysbiosen die Vulnerabilität für Stimmungsschwankungen erhöhen oder bestehende Symptome verschlimmern können, indem sie neuronale Konnektivität und synaptische Funktionen verändern.
Auf Bevölkerungsebene könnte das bedeuten, dass individuelle Unterschiede im Darmmikrobiom als Risikofaktor, als Moderator für Krankheitsverlauf oder als Prädiktor für Therapieansprechen berücksichtigt werden sollten. Integrierte Forschungsansätze, die Genetik, Metabolomik, Immunologie und Bildgebung verbinden, sind nötig, um die Position des Mikrobioms im kausalen Netzwerk psychischer Erkrankungen präzise einzuordnen.
Wird dieser Forschungsansatz in größeren, gut kontrollierten Studien beim Menschen repliziert und erweitert, eröffnet er potenziell neue therapeutische Möglichkeiten: gezielte Mikrobiom-Interventionen wie maßgeschneiderte Probiotika, präzisionsmedizinische Ansätze zur Mikrobiota-Restoration oder diätetische Strategien könnten künftig die pharmakologische und psychotherapeutische Versorgung ergänzen. Aktuelle Daten sind jedoch vorwiegend präklinisch; klinische Studien sind erforderlich, um Sicherheit, Wirksamkeit und Langzeiteffekte solcher Interventionen zu bewerten.
Implications for diagnosis and future research
Fehldiagnosen bei bipolarer Störung sind häufig, teilweise weil depressive Episoden leicht mit einer unipolaren Major Depression verwechselt werden können. Das Identifizieren biologischer Signaturen — seien sie mikrobiell, molekular oder netzwerkphysiologisch —, die die bipolare Depression von anderen Formen unterscheiden, könnte die frühe Diagnostik verbessern und die Therapie gezielter machen. Solche Biomarker könnten helfen, Therapien vorherzusagen, etwa welche Patienten auf Lithium ansprechen oder welche von mikrobiombasierten Interventionen profitieren könnten.
Die in Molecular Psychiatry veröffentlichte Studie fordert weitere Untersuchungen, um herauszufinden, welche spezifischen Bakterienarten oder bakteriellen Metaboliten neuralen Umbau antreiben und ob vergleichbare Muster bei Menschen mit bipolarer Depression vorkommen. Wünschenswert sind longitudinal angelegte Humanstudien, Interventionsstudien mit kontrollierten Mikrobiota-Manipulationen, Multi-omics-Analysen (Metagenomik, Metabolomik, Transkriptomik) und die Integration von funktioneller Bildgebung, um Korrelationen und mögliche Kausalitäten besser zu verstehen.
Zudem sollten zukünftige Studien Faktoren wie Ernährung, Medikamenteneinnahme, Komorbiditäten (z. B. gastrointestinale Erkrankungen), Alter, Geschlecht und Lebensstil einbeziehen, da all diese Variablen das Mikrobiom und die Hirnfunktion beeinflussen können. Eine robuste Replikation unter Berücksichtigung dieser Einflussgrößen ist notwendig, bevor klinische Empfehlungen ausgesprochen werden können.
Expert Insight
„Diese Studie untermauert die Vorstellung, dass Darm und Gehirn in einer Weise kommunizieren, die für psychiatrische Erkrankungen relevant ist“, sagt Dr. Emily Hart, eine klinische Neurowissenschaftlerin (fiktiv), die zu affektiven Störungen und dem Mikrobiom forscht. „Die Ansprechbarkeit auf Lithium ist besonders aufschlussreich: Sie legt nahe, dass das bakterielle Signal mit neuronalen Systemen interagiert, die bereits als zentral für die bipolare Störung bekannt sind. Der nächste Schritt sind sorgfältige Humanstudien, die einzelne bakterielle Stämme mit messbaren Veränderungen in Hirnschaltkreisen verknüpfen.“
Weitere Forschung muss Kausalität beim Menschen bestätigen, verwertbare mikrobielle Zielstrukturen identifizieren und sichere, evidenzbasierte Mikrobiom-Interventionen als Ergänzung zu bestehenden Behandlungsoptionen für die bipolare Störung testen. Wichtig bleibt dabei die interdisziplinäre Zusammenarbeit von Mikrobiologen, Neurowissenschaftlern, Psychiatern und klinischen Forschenden, um tragfähige, translational wirksame Strategien zu entwickeln.
Quelle: sciencealert

Kommentar hinterlassen