8 Minuten
Die Parkinson-Krankheit könnte sich still und leise in unserem Haar bemerkbar machen. Eine kürzlich veröffentlichte Studie aus China legt nahe, dass ein winziger Haarschnitt Hinweise auf eine Erkrankung liefern könnte, die bislang schwer frühzeitig und nicht-invasiv zu identifizieren war.
Der Haarhinweis
Ein Forscherteam unter Leitung des Biologen Ming Li von der Hebei-Universität untersuchte Haarproben von 60 Personen mit diagnostizierter Parkinson-Krankheit und verglich diese mit altersangepassten gesunden Kontrollen. In ihrem frühen, noch als Pre-Proof veröffentlichten Bericht in iScience identifizieren die Autorinnen und Autoren ein klares Muster: Die Haare der Parkinson-Patienten wiesen niedrigere Eisen- und Kupferwerte sowie erhöhte Mangan- und Arsenkonzentrationen auf.
Warum Haar? Haare funktionieren wie ein langsam arbeitender Filmrekorder. Sie lagern Metalle über Wochen und Monate ein und dokumentieren damit Expositionen und metabolische Veränderungen, die Blut- oder Speichelproben nicht in der gleichen zeitlichen Tiefe archivieren können. Blut liefert ein Momentbild; Haare speichern eine historische Spur.
Die Forscher argumentieren, dass diese elementaren Unterschiede diagnostisches Potenzial besitzen. Gegenwärtig stützen sich Kliniker auf klinische Untersuchungen, bildgebende Verfahren und ein Sammelsurium von Biomarkern in Körperflüssigkeiten, um die Parkinson-Krankheit zu klassifizieren. Ein verlässlicher, nicht-invasiver Marker, der langfristige systemische Veränderungen abbildet, wäre ein bedeutender klinischer Fortschritt. Allerdings ist die Studie klein: Sechzig Patientinnen und Patienten können zwar ein Signal zeigen, aber noch keine festen diagnostischen Regeln liefern.
Biologie hinter dem Signal
Die konsistenteste Beobachtung in menschlichen Proben und Mausmodellen war ein reduzierter Eisengehalt im Haar. In Laborversuchen an Mäusen, die genetisch so verändert wurden, dass sie Parkinson-ähnliche Funktionsstörungen entwickeln, spiegelte niedriges Haar-Eisen Hinweise auf eine geschwächte Darmbarriere wider. Gene, die normalerweise die Eisenaufnahme im Darm unterstützen, zeigten eine geringere Aktivität. Gleichzeitig stieg die Aktivität bakterieller Gene, die mit Eisen-Ausschöpfung (iron scavenging) in Verbindung stehen, was darauf hindeutet, dass Mikroben im Darm Eisen anhäufen und dadurch dem Wirt weniger verfügbar machen könnten.
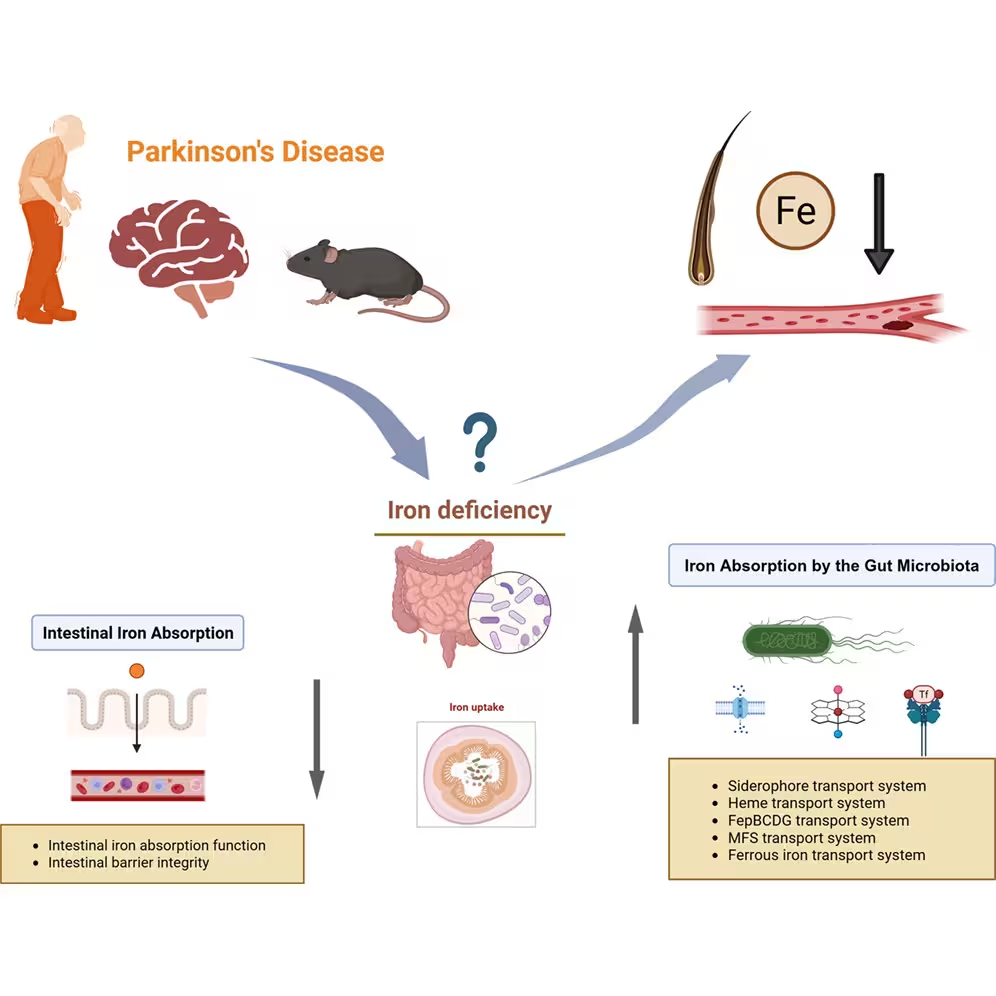
Diese Beobachtungen fügen sich zu einer plausiblen biologischen Erklärung zusammen. Parkinson wird zunehmend als systemische Erkrankung verstanden und nicht ausschließlich als rein zerebrale Störung. Veränderungen im Darmmikrobiom treten oft Jahre vor den motorischen Symptomen auf und könnten eine frühe Phase der Krankheit markieren. Umweltfaktoren — etwa Pestizide, Schwermetallbelastungen oder Ernährungsgewohnheiten — beeinflussen sowohl die Zusammensetzung mikrobieller Gemeinschaften als auch den systemischen Metallstoffwechsel. Das erhöhte Arsen in den Haarproben ist in diesem Zusammenhang bemerkenswert; Arsen-Exposition kann über Nahrungsmittel wie Schalentiere oder Innereien erfolgen, die einige Studienteilnehmende häufiger konsumierten, aber auch über kontaminierte Böden und Wasserquellen.
Eisen spielt eine zentrale Rolle für die neuronale Funktion: Es ist essenziell für Myelinisierung, Neurotransmitter-Synthese und mitochondrialen Energiestoffwechsel. Sowohl Eisenüberladung als auch Eisenmangel wurden mit Neurodegeneration in Verbindung gebracht, abhängig davon, in welchen Geweben und Hirnregionen das Ungleichgewicht auftritt. Wenn Darmdysfunktion und mikrobielle Konkurrenz die verfügbare Eisenmenge für den Wirt reduzieren, könnten sich diese Effekte über Jahre hinweg bis ins Gehirn fortpflanzen. Haar-Eisen könnte daher ein Spiegelbild einer breiteren metabolischen Störung sein, die mit Progression und Pathogenese der Parkinson-Krankheit verbunden ist.
Technisch betrachtet basiert die Messung von Metallen im Haar auf etablierten Methoden der Spurenelementanalytik wie der Massenspektrometrie mit induktiv gekoppeltem Plasma (ICP-MS) oder der Röntgenfluoreszenzanalyse (XRF). Solche Techniken erlauben quantifizierbare, präzise Bestimmungen von Eisen, Kupfer, Mangan, Arsen und anderen Elementen in sehr geringen Konzentrationen. Kritisch ist die Probenvorbereitung: Kontaminationen durch Umwelt- oder kosmetische Produkte müssen kontrolliert, die Proben standardisiert und mögliche externe Quellen (z. B. Haarfärbemittel) berücksichtigt werden, um verlässliche Ergebnisse zu erhalten.
Auswirkungen und nächste Schritte
Diese Forschungsrichtung baut auf einer Übersicht aus dem Jahr 2025 auf, die Hinweise auf Eisen-Fehlregulationen im Gehirn, Blut und Darm von Parkinson-Patienten zusammenfasste. Neu an der aktuellen Studie ist das zugängliche Substrat: Haar. Diese Zugänglichkeit ist für Screening-Programme in großen Bevölkerungsgruppen relevant, vor allem in Regionen, in denen aufwändige Bildgebung und spezialisierte Labortests nur eingeschränkt verfügbar sind.
Die potenziellen Anwendungen reichen von bevölkerungsbasiertem Screening bis hin zu longitudinalen Studien, mit denen der zeitliche Verlauf elementarer Veränderungen vor Ausbruch klinischer Symptome verfolgt werden könnte. Ein weiterer denkbarer Nutzen wäre die Stratifizierung von Patientinnen und Patienten in klinischen Studien: Haar-Elementprofile könnten helfen, Subgruppen mit unterschiedlichem Stoffwechsel- oder Umwelt-Expositionshintergrund zu identifizieren und somit die Aussagekraft therapeutischer Studien verbessern.
Dennoch bleiben viele offene Fragen. Kann das Eisen-Signal spezifisch zwischen Parkinson und anderen neurodegenerativen Erkrankungen unterscheiden, etwa der Multisystematrophie oder der Lewy-Körper-Demenz? In welchem Umfang spiegelt die Haar-Signatur Umwelteinflüsse gegenüber endogenen Stoffwechselveränderungen wider? Und werden größere, multizentrische Kohorten den beobachteten Muster über unterschiedliche Ernährungsgewohnheiten, Wasserqualitäten und berufliche Expositionen hinweg bestätigen?
Methodisch sind Reproduzierbarkeit und Standardisierung entscheidend. Zukünftige Studien sollten standardisierte Probenahmeprotokolle, detaillierte Erhebungen zu Ernährung und Umwelt sowie strenge Kontrollen für externe Kontaminationen einschließen. Longitudinale Designs, die Proben zu verschiedenen Zeitpunkten vor und nach Symptombeginn sammeln, wären besonders aussagekräftig, um kausale Zusammenhänge und zeitliche Abfolgen zu klären.
Auf klinischer Ebene stellt sich die Frage, wie ein Haar-basierter Biomarker in den diagnostischen Workflow integriert werden könnte. Ein mögliches Szenario wäre ein gestuftes Screening: Bei Verdacht auf Parkinson könnte eine einfache Haaranalyse als kostengünstiges, nicht-invasives Erstscreening eingesetzt werden, gefolgt von spezifischeren bildgebenden Verfahren und Liquor- oder Blut-Biomarkern bei positiven Ergebnissen. Solch ein Ansatz würde die Ressourcen schonen und frühzeitige Identifikation verbessern, vorausgesetzt, Sensitivität und Spezifität sind ausreichend hoch.
Experteneinschätzung
"Das ist ein vielversprechender Treffer in einem riesigen Heuhaufen", sagt Dr. Elena Morales, Neurologin und translationale Forscherin, die nicht an der Studie beteiligt war. "Haare liefern eine integrative Messung, die man aus einer einzelnen Blutabnahme nicht erhält, aber wir müssen Signal wirklich von Rauschen trennen. Große, diverse Kohorten und sorgfältige Kontrolle von Ernährung und Umweltexposition sind unabdingbar, bevor das Ganze ein klinisches Instrument werden kann."
Der Weg nach vorn ist klar, aber mühsam: Die Beobachtungen müssen in größeren Populationen reproduziert werden; es muss geprüft werden, ob Haar-Elementmuster das Auftreten der Erkrankung vor klinischen Symptomen vorhersagen können; und die molekulare Kette, die Darmmikroben, eisenregulierende Gene und neuronale Vulnerabilität verknüpft, muss entwirrt werden. Gelingen diese Schritte, könnte eine routinemäßige Haarprobe Teil von Parkinson-Risiko-Screenings werden und ein sonst unsichtbares, systemweites Ungleichgewicht sichtbar machen.
Für den Moment bietet die Studie einen provozierenden Einblick: Unter dem scheinbar banalen Akt eines Haarschnitts könnte ein Archiv liegen — eines, das eine längere Geschichte über Umweltexpositionen, Mikrobiome und die langsamen Verschiebungen erzählt, die neurodegenerativen Erkrankungen vorausgehen.
Erweiterte konzeptionelle Überlegungen: Die Idee, Haare als Biomonitor für neurodegenerative Erkrankungen zu nutzen, passt in ein größeres Paradigma der personalisierten Präventivmedizin. Insbesondere für Parkinson, eine Erkrankung mit heterogener Ätiologie, könnten multimodale Ansätze sinnvoll sein, die genetische Risikofaktoren (z. B. Mutationen in SNCA, LRRK2, GBA), Umweltfaktoren (Pestizide, industrielle Schadstoffe), Stoffwechselmarker (Eisen- und Kupfer-Homöostase) und mikrobiologische Profile kombinieren. Solch integrierte Modelle könnten helfen, individuelle Risikoprofile zu erstellen und gezielte Präventions- oder Interventionsstrategien zu entwickeln.
Praktisch gesehen müssten zukünftige Forschungsvorhaben auch sozioökonomische und ethische Aspekte berücksichtigen: Wer erhält Zugang zu Screenings? Wie werden Daten geschützt? Welche psychosozialen Folgen hat eine frühzeitige Risikoinformation für Betroffene, wenn noch keine kurativen Therapien verfügbar sind? Antworten auf diese Fragen sind notwendig, um den Übergang von Forschung zu sinnvoller klinischer Anwendung verantwortungsvoll zu gestalten.
Zusammenfassend lässt sich sagen: Die Analyse von Haarmetallen stellt eine aufregende, zugängliche Ergänzung zum Werkzeugkasten der Parkinson-Forschung dar. Mit rigoroser Methodik, großer Stichprobengröße und interdisziplinärer Zusammenarbeit könnte die Haaranalyse dazu beitragen, das Verständnis für frühe, systemische Veränderungen bei Parkinson zu vertiefen und möglicherweise einen praktikablen Weg zu früher Erkennung und Risikostratifizierung zu ebnen.
Quelle: sciencealert


Kommentar hinterlassen