8 Minuten
Wissenschaftler an der University of Wisconsin–Madison haben eine überraschende molekulare Partnerschaft entdeckt, die die Enden von Chromosomen schützt. Ihre Entdeckung verknüpft ein bekanntes DNA-bindendes Protein mit der Aktivität der Telomerase und liefert neue Hinweise darauf, warum einige Patientinnen und Patienten unerklärliche, lebensbedrohliche Kurz‑Telomer‑Erkrankungen entwickeln.
Warum Telomere wichtig sind und wo das Rätsel begann
Telomere sind sich wiederholende DNA‑Protein‑Kappen, die sich an den Enden der Chromosomen befinden und verhindern, dass das Genom ausfranst. Jedes Mal, wenn sich eine Zelle teilt, verkürzen sich die Telomere geringfügig — ein normaler Bestandteil des Alterungsprozesses. Werden Telomere jedoch zu kurz oder nicht ausreichend instand gehalten, wird die DNA instabil und Zellen können die Teilung einstellen oder absterben. Diese Vorgänge liegen vielen vorzeitigen Alterungssyndromen und mehreren schweren Blutkrankheiten zugrunde.
Forscherinnen und Forscher haben lange defekte Telomerase, das Enzym, das Telomere wieder aufbaut, mit klinischen Erkrankungen wie aplastischer Anämie, myelodysplastischem Syndrom und akuter myeloischer Leukämie in Verbindung gebracht. Dennoch konnten bei vielen Patientinnen und Patienten mit extrem verkürzten Telomeren keine Mutationen in der Telomerase selbst die Erkrankung erklären. Diese Wissenslücke war der Antrieb für die hier berichtete Studie und motivierte das Team, nach bislang übersehenen molekularen Faktoren zu suchen, die Telomerasefunktion und Telomer‑Stabilität beeinflussen.
Die unklaren Ursachen bei idiopathischer Telomerverkürzung haben erhebliche klinische Konsequenzen: Ohne eine molekulare Erklärung bleiben Diagnosen unvollständig, Prognosen unsicher und therapeutische Ansätze eingeschränkt. Die neue Studie adressiert genau diese Lücke, indem sie eine zusätzliche regulatorische Komponente identifiziert, die bei der Erhaltung der Telomerlänge eine Rolle spielt.
Wie ein unerwarteter Partner in den Fokus rückte
Unter Leitung von Professor Ci Ji Lim nutzte das Team der UW–Madison die strukturvorhersagende Maschine AlphaFold — ein auf maschinellem Lernen basierendes Werkzeug zur Vorhersage von Proteinstrukturen und Protein‑Protein‑Interaktionen —, um nach Proteinen zu suchen, die mit menschlicher Telomerase interagieren könnten. Solche computergestützten Suchen ermöglichen es, Kandidaten schnell zu priorisieren und Hypothesen zu generieren, die anschließend experimentell geprüft werden können.
Die computationalen Screens identifizierten das Replikationsprotein A, kurz RPA — ein weit verbreitetes Einzelstrang‑DNA‑bindendes Protein, das vor allem für seine Rollen bei DNA‑Replikation und DNA‑Reparatur bekannt ist — als plausiblen Partner der Telomerase. RPA ist evolutionär konserviert und spielt zentrale Rollen in der Genomstabilität; seine Verbindung zur Telomerase war bislang nicht vollständig geklärt und damit wissenschaftlich hochrelevant.
Die Entdeckung war insofern überraschend, als RPA primär mit Prozessen in Verbindung gebracht wurde, die an Replikationsgabeln und Reparaturkomplexen stattfinden. Dass RPA zusätzlich telomerische Funktionen ausüben könnte, erweitert das Verständnis der molekularen Netzwerke, die Telomererhalt steuern, und liefert neue Ansatzpunkte für molekulare Diagnostik und mögliche Therapien.
Vom Modell zum Molekül: experimentelle Validierung
Gestützt auf die AlphaFold‑Vorhersagen führten der Doktorand Sourav Agrawal, die Forschungswissenschaftlerin Xiuhua Lin und der Postdoktorand Vivek Susvirkar biochemische Experimente durch, die die computationalen Hypothesen bestätigten. In humanen Zelllinien zeigte sich, dass RPA erforderlich ist, um die Telomeraseaktivität zu stimulieren und die Telomerlänge zu erhalten.
Die experimentellen Ansätze umfassten gezielte Depletionen von RPA, Rescue‑Experimente mit rekombinanten Proteinen sowie In‑vitro‑Assays zur Messung der Telomeraseaktivität. Diese Methoden belegten konsistent, dass RPA nicht nur Einzelstrang‑DNA während Replikation und Reparatur bindet, sondern auch die Funktion der Telomerase an den Chromosomenenden unterstützt. Mechanistisch scheint RPA die Zugänglichkeit oder Konformation der telomerischen DNA bzw. der Telomerase‑Ribonukleoprotein‑Komplexe so zu beeinflussen, dass die Verlängerung der Telomere effizienter ablaufen kann.
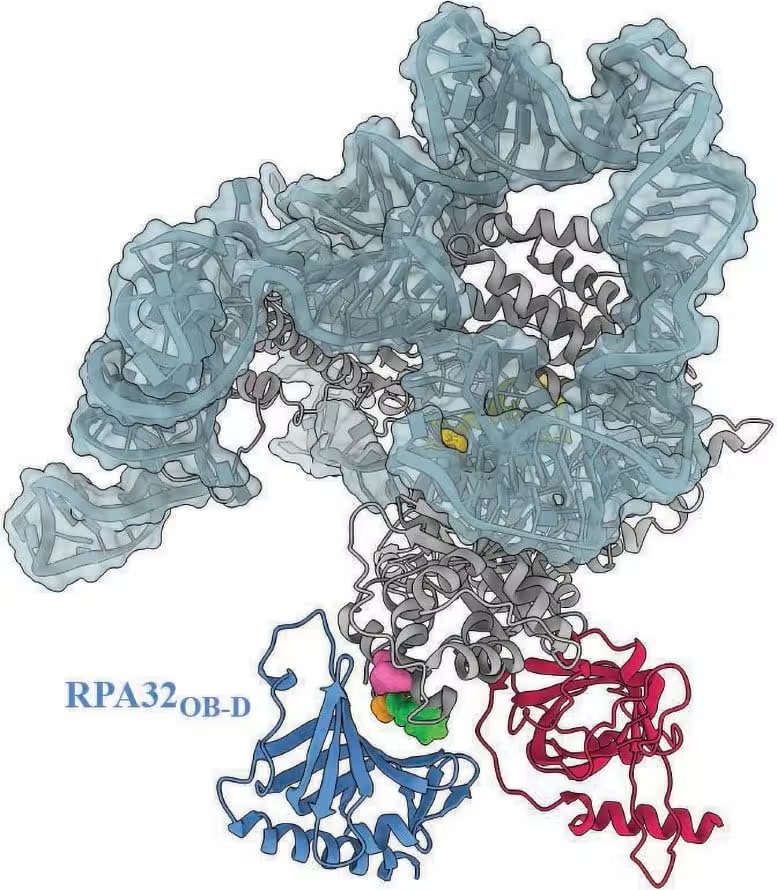
Ein Modell des menschlichen Telomerasekomplexes hebt die Stelle hervor, an der RPA voraussichtlich andockt. Drei strukturelle Varianten der Telomerase, die mit Erkrankungen bei Patientinnen und Patienten in Verbindung gebracht wurden, liegen innerhalb dieser Andockzone. Das legt nahe, dass diese Varianten die Interaktion zwischen RPA und Telomerase behindern könnten. Credit: Ci Ji Lim
Zusätzlich zu den klassischen biochemischen Tests wurden Strukturmodelle und Mutationsanalysen zusammengeführt, um zu zeigen, wie bestimmte Varianten die Kontaktfläche zwischen RPA und Telomerase stören könnten. Solche kombinatorischen Ansätze — strukturelle Vorhersage plus experimentelle Überprüfung — erhöhen die Aussagekraft und Reproduzierbarkeit der Ergebnisse.
Klinische Implikationen: eine fehlende Erklärung für Kurz‑Telomer‑Erkrankungen
Lim betonte die klinische Bedeutung der Ergebnisse: "Diese Forschungsrichtung geht über ein rein biochemisches Verständnis eines molekularen Prozesses hinaus. Sie vertieft das klinische Verständnis von Telomererkrankungen." Das Team zeigte, dass einige krankheitsassoziierte Varianten der Telomerase innerhalb der vorhergesagten RPA‑Andockstelle liegen. Diese räumliche Überlappung legt nahe, dass diese Varianten RPA daran hindern könnten, die Telomerase zu stimulieren, was das bislang unerklärte Kurz‑Telomer‑Phänotyp erklären würde, den Klinikerinnen und Kliniker bei bestimmten Patientinnen und Patienten beobachtet haben.
Für die klinische Genetik ist das von direkter Relevanz: Die Entdeckung liefert Ärztinnen, Ärzten und Humangenetikerinnen einen neuen Testansatz. Statt ausschließlich nach Mutationen in telomerischen Kernkomponenten zu suchen, können Untersuchungen nun gezielt Varianten analysieren, die die RPA–Telomerase‑Interaktion stören. Solche Tests könnten bisher unerklärte Fälle aufklären und helfen, genetische Diagnosen zu präzisieren.
Darüber hinaus hat die Korrelation zwischen bestimmten Telomerasevarianten und gestörter RPA‑Stimulation direkte Prognose‑ und Therapieimplikationen: Wenn eine gestörte Interaktion identifiziert wird, lässt dies Rückschlüsse auf den molekularen Mechanismus, die Schwere des Defekts und mögliche therapeutische Strategien zu — etwa die Entwicklung von Molekülen, die die Interaktion stabilisieren oder RPA‑Funktion pharmakologisch substituieren.
Weltweites Interesse und nächste Schritte für Tests
Die Arbeit hat bereits internationale Aufmerksamkeit erregt. Lim berichtet von Anfragen aus Kliniken und Forschungsgruppen in Ländern wie Frankreich, Israel und Australien, die biochemische Tests wünschen, um zu prüfen, ob die Mutationen ihrer Patientinnen und Patienten die RPA‑Bindung oder die Stimulierung der Telomerase beeinträchtigen.
Solche internationalen Kooperationen sind entscheidend, um die Validität der Befunde in unterschiedlichen genetischen Kontexten zu prüfen, größere Kohorten zu analysieren und die klinische Relevanz quantitativ zu bewerten. Der Aufbau standardisierter biochemischer Assays, gekoppelt an genetische Sequenzdatenbanken, wird helfen, Varianten systematisch zu klassifizieren und klinische Entscheidungsbäume zu verbessern.
"Es gibt Patientinnen und Patienten mit verkürzten Telomeren, deren Befunde sich mit unserem bisherigen Wissensstand nicht erklären ließen", sagte Lim. "Jetzt haben wir für einen Teil dieser Telomer‑Erkrankungsvarianten eine zugrunde liegende Ursache: Ergebnis einer fehlenden Fähigkeit von RPA, die Telomerase zu stimulieren." Mit validierten biochemischen Assays kann das Team Patientenvarianten beurteilen und Ärztinnen sowie Ärzten Einsichten in mögliche Mechanismen, Prognosen und potenzielle therapeutische Ansätze liefern.
Langfristig könnte dies klinische Richtlinien beeinflussen: Genetische Testpanels für Telomeropathien könnten um Analysen ergänzt werden, die nicht nur Sequenzveränderungen, sondern auch deren funktionelle Auswirkung auf Protein‑Protein‑Interaktionen berücksichtigen. Solche integrativen Diagnostik‑Pipelines verbessern die Aussagekraft genetischer Befunde und fördern personalisierte Therapieansätze.
Werkzeuge und Technologien, die dies ermöglichten
Die Studie zeigt exemplarisch, wie moderne Strukturvorhersage‑Tools wie AlphaFold nützliche Hypothesen für die experimentelle Biologie liefern können. Indem Kandidateninteraktionen computergestützt priorisiert wurden, konnten die Forschenden den experimentellen Suchraum deutlich einschränken und anschließend RPAs Rolle über klassische biochemische Assays validieren. Dieses kombinierte Vorgehen beschleunigt den Weg von der Hypothese zur klinisch relevanten Erkenntnis.
Die Arbeit unterstreicht zudem die zunehmende Bedeutung interdisziplinärer Zusammenarbeit zwischen Biochemie, molekularer Genetik und computergestützter Strukturbiologie. Solche Kooperationen ermöglichen die Entwicklung robuster, reproduzierbarer Methoden zur Untersuchung proteinbasierter Regulationsmechanismen und fördern die Translation grundlegender Forschungsergebnisse in die klinische Anwendung.
Technologisch ergibt sich daraus ein Vorteil für die Diagnostik: Reproduzierbare in‑vitro‑Assays, unterstützt durch strukturbiologische Modelle, erlauben es, Varianten in kurzer Zeit auf ihren funktionellen Einfluss zu prüfen. In Kombination mit klinischer Phänotypisierung und Familienanamnese kann dies die Diagnostik von Telomeropathien deutlich verbessern.
Expertinnen‑ und Experteneinschätzung
Dr. Elena Morales, eine molekulargenetische Forscherin, die nicht an der Studie beteiligt war, bemerkte: "Die Verknüpfung von RPA mit Telomerase eröffnet eine neue Ebene der Regulation für die Telomererhaltung. Klinisch hilft dies, einen Teil der Patientinnen und Patienten mit idiopathischer Telomerverkürzung zu erklären. Therapeutisch wäre es spannend, Wege zu finden, die Stimulierung der Telomerase durch RPA wiederherzustellen oder zu imitieren."
Morales betonte auch die Bedeutung weitergehender funktionaler Studien: "Um therapeutische Ansätze zu entwickeln, benötigen wir detaillierte Kenntnisse darüber, wie RPA die Telomerase mechanistisch beeinflusst — ob über allosterische Effekte, Stabilisierung des Telomerase‑RNPs oder Veränderung der DNA‑Substratkonformation." Solche Einsichten würden zielgerichtete Medikamentenentwicklung oder genetische Interventionen erleichtern.
Während Forschende die Testkapazitäten erweitern und Patientenvarianten systematisch auf ihre Wirkung auf die RPA‑Interaktion screenen, ist zu erwarten, dass Diagnosen für Familien mit Kurz‑Telomer‑Syndromen schneller erfolgen. Langfristig könnten daraus molekular begründete Behandlungskonzepte entstehen, die spezifisch auf die jeweils identifizierten Mechanismen abzielen — sei es durch kleine Moleküle, Peptidmimetika oder gentechnische Ansätze.
Quelle: scitechdaily

Kommentar hinterlassen