9 Minuten
Im Jahr 1972 fiel Klinikern etwas Auffälliges auf: Die Blutprobe einer schwangeren Frau fehlte ein Oberflächenmolekül, das bei allen anderen bekannten roten Blutkörperchen vorhanden war. Mehr als fünf Jahrzehnte blieb dieses Fehlen eine ungelöste Besonderheit. Im Jahr 2024 konnten Forscher aus dem Vereinigten Königreich und Israel die Ursache schließlich zurückverfolgen und ein zuvor nicht erkanntes menschliches Blutgruppensystem beschreiben, das mit diesem fehlenden Marker verknüpft ist.
Wie ein einziges fehlendes Molekül einen 50 Jahre alten Fall wieder aufdeckte
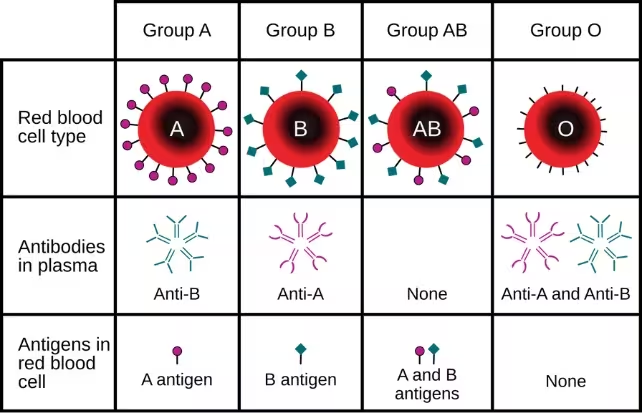
Wenn die meisten Menschen „Blutgruppe" hören, denken sie an ABO und Rh. Tatsächlich tragen menschliche Erythrozyten jedoch eine Vielzahl von Proteinen und Zuckern auf ihrer Oberfläche, die als antigenische Identitätstags fungieren. Diese Antigene informieren das Immunsystem darüber, welche Zellen „eigen" sind und welche als fremd erkannt werden — eine Unterscheidung, die insbesondere bei Bluttransfusionen lebenswichtig ist. Die Disziplin der Transfusionsmedizin und Immunhämatologie hängt stark von der genauen Identifikation dieser Blutgruppenantigene ab.
Bei Routineuntersuchungen tragen mehr als 99,9 % der Menschen ein Antigen, das als AnWj bekannt ist. Die Erythrozyten der Patientin von 1972 wiesen diesen Marker nicht auf, und über Jahre fragten sich Forscher, ob es sich um eine Laboranomalie, einen vorübergehenden Zustand oder um einen Hinweis auf ein seltenes vererbtes Merkmal handelte. Solche Fälle werfen auch grundlegende Fragen zur Genexpression, zur Membranbiologie und zu möglichen regulatorischen Mechanismen auf.
Die Entdeckung des fehlenden AnWj-Antigens war nicht nur ein Kuriosum; sie eröffnete eine langfristige wissenschaftliche Untersuchung mit Konsequenzen für Blutbanken, Genetiker und Kliniker. Die genaue Identifizierung eines Antigens verändert Screening- und Teststrategien, schützt vor Transfusionszwischenfällen und verbessert die Versorgung von Patienten mit seltenen Phänotypen.
Vom genetischen Spurensuchen zur Benennung eines neuen Systems
Jahrzehntelang durchforstete man Laborakten, Blutspendeaufzeichnungen und Fallberichte sowie archivierte Proben. Kombinationen aus Serologie, molekularer Genetik und funktionellen Tests führten schließlich zum molekularen Täter: Mutationen im MAL-Gen. Das MAL-Gen kodiert ein kleines, membrannahes Protein, das eine Rolle bei der Stabilisierung der Zellmembran und bei intrazellulären Transportprozessen hat. Da das AnWj-Antigen auf diesem Protein lokalisiert ist, benannte das Forscherteam die neu definierte Klassifikation als MAL-Blutgruppe.
Hämatologin Louise Tilley vom National Health Service des Vereinigten Königreichs, die einen großen Teil der langfristigen Untersuchung leitete, beschrieb das Ergebnis als „eine große Leistung" und als die Culmination jahrelanger Zusammenarbeit, die die Versorgung seltener Patienten verbessern werde. Zellbiologe Tim Satchwell von der University of the West of England hob die praktische Schwierigkeit hervor: „MAL ist ein sehr kleines Protein mit einigen besonderen Eigenschaften, was es schwierig machte, es zu identifizieren, und uns dazu zwang, mehrere Untersuchungsansätze zu verfolgen, um den Beweis zu erbringen, den wir brauchten, um dieses Blutgruppensystem zu etablieren."
Die Identifikation eines neuen Blutgruppensystems setzt oft voraus, mehrere unabhängige Beweislinien zusammenzuführen: serologische Daten, genetische Korrelationen und funktionelle Wiederherstellungsversuche. In diesem Fall ergänzten historische Fallberichte die moderne Molekulardiagnostik und illustrierten, wie Archivmaterial für heutige Entdeckungen wertvoll sein kann.
Wie Forscher das Gen als Ursache nachwiesen
Um über reine Korrelation hinauszugehen, wandten die Forscher funktionelle Genetik an. Sie führten ein intaktes MAL-Gen in Blutzellen ein, die AnWj-negativ waren, und beobachteten, dass diese Zellen daraufhin das AnWj-Antigen exprimierten. Dieses Wiederherstellungsexperiment lieferte schlüssige Hinweise dafür, dass MAL — und nicht ein unzusammenhängender Faktor — die Präsenz des AnWj-Antigens bestimmt.
Darüber hinaus zeigten genetische Analysen, dass alle in der Studie identifizierten Patienten mit dem AnWj-negativen Phänotyp dieselbe MAL-Mutation aufwiesen, wenn beide Allele betroffen waren. Dies legt einen klassischen rezessiven Erbgang nahe für die Formen, die durch strukturelle Veränderungen im MAL-Gen verursacht werden. Intriguierenderweise fanden die Forscher außerdem drei Personen, die AnWj nicht exprimierten, obwohl sie diese spezifische Mutation nicht trugen; dies deutet darauf hin, dass bestimmte hämatologische Störungen oder regulatorische Mechanismen die Antigenexpression unterdrücken können.
Solche Fälle, in denen Phänotypen ohne offensichtliche Genmutation auftreten, sind in der Immunhämatologie wichtig, weil sie klinisch andere Konsequenzen haben können: Eine durch Suppression verursachte Antigenverlustsituation ist oft reversibel oder ein Hinweis auf eine zugrunde liegende Erkrankung, während ein genetisch verankerter Verlust dauerhafter und erblich sein kann.

Klinische Bedeutung: Warum das für Transfusionen wichtig ist
Bluttransfusionen beruhen auf einem sorgfältigen Abgleich von Antigenen. Stimmen die Antigenprofile von Spender und Empfänger nicht überein, können Antikörperreaktionen von milden Transfusionsnebenwirkungen bis zu lebensbedrohlichen hämolytischen Reaktionen reichen. Transfusionsreaktionen können akut oder verzögert auftreten und sind eine ernste Komplikation in der klinischen Praxis.
Obwohl das MAL/AnWj-System nur einen winzigen Bruchteil aller Transfusionen betreffen wird — die AnWj-Negativität ist extrem selten — ist seine Identifikation dennoch bedeutsam, weil seltene Diskrepanzen historisch beträchtliche klinische Probleme verursacht haben. Sobald die genetischen Marker, die dem AnWj-negativen Zustand zugrunde liegen, bekannt sind, können Labore feststellen, ob ein Patient den Phänotyp vererbt hat oder ob eine Antigensuppression vorliegt. Diese Unterscheidung kann auf andere zugrunde liegende Erkrankungen hinweisen und die Transfusionsstrategie für betroffene Personen leiten.
Für Blutbanken bedeutet dies: Zielgerichtetes Screening, Integration genetischer Tests in Situationen mit unklarer Serologie und der Aufbau von Registries für seltene Blutgruppentypen. In Notfallsituationen bleiben serologische Tests die Grundlage, doch für Patienten mit wiederholten Transfusionsbedarfen — beispielsweise bei Thalassämie oder Sichelzellkrankheit — kann die Kenntnis von MAL-Status und AnWj-Expression entscheidend sein, um alloimmunen Reaktionen vorzubeugen.
Weiterhin erlaubt die molekulare Charakterisierung den Aufbau von kompatiblen Blutdepots für seltene Phänotypen und unterstützt die Entwicklung genbasierter Screening-Algorithmen, die ergänzend zur traditionellen Serologie eingesetzt werden können. Gesundheitssysteme müssen abwägen, wann genetische Tests kosteneffizient sind: bei ungewöhnlichen Antikörpern, wiederholten Transfusionsreaktionen oder unklarer Serologie sind sie jedoch besonders hilfreich.
Was wir noch lernen müssen
Wesentliche Fragen bleiben offen. Warum erscheint das AnWj-Antigen erst nach der Geburt? Die ontogenetische Regulation vieler Erythrozytenantigene variiert: Manche Antigene werden erst in späteren Entwicklungsphasen exprimiert, andere können durch epigenetische Mechanismen reguliert werden. Ob MAL-Expression einem entwicklungsbedingten Schalter folgt oder ob weitere kofaktorielle Proteine beteiligt sind, ist Gegenstand laufender Forschung.
Gibt die MAL-Mutation subtile physiologische Effekte jenseits der veränderten Antigenpräsentation? In der untersuchten Kohorte konnte keine konsistente Erkrankung oder andere Zellanomalien mit der Mutation verknüpft werden, doch die Fallzahl ist klein, da solche Fälle sehr selten sind. Längerfristige Beobachtungsdaten und größere Populationsstudien sind nötig, um mögliche subtile Auswirkungen auf Membranstabilität, Signaltransduktion oder zellulären Transport zu erkennen.
Zukünftige Arbeiten werden die Populationsprävalenz untersuchen, die Mechanismen analysieren, die in nicht-mutierten Patienten die Antigenexpression unterdrücken, und erarbeiten, wie MAL-Screening ohne unnötige Testbelastung in Blutbankabläufe integriert werden kann. Zentral ist auch die Bewertung des klinischen Nutzens genetischer Tests gegenüber serologischen Methoden und die Entwicklung kosteneffizienter Algorithmen für die Routinediagnostik.
Darüber hinaus sind interdisziplinäre Studien sinnvoll, die Epidemiologen, Molekulargenetiker, Immunhämatologen und Blutspendedienste zusammenführen, um Standardisierungen in der Testung und in der Dokumentation seltener Phänotypen zu erreichen. Aufbauend auf internationalen Datenbanken lassen sich dann Häufigkeit, geographische Verteilung und mögliche ethnische Unterschiede der MAL-Varianten besser bestimmen.
Expertise und praktische Empfehlungen
„Solche Entdeckungen erinnern uns daran, dass die menschliche Biologie weiterhin Überraschungen bereithält," sagt Dr. Amelia Hart, eine fiktive, aber realistisch dargestellte Expertin für Transfusionsmedizin. „Für Blutdienste ist die Herausforderung praktisch: diejenigen identifizieren, die besondere Versorgung benötigen, kompatibles Blut bereitstellen und das kosteneffizient tun. Die Kenntnis des Gens hinter einem seltenen Antigen erlaubt uns, präzise Gentests zu entwickeln, die eingesetzt werden können, wenn die Serologie keine eindeutige Antwort liefert."
Für Patienten, die aufgrund vererbter MAL-Mutationen AnWj-negativ sind, bietet genetisches Testen nun Klarheit: Vererbung vs. Suppression, individualisierte Transfusionsplanung und frühzeitige Hinweise auf mögliche Komplikationen. Für Forscher unterstreicht die MAL-Entdeckung, wie sorgfältige Archivarbeit, moderne molekulare Techniken und internationale Kooperation ungelöste Rätsel über Generationen hinweg lösen können.
Praktische Empfehlungen für Kliniker und Blutbanken umfassen:
- Bei unklarer Serologie oder wiederholten Transfusionsreaktionen MAL-Genetik in Erwägung ziehen.
- Bei AnWj-negativen Befunden zwischen genetisch determiniertem Phänotyp und Antigensuppression unterscheiden, da dies unterschiedliche klinische Implikationen hat.
- Kooperation mit nationalen Referenzlaboren und Teilnahme an Registries für seltene Blutgruppen fördern, um kompatible Spender zu identifizieren.
- Information und genetische Beratung für betroffene Familien anbieten, da vererbbare Formen weitergegeben werden können.
Insgesamt bietet die Identifikation des MAL-Blutgruppensystems eine verbesserte diagnostische Grundlage und Handlungsoptionen zur Minimierung von Transfusionsrisiken und zur besseren Betreuung von Menschen mit seltenen Blutgruppen.
Forschungsperspektiven und Zusammenfassung
Die Entdeckung verdeutlicht mehrere wichtige Prinzipien: Erstens die Bedeutung historischer klinischer Beobachtungen kombiniert mit modernen Methoden; zweitens den Wert funktioneller Genetik zur Etablierung kausaler Zusammenhänge; drittens die klinische Relevanz selbst äußerst seltener Antigene für die Transfusionsmedizin. Die Charakterisierung von MAL als Träger des AnWj-Antigens integriert molekulare Genetik mit Immunhämatologie und liefert konkrete Werkzeuge zur Verbesserung der Patientensicherheit.
Zukünftige Studien sollten sich auf folgende Aspekte konzentrieren: groß angelegte Sequenzanalysen zur Bestimmung der Prävalenz von MAL-Varianten in verschiedenen Populationen, mechanistische Untersuchungen zur Regulation der MAL-Expression und prospektive klinische Studien zur Bewertung des Nutzens genetischer Teststrategien im Transfusionsmanagement. Außerdem ist die Weiterentwicklung von internationalen Datenbanken und die Harmonisierung von Nomenklatur und Testverfahren essenziell, um den klinischen Nutzen maximal zu gestalten.
Für die meisten Patienten und Transfusionen bleibt die bestehende Kombination aus ABO- und Rh-Testing sowie einer standardisierten serologischen Diagnostik ausreichend. Für die wenigen Fälle, die von seltenen Antigenvarianten wie AnWj betroffen sind, schafft die neue Erkenntnis jedoch die Grundlage für präzise Diagnostik, bessere Versorgung und geringeres Risiko bei Bluttransfusionen.
Quelle: sciencealert

Kommentar hinterlassen