8 Minuten
Speziell im Labor erzeugte, "junge" Immunzellen aus menschlichen induzierten pluripotenten Stammzellen (iPSCs) scheinen bei gealterten Mäusen Teile der kognitiven Leistung und die Gesundheit von Gehirnzellen wiederherzustellen, so eine neue Studie des Cedars-Sinai Medical Center. Die Arbeit deutet auf einen zellbasierten Ansatz hin, um altersbedingtem kognitiven Abbau und bestimmte Merkmale der Alzheimer-Krankheit entgegenzuwirken, obwohl wichtige Einschränkungen und offene Fragen verbleiben.
Warum Reinigungs‑Immunzellen für das alternde Gehirn wichtig sind
Mononukleäre Phagozyten sind mobile Immunzellen, die den Körper nach Abfallstoffen und toten Zellen absuchen und diese beseitigen. In der Hirnparenchym‑Umgebung erscheint ihre spezialisierte Form — die Mikroglia — als zentrales Regulativ für Entzündung und die Entfernung aggregierter Proteine wie Amyloid- und Tau‑Aggregate. Mit zunehmendem Alter verringert sich jedoch die Effizienz dieser zellulären "Reiniger"; sie zeigen eine veränderte Genexpression, eingeschränkte Phagozytose und können proinflammatorische Signale verstärken. Diese Kombination wird mit kognitivem Leistungsabfall, Synapsenverlust und dem Risiko neurodegenerativer Erkrankungen wie Alzheimer in Verbindung gebracht.
Die Rolle von Immunzellen, systemischen Faktoren und extrazellulären Vesikeln in der Neuroimmunologie ist ein wachsendes Forschungsfeld. Erkenntnisse aus Studien zu Blut‑austausch, Blutplasma‑Transfer und Knochenmarktransplantationen legen nahe, dass sowohl blutgebundene Proteine als auch zelluläre Komponenten die Gehirnalterung modulieren können. Die Identifizierung mononukleärer Phagozyten als mögliche Mediatoren liefert nun einen spezifizierteren Zielpunkt für therapeutische Interventionen.
Wie die Forschenden ein "jünger wirkendes" Immunsystem rekonstruierten
Anstatt junges Blut zu übertragen, züchtete das Team um die Forschenden am Cedars-Sinai mononukleäre Phagozyten im Labor aus menschlichen iPSCs. Induzierte pluripotente Stammzellen sind reprogrammierte somatische Zellen, die pluripotente Eigenschaften zurückerlangen und sich in verschiedene Zelltypen differenzieren lassen. Diese iPSC-Technologie erlaubt die Herstellung erneuerbarer, potenziell patientenspezifischer therapeutischer Zelllinien, was die Grundlage für individualisierte oder standardisierte zellbasierte Therapien sein kann.
Die Gruppe kultivierte definierte Zellpopulationen, charakterisierte deren Phänotyp durch Oberflächenmarker und Transkriptomanalysen und etablierte Protokolle zur Herstellung von belastbaren Chargen mononukleärer Phagozyten unter kontrollierten Bedingungen. Anschließend injizierten die Forschenden diese ingenieurmäßigen, "jugendlichen" mononukleären Phagozyten in natürlich gealterte Mäuse sowie in Mausmodelle mit Alzheimer-ähnlicher Pathologie, um zu prüfen, ob die Zellen kognitive Parameter und die Gesundheit des Hippocampus beeinflussen.
Illustration von Amyloidplaques (orange) und Mikroglia‑Zellen (rot) zwischen Neuronen
Ermutigende Verbesserungen — aber kein Allheilmittel
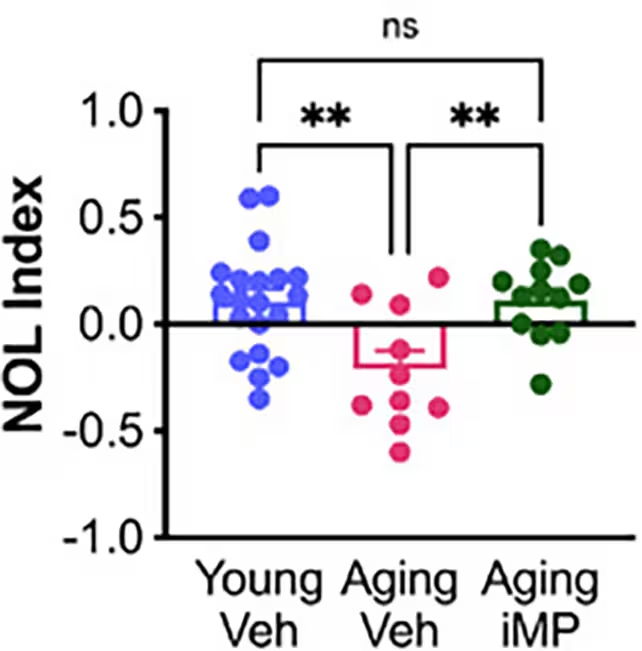
In Verhaltensaufgaben, etwa dem Test zur Erkennung eines neu platzierten Objekts (novel object location task), erreichten ältere Mäuse, die die im Labor hergestellten Immunzellen erhielten (in der Studie als "Aging iMP" bezeichnet), Leistungswerte, die denen jüngerer Kontrolltiere ähnelten. Solche Verhaltensdaten deuten darauf hin, dass bestimmte kognitive Domänen, wie räumliches Gedächtnis und Orientierung, durch systemische zelluläre Interventionen beeinflusst werden können. Diese Ergebnisse sind im Kontext der Alzheimer-Forschung bedeutsam, da kognitive Endpunkte direkt mit alltäglichen Funktionen korrelieren.
Zusätzlich zeigten die behandelten Tiere Hinweise auf eine gesündere Mikroglia‑Morphologie und -Funktion sowie den Erhalt von Moose‑Zellen (mossy cells) im Hippocampus — einer neuronalen Population, die das Gedächtnis stützt und typischerweise mit dem Alter und bei Alzheimer abnimmt. Die Autorinnen und Autoren berichten, dass die Zahl der Mossy‑Zellen in behandelten Mäusen stabil blieb, was eine plausibel kausale Verbindung zu den beobachteten Gedächtnisgewinnen nahelegt.
Coautor Clive Svendsen betont die praktische Seite des Ansatzes: Anstatt ganze junge Plasmen zu transfundieren, könnten gezielt hergestellte Immunzellen verjüngende Faktoren liefern und gleichzeitig unter klinischen Qualitätsstandards produziert werden, was Standardisierung, Reinheit und Skalierbarkeit verbessern würde. Dies ist relevant für die Translation in klinische Studien und die Herstellung nach Good Manufacturing Practice (GMP).
Was gelangte tatsächlich ins Gehirn?
Bemerkenswert ist, dass die injizierten Immunzellen offenbar nicht in nennenswerter Zahl physisch ins Gehirngewebe einwanderten. Diese Beobachtung deutet auf einen indirekten Wirkmechanismus hin: Die im Kreislauf zirkulierenden, jungen mononukleären Phagozyten könnten sekretorische Faktoren, lösliche Proteine oder extrazelluläre Vesikel (kleine Signalpakete, die Moleküle zwischen Zellen transportieren) freisetzen, die die Blut‑Gehirn‑Schranke passieren oder entlang neuroimmuner Achsen wirken. Solche molekularen Botschaften könnten systemische Entzündung reduzieren, residenten Mikroglia entweder direkt stimulieren oder deren phänotypische Reprogrammierung anstoßen und so synaptischen Erhalt und neuronale Homöostase fördern.
Systemische‑zu‑Gehirn‑Signalisierung ist ein aktives Forschungsfeld in der Neuroimmunologie und umfasst Mechanismen wie Transport über Endothelzellen, Aufnahme durch perivaskuläre Makrophagen, oder Wirkung über periphere Nervensystempfade. Das Modell legt nahe, dass zellfreie Komponenten, insbesondere extrazelluläre Vesikel (Exosomen, Mikrovesikel), als therapeutisch attraktive, potenziell weniger immunogene Alternativen zu Vollzelltherapien untersucht werden können.
Einschränkungen und Vorbehalte
Die Vorteile waren in den natürlich gealterten Mäusen am ausgeprägtesten; in den Alzheimer‑Modellen fielen die Effekte moderater aus. Deutliche Alzheimer‑assoziierte Schädigungen, etwa die Akkumulation von Amyloid‑Beta oder ausgeprägte Tauopathie, konnten nicht vollständig rückgängig gemacht werden. Dies unterstreicht, dass ein einzelner interventioneller Ansatz wahrscheinlich nicht alle pathologischen Aspekte der Alzheimer‑Krankheit adressiert.
Wichtig ist zudem die Übertragbarkeit: Ergebnisse aus Nagetiermodellen lassen sich nicht ohne Weiteres auf den Menschen übertragen. Unterschiede in Immunologie, Lebensspanne, komplexer Kognition und Pathophysiologie erfordern umfangreiche präklinische Sicherheitsstudien in größeren und relevanteren Modellen sowie eine strenge toxikologische Bewertung. Fragen zu Dosis, Häufigkeit der Verabreichung, Langzeitwirkung, potenzieller Immunogenität der iPSC‑abgeleiteten Zellen und der Balance zwischen entzündungshemmenden und immunstimulierenden Effekten müssen geklärt werden, bevor klinische Studien beim Menschen beginnen können.
Weitere Risiken betreffen die Herstellung: iPSC‑Abkömmlinge können genetische und epigenetische Variabilität aufweisen; es müssen robuste Qualitätskontrollen etabliert werden, um das Risiko von unerwünschter Differenzierung oder Tumorbildung (Teratomrisiko) zu minimieren. Regulatorische Hürden, Anforderungen an GMP‑Produktion und die Kosten für individualisierte Zelltherapien bleiben substanzielle Barrieren.
Potentieller Weg zur Therapie und zukünftige Richtungen
Wenn sich iPSC‑abgeleitete mononukleäre Phagozyten aus den eigenen Zellen eines Patienten herstellen lassen, könnten sie einige Komplikationen von Plasmashifts oder Knochenmarktransplantationen umgehen, etwa immunologische Inkompatibilitäten oder die Notwendigkeit intensiver Immunsuppression. Autologe Ansätze vermindern zwar das Risiko von Abstoßungsreaktionen, sie erhöhen jedoch die Komplexität und Kosten der Produktion. Alternativ könnten allogene, standardisierte Zelllinien mit geringerer Immunogenität entwickelt werden, die als "Off‑the‑shelf"‑Produkte dienen.
Die Forscherinnen und Forscher schlagen vor, dass eine kurzfristige systemische Behandlung ausreichen könnte, um die Immun‑Signalkaskaden neu zu kalibrieren und so die kognitive Funktion zu verbessern. Dieser Ansatz öffnet Wege für gezielte zell‑ oder vesikelbasierte Therapien gegen alters- und Alzheimer‑assoziierten kognitiven Abbau. Zu prüfen sind dabei Kombinationstherapien: etwa die Kombination von zellbasierten Ansätzen mit Antikörpern gegen Amyloid, kleinen Molekülen zur Modulation von Tau‑Pathologie oder neurotrophen Faktoren, die neuronalen Erhalt fördern.
Technische Weiterentwicklungen könnten die Identifizierung und Isolierung der aktiven Moleküle ermöglichen — sei es ein spezifisches Cytokin‑Profil, Mikro‑RNA‑Signaturen in Exosomen oder membranassoziierte Proteine — die für die neuroprotektiven Effekte verantwortlich sind. Ließen sich diese Mediatoren charakterisieren, wären pharmakologische oder biologische Nachahmer denkbar, die die Verjüngungssignale ohne Zelltransplantation reproduzieren.
Expertinnen‑ und Experteneinschätzung
"Diese Studie hebt das Immunsystem als Hebel für die Gehirnalterung hervor", sagt die fiktive Neuroimmunologin Dr. Lena Ortiz vom Institute for Brain Health. "Selbst ohne direkten Eintritt der Zellen ins Gehirn können periphere Immunzellen molekulare Botschaften senden, die Entzündungszustände umformen und neuronale Netzwerke unterstützen. Die Herausforderung besteht nun darin, diese molekularen Signale in eine reproduzierbare und sichere Therapie für Menschen zu überführen."
Aus Fachsicht sind mehrere Aspekte kritisch: robuste Reproduzierbarkeit der Effekte, Identifikation der wirksamen Faktoren, Minimierung systemischer Nebenwirkungen und das Design geeigneter klinischer Endpunkte für kognitive Tests bei Menschen. Die Interdisziplinarität zwischen Stammzellbiologie, Neuroimmunologie, Neuropathologie und klinischer Neurologie wird hierbei entscheidend sein.
Wie die Forschung in das größere Bild passt
Die Ergebnisse fügen sich in eine wachsende Evidenzbasis ein, laut der systemische Faktoren — blutgetragene Proteine, Immunzellen und extrazelluläre Vesikel — die Gehirnalterung modulieren. Frühere Experimente zeigten kognitive Verbesserungen, wenn ältere Tiere junges Blut oder Knochenmark erhielten; die aktuelle Studie isoliert mononukleäre Phagozyten als plausible Mediatoren und liefert zugleich einen herstellbaren Ansatz, um diesen Effekt zu reproduzieren.
Konkrete nächste Schritte umfassen die Kartierung aktiver Moleküle, die von den ingenieurisierten Zellen freigesetzt werden; die Erprobung extrazellulärer Vesikel als zellfreie Therapieoption; und umfassende präklinische Sicherheitsstudien, die Dosis‑/Wirkungs‑Beziehungen, Biodistribution und Immunantworten beleuchten. Wenn die molekularen Mediatoren identifiziert werden können, erscheinen zielgerichtete Arzneimittel oder Biologika denkbar, die das verjüngende Signal ohne Zelltansplantation nachahmen.
Obwohl die Forschung noch weit von einer klinischen Lösung für Alzheimer entfernt ist, stellt sie einen strategischen Paradigmenwechsel dar: Anstatt ausschließlich zu versuchen, jede Amyloidplaque zu entfernen, könnte die Stärkung des immunologischen Umfelds des Gehirns und die Unterstützung neuronaler Hilfszellen (wie Mikroglia und Mossy‑Zellen) die Funktion erhalten und einen langsamen kognitiven Abbau verzögern. Solch ein multifaktorieller Ansatz könnte in Kombination mit klassischen anti‑amyloiden oder anti‑tauartigen Therapien am effektivsten sein.
Insgesamt liefert die Studie wichtige Hinweise darauf, wie zellbasierte Therapien, iPSC‑Technologie, Neuroimmunologie und die Analyse extrazellulärer Vesikel zusammenspielen können, um innovative Behandlungsstrategien gegen altersbedingte kognitive Störungen und neurodegenerative Erkrankungen zu entwickeln. Die Translation in die klinische Praxis wird weiterhin intensive Forschung, Transparenz bei der Datenerhebung und internationale Kooperationen erfordern, um sichere, skalierbare und wirksame Therapien zu etablieren.
Quelle: sciencealert


Kommentar hinterlassen