8 Minuten
Forscher am MIT und an der Stanford University haben eine neue Immuntherapie entwickelt, die eine zuckerbasierte molekulare "Bremse" auf Krebszellen außer Kraft setzt. Dadurch kann das Immunsystem Tumoren erkennen und zerstören, die zuvor der Immunüberwachung entgangen waren. Die Strategie nutzt gentechnisch hergestellte Hybridproteine namens AbLecs — lectin-verknüpfte Antikörper — um glykanvermittelte Signale zu blockieren, die die Immunantwort unterdrücken.
Warum Glykane wichtig sind: die verborgenen Zuckersignale auf Krebszellen
Glykane sind komplexe Zuckerstrukturen, die nahezu jede Zelle des Körpers umgeben. Krebs verändert diese zuckerhaltige Hülle: Tumorzellen zeigen häufig veränderte Glykane, die reich an Sialinsäure sind. Diese sialinsäurehaltigen Glykane binden an Lektinrezeptoren von Immunzellen, die als Siglecs bezeichnet werden, und aktivieren einen immunsuppressiven Signalweg, der wie eine Bremse auf antitumorale Reaktionen wirkt. Die Glykanstruktur, ihre Dichte und die spezifischen Bindungsstellen beeinflussen dabei, wie stark die Signalübertragung ist.
Konventionelle Checkpoint-Inhibitoren — also Wirkstoffe, die PD-1 oder PD-L1 blockieren — lösen eine Klasse von Bremsen und haben bei manchen Patientinnen und Patienten dramatische, langanhaltende Remissionen erzielt. Dennoch sprechen viele Tumoren nicht auf diese Therapien an. Die Siglec–Sialinsäure-Achse stellt einen alternativen Checkpoint dar: Wenn Siglecs an Sialinsäuren auf Krebszellen binden, sind Makrophagen, natürliche Killerzellen (NK-Zellen) und andere Effektorzellen des Immunsystems weniger geneigt, anzugreifen. Dieses Signal trägt damit entscheidend zur Immunevasion von Tumoren bei und erklärt teilweise die Limitierungen bestehender Immuntherapien.
Wie AbLecs wirken: Lektine mit Antikörpern kapern
Die zentrale Innovation der Teams von MIT und Stanford ist ein modulares Protein, das sie AbLec nennen. Jedes AbLec fusioniert eine lectinähnliche Domäne, die an sialinsäurehaltige Glykane bindet, mit einem Antikörperarm, der ein tumorspezifisches Antigen erkennt. Der Antikörper transportiert und konzentriert die Lektindomäne an der Tumorzelloberfläche, wo sie mit den Siglecs der Immunzellen um die Bindung an Sialinsäuren konkurriert. Dadurch entsteht ein lokaler Glykanblocker, der als Decoy fungiert und die immunsuppressiven Siglec-Interaktionen verhindert.
Vom schwachen Binder zum effektiven Blocker
Lektindomänen alleine binden oft nur schwach an Zielglykane und reichern sich deshalb nicht effektiv in Tumoren an. Antikörper hingegen weisen in der Regel eine hohe Affinität zu Tumorantigenen auf und können sich in großer Zahl an Tumorzellen lokal ansammeln. Die Verknüpfung einer Lektindomäne mit einem Antikörper kombiniert die Vorteile beider Komponenten: gezielten Transport plus lokale Glykansperre. Das Ergebnis ist ein lokal konzentrierter Köder, der die immunsuppressive Siglec-Aktivierung verhindert und Immunzellen wieder zur Angriffshandlung befähigt. Zusätzlich kann die Antikörperkomponente Fc-vermittelte Effektormechanismen wie Antikörper-abhängige zellvermittelte Zytotoxizität (ADCC) oder Phagozytose begünstigen, was die antitumorale Wirkung weiter verstärken kann.
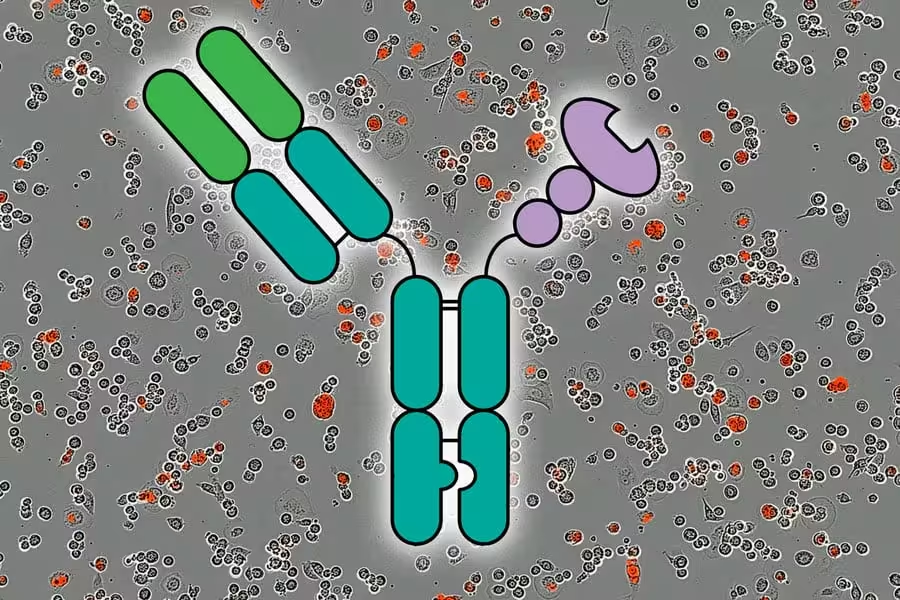
Die Forschenden zeigten, dass sie eine starke antitumorale Immunantwort auslösen können, indem sie Moleküle namens AbLecs einsetzen, die hier in der Mitte dargestellt sind und einen Immuncheckpoint blockieren. Der Hintergrund zeigt rote Fluoreszenz, die über einen Zeitraum von fünf Stunden getötete Krebszellen signalisiert. Quelle: Courtesy of the researchers; MIT News
Präklinische Evidenz: von Zellen bis zu humanisierten Mäusen
Um den proof of concept zu demonstrieren, konstruierten die Forscher ein AbLec, das Trastuzumab (den Anti-HER2-Antikörper) mit einer Lektindomäne aus Siglec-7 oder Siglec-9 verband. In zellbasierten Assays wurden durch diese AbLecs Immunzellen so umprogrammiert, dass sie HER2-positive Tumorzellen attackierten. In einem Mausmodell, das gentechnisch so verändert wurde, dass es humane Siglecs und menschliche Antikörperrezeptoren exprimiert, reduzierte die Behandlung mit dem AbLec Lungenmetastasen im Vergleich zu Trastuzumab allein.
Diese Ergebnisse sind bedeutsam, weil sie zeigen, dass sowohl angeborene Immunzellen (wie Makrophagen und NK-Zellen) als auch adaptive Immunantworten durch die Blockade glykanbasierter Checkpoints befreit werden können. In Modellsystemen, in denen Standard-Antikörpertherapien nur begrenzten Effekt hatten, verringerte die AbLec-Behandlung die Tumorlast deutlich. Die präklinischen Daten umfassen quantitative Messungen der Tumorgröße, Immunzellinfiltration und Zytokinprofile sowie zeitliche Verläufe, die eine robuste Aktivierung antitumoraler Mechanismen nahelegen.
Modulares Design: eine Plug-and-Play-Plattform
Einer der vielversprechendsten Aspekte von AbLecs ist ihre Modularität. Der Antikörperarm lässt sich austauschen, um unterschiedliche Tumorantigene zu adressieren — zum Beispiel Rituximab (CD20) für B-Zell-Neoplasien oder Cetuximab (EGFR) für andere solide Tumoren. Ebenso kann die Lektindomäne gewechselt werden, um verschiedene Glykanmotive oder Mitglieder der Lektinrezeptorfamilie zu targetieren. Dieses Plug-and-Play-Design eröffnet Möglichkeiten für tumorartspezifische Anpassungen und kombinatorische Therapiestrategien.
Da viele Tumorarten auf glykanbasierte Immunsuppression angewiesen sind, könnten AbLecs bestehende Checkpoint-Inhibitoren sinnvoll ergänzen oder Patienten helfen, die nicht auf PD-1/PD-L1-Blockaden ansprechen. Technisch lassen sich mehrere Lektindomänen oder unterschiedliche Antikörper in einer Kombination oder als Bispezifika einsetzen, um mehrere immunsuppressive Glykanmotive gleichzeitig zu neutralisieren. Diese Flexibilität ist besonders wichtig, weil Tumoren heterogen sind und Glykanprofile zwischen Patienten, Tumortypen und sogar innerhalb eines einzelnen Tumors variieren können.
Herausforderungen und nächste Schritte
Vor dem klinischen Einsatz von AbLecs bleiben mehrere wichtige Hürden zu überwinden. Tumorassoziierte Glykane werden mitunter, wenn auch in geringerem Maße, auf gesunden Geweben exprimiert — dies wirft Fragen zu Off-Target-Effekten und Sicherheit auf. Mögliche Nebenwirkungen könnten Gewebeschädigungen, Autoimmunreaktionen oder entzündliche Prozesse umfassen, wenn gesunde Zellen fälschlicherweise als Ziel angesehen werden. Daher sind detaillierte Toxizitätsstudien an mehreren Tierarten und in humanisierten Modellen nötig.
Ein weiteres Problem ist die Immunogenität neuer Proteinfusionen: Das Immunsystem kann auf fremde oder neuartige Proteinstrukturen mit Antikörperbildung reagieren, was Wirksamkeit und Verträglichkeit beeinträchtigen könnte. Strategien zur Humanisierung, zur Minimierung immunogener Sequenzen und zur Optimierung von Dosisregimen werden entscheidend sein. Außerdem ist die großskalige Herstellung komplexer Hybridproteine technisch anspruchsvoll — Qualitätskontrolle, Stabilität, Glykoform-Analysen und Produktionskosten sind reale Herausforderungen für die klinische Translation.
Wesentlich für den Übergang in die Klinik sind gut konzipierte Phase‑I-Studien, die Wirksamkeit, Verträglichkeit und optimale Dosisbereiche evaluieren. Zusätzlich müssen Biomarker für die Patientenselektion entwickelt werden, um zu identifizieren, welche Tumoren primär durch Siglec–Sialinsäure-Interaktionen immunsuppressiv gesteuert werden. Nur durch sorgfältig aufgebaute klinische Studien und begleitende translationale Forschung lässt sich bestimmen, ob AbLecs tatsächlich die Zahl der Patienten erweitern, die von Immuntherapie profitieren.
Expertinnen- und Experteneinschätzung
"Das Targeting der Glykansignatur ist ein eleganter Ansatz, um die Immuntherapie zu verbreitern," sagt Dr. Elena Morales, Immunonkologin, die nicht an der Studie beteiligt war. "AbLecs lösen geschickt ein Lieferproblem — sie machen aus schwachen Glykangebinden potente, tumorlokalisierte Blocker. Sollten Sicherheit und Spezifität in klinischen Studien bestätigt werden, könnten AbLecs eine wichtige Ergänzung zu PD-1/PD-L1-Inhibitoren werden."
Weitere Fachkommentare heben hervor, dass die Kombination von AbLecs mit bestehenden Therapien — wie Checkpoint-Inhibitoren, zielgerichteten Therapien oder adoptiven Zelltherapien — synergetische Effekte erzeugen könnte. Ebenso wird die Notwendigkeit betont, molekulare Tests zur Charakterisierung der Glykanlandschaft in Tumoren zu etablieren, damit Behandlungen präzise auf die Biologie des jeweiligen Patienten zugeschnitten werden können.
Auswirkungen für Patientinnen, Patienten und Therapien
Für Patientinnen und Patienten eröffnet die AbLec-Technologie zwei wesentliche potenzielle Vorteile: erstens die Möglichkeit, eine bisher unadressierte Immunevasionsstrategie zu überwinden; zweitens die Flexibilität, auf verschiedene Tumorantigene und Glykanziele zugeschnitten zu werden. Das bedeutet grundsätzlich, dass ein größerer Anteil von Krebserkrankungen für eine Immuntherapie empfänglich gemacht werden könnte.
In der Praxis müssen Klinikerinnen und Forscher Biomarker definieren, die vorhersagen, welche Tumoren maßgeblich durch Sialinsäure–Siglec-Interaktionen getrieben sind. Patientenselektion, Kombinationstherapien und Sicherheitsmonitoring werden bestimmen, wie AbLecs zusammen mit bestehenden Behandlungsoptionen eingesetzt werden. Ebenso wichtig sind ökonomische Aspekte: Entwicklungs- und Herstellungskosten sowie Erstattungsfragen werden den Zugang zu solchen individualisierten Therapien beeinflussen.
Blick nach vorn
Die AbLec-Strategie veranschaulicht einen breiteren Trend in der Tumorimmunologie: das gezielte Angehen biochemischer Signale der Tumormikroumgebung, nicht nur der klassischen Immun-Checkpoint-Moleküle. Indem molekulare Köder in gezielte Therapeutika umgewandelt werden, versuchen Wissenschaftler, Tumoren vor dem Immunsystem zu enttarnen. Die nächsten Kapitel dieser Forschungsrichtung werden in frühen klinischen Studien geschrieben, in denen Wirksamkeit, Sicherheit und der reale Nutzen für Patientinnen und Patienten geprüft werden.
Langfristig könnten AbLecs Teil einer personalisierten Immuntherapie-Architektur werden, die genomische, proteomische und glykomische Informationen kombiniert, um optimale Behandlungsentscheidungen zu treffen. Die Integration von Glykanprofilen in Diagnostik und Therapieplanung könnte neue Biomarker schaffen und damit die Präzision onkologischer Behandlungen weiter erhöhen. Insgesamt bieten AbLecs ein vielversprechendes Konzept, das die Grenzen aktueller Immuntherapien verschieben könnte, sofern die Validierung durch klinische Studien gelingt.
Quelle: scitechdaily


Kommentar hinterlassen