8 Minuten
Angst wird möglicherweise nicht allein von Neuronen gesteuert. Neue Forschungsergebnisse an Mäusen deuten darauf hin, dass ein Tauziehen zwischen zwei unterschiedlichen Gruppen von Immunzellen im Gehirn — den Mikroglia — Angstverhalten an- oder ausschalten kann. Diese Entdeckung rückt die biologischen Wurzeln von Angst in ein neues Licht und eröffnet Perspektiven für immunzentrierte Behandlungsstrategien in der Zukunft.
Forscher identifizierten zwei konkurrierende Gruppen von Gehirn-Immunzellen, die zusammen das Angstniveau beeinflussen. Das Gleichgewicht zwischen diesen Mikroglia-Subtypen könnte erklären, warum Angst bei manchen Individuen außer Kontrolle gerät und in chronische Angstzustände oder Angststörungen übergeht.
Immune cells, not just neurons: a surprising place to look
Jahrzehntelang konzentrierte sich die Angstforschung vor allem auf neuronale Netzwerke, Neurotransmitter und synaptische Plastizität. Das Gehirn enthält jedoch auch eigene angestammte Immunzellen, die Mikroglia, die kontinuierlich das neuronale Gewebe überwachen und erhalten. Mikroglia tragen zur Eliminierung überzähliger Synapsen bei, reagieren auf Verletzungen und modulieren entzündliche Signale. Sie sind sehr dynamisch: je nach Entwicklungsstadium und Umwelteinflüssen ändern sie Morphologie und Genexpressionsprofile. Das Team der University of Utah fand heraus, dass zwei Mikroglia-Subpopulationen wie antagonistische Bedienungen funktionieren: Eine agiert als "Gaspedal" und fördert ängstliches Verhalten, die andere wirkt als "Bremse" und unterdrückt dieses Verhalten.
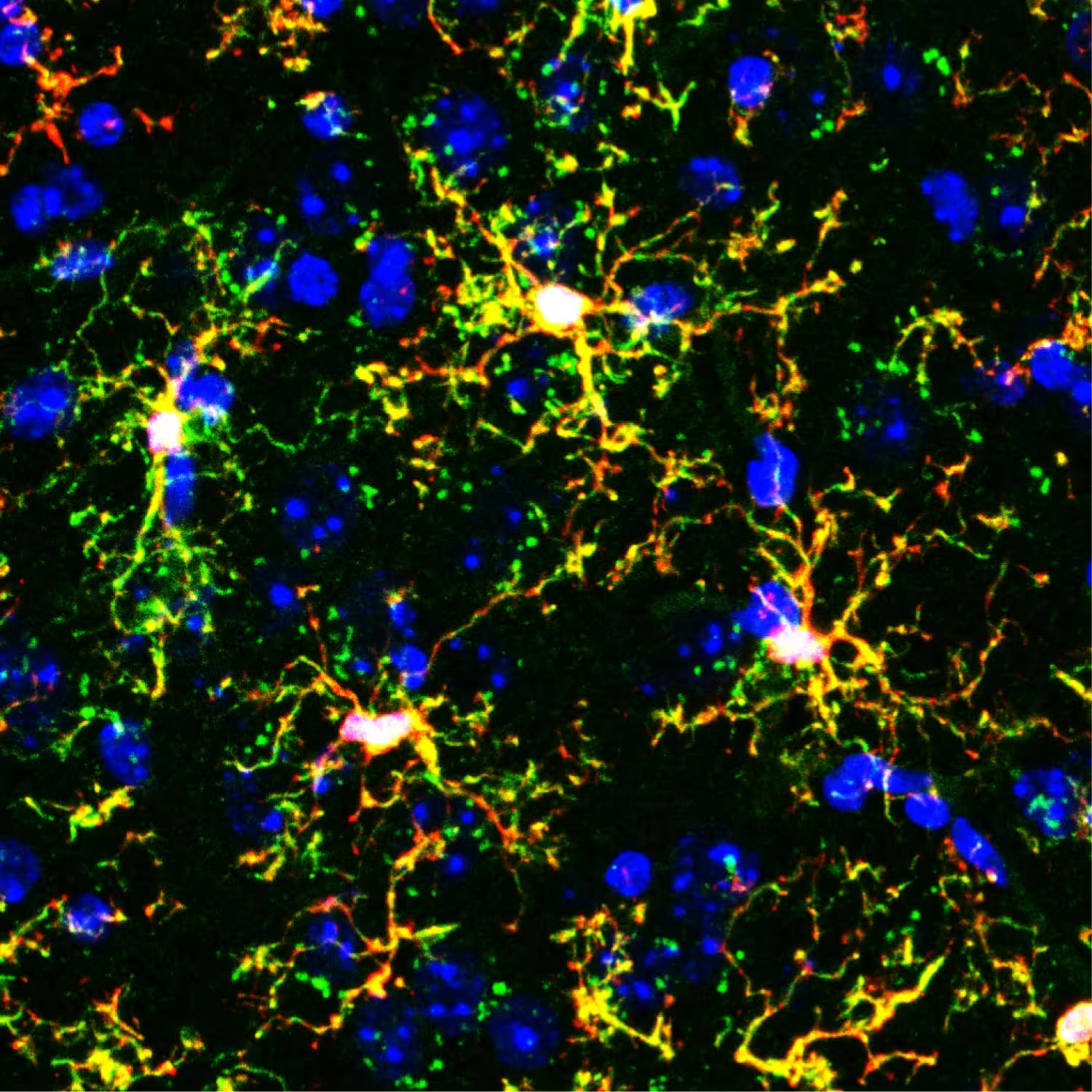
Fluoreszenzmikroskopisches Bild transplantierter Mikroglia (verzweigende gelbe Formen) im Mausgehirn. Rot markiert genetisch veränderte transplantierte Mikroglia, Grün markiert Immunzellen wie Makrophagen, und Blau markiert Zellkerne.
How the researchers untangled the microglial tug-of-war
Die im Fachjournal Molecular Psychiatry veröffentlichte Studie begann mit einer zunächst widersprüchlichen Beobachtung. Als die Forschenden selektiv eine Untergruppe von Mikroglia, die sogenannten Hoxb8-Mikroglia, störten, entwickelten Mäuse ängstliches Verhalten: gesteigertes Putzen (overgrooming) und das Meiden offener Flächen. Überraschenderweise zeigten die Tiere jedoch normales Verhalten, wenn alle Mikroglia gleichzeitig unterdrückt wurden — inklusive sowohl Hoxb8- als auch nicht-Hoxb8-Zellen.
Dieser Befund deutete darauf hin, dass die beiden Populationen entgegengesetzte Rollen haben könnten. Um diese Hypothese zu prüfen, wendeten die Autoren eine konsequente experimentelle Strategie an: Sie erzeugten Mäuse ohne Mikroglia und transplantierten anschließend gezielt einzelne Mikroglia-Populationen zurück, um zu beobachten, wie jede Subgruppe das Verhalten beeinflusst. Solche rekonstruktiven Experimente erlauben es, kausale Zusammenhänge zwischen Zelltypen und Verhalten herzustellen und die Wirkungen spezifischer Zellpopulationen isoliert zu betrachten.
Accelerators and brakes, isolated
Wenn Mäuse ausschließlich nicht-Hoxb8-Mikroglia erhielten, zeigten sie eindeutige Anzeichen erhöhter Angst — vergleichbar mit dem Durchdrücken des Gaspedals. Das übermäßige Putzen, erhöhte Vermeidungsverhalten in Offenfeld-Tests und reduzierte Exploration in angstassoziierten Tests wurden deutlich ausgeprägt. Demgegenüber blieben Mäuse, die nur Hoxb8-Mikroglia erhielten, vergleichsweise ruhig und zeigten geringere Anzeichen von Angst, was auf einen dominanten hemmenden Einfluss hinweist. Entscheidend war, dass Mäuse, denen beide Populationen transplantiert wurden, ein ausgeglichenes Verhalten zeigten: Die Bremse kompensierte das Gaspedal und verhinderte so anhaltende Angstreaktionen.
Diese Ergebnisse führten den leitenden Autor Mario Capecchi, PhD, zu der Schlussfolgerung, dass die beiden Mikroglia-Populationen zusammen das passende Angstniveau einstellen, abhängig von Umweltreizen und inneren Zuständen. "Zusammen bestimmen sie genau die richtigen Angstlevel als Antwort auf das, was in der Umgebung der Maus geschieht", sagte Capecchi. Methodisch nutzten die Autoren neben Verhaltensanalysen auch histologische Kartierungen, Genexpressionsanalysen und einzelne Zellsequenzierungen (single-cell RNA-seq), um die Subtypen zu charakterisieren und ihre räumliche Verteilung im Gehirn zu bestimmen.

Donn Van Deren, PhD, Erstautor der Studie
Why this changes how we think about anxiety biology
Die meisten psychiatrischen Medikamente zielen derzeit auf neuronale Signalwege — etwa Monoamintransporter, GABAerge oder glutamaterge Systeme. Die neuen Ergebnisse legen nahe, dass Immunzellen im Gehirn keine passiven Beobachter sind, sondern aktive Regulatoren des Verhaltens. Wenn vergleichbare Mikroglia-Subtypen und neuronale Mikroglia-Schaltkreise auch beim Menschen existieren — und es gibt Hinweise aus single-cell-Studien, dass die menschliche Mikroglia-Diversität ähnlich komplex ist — könnten einige Formen von Angststörungen weniger aus klassischen Neurotransmitter-Defekten resultieren, sondern eher aus einem Ungleichgewicht dieser Immunzellpopulationen.
Das bedeutet nicht, dass Mikroglia die Neuronen als zentrale Akteure in der Stimmungsregulation ersetzen; vielmehr fügt es eine zusätzliche Ebene hinzu: ein fein abgestimmtes Zusammenspiel von Immunzellen und neuronalen Netzwerken, das Verhalten moduliert. Diese Sichtweise erklärt plausibel, warum Angst in manchen Fällen plötzlich eskalieren kann — etwa durch Verlust der bremsenden Mikroglia oder eine Überaktivität der beschleunigenden Population, wodurch das System in einen persistierenden Zustand von Hypervigilanz und Vermeidungsverhalten kippen könnte.
Potential paths for therapies and diagnostics
Die Übertragung dieser Erkenntnisse auf humane Therapien wird Zeit benötigen, doch die konzeptionellen Implikationen sind weitreichend. Therapieansätze könnten darauf abzielen, die bremsenden Mikroglia zu stärken, überaktive beschleunigende Mikroglia zu dämpfen oder die Signalübertragung zwischen diesen Subtypen umzulenken. Mögliche Strategien reichen von kleinen Molekülen, die spezifische Mikroglia-Funktionen verändern, über zielgerichtete Immuntherapien bis hin zu in weiter Ferne liegenden zellbasierten Ansätzen.
Technisch denkbar sind zum Beispiel Modulatoren des CSF1R-Signalwegs zur selektiven Beeinflussung von Mikroglia-Populationen, Antikörper gegen Oberflächenmarker, die für einen Subtyp charakteristisch sind, oder kleine Moleküle, die intrazelluläre Signalwege regulieren (z. B. TREM2-, NF-κB- oder MAPK-assoziierte Pfade). Diagnostisch könnten PET-Tracer für Mikroglia-Aktivität (z. B. TSPO-Liganden, wenn auch mit bekannten Einschränkungen) oder neue Liganden für Subtyp-spezifische Marker helfen, Ungleichgewichte im Gehirn sichtbar zu machen. Ergänzend dazu könnten Blut-basierte Biomarker oder Liquor-Analysen Hinweise auf entzündliche Signaturen liefern, die mit veränderten Mikroglia-Populationen korrelieren.
"Wir sind noch weit von der klinischen Anwendung entfernt", sagte Donn Van Deren. "Aber künftig könnte man sehr spezifische Immunzellpopulationen im Gehirn ansprechen und pharmakologisch oder immuntherapeutisch korrigieren. Das wäre ein radikaler Wandel in der Behandlung neuropsychiatrischer Erkrankungen." Wichtige Herausforderungen bleiben: Selektivität gegenüber Zielsubtypen, Überwindung der Blut-Hirn-Schranke, unerwünschte Nebenwirkungen auf andere Gliazellen und die langfristige Stabilität der Interventionen.
Scientific context and open questions
- Die Mechanismen, durch die Hoxb8- und nicht-Hoxb8-Mikroglia gegensätzliche Effekte vermitteln, sind noch unklar: Sekretieren sie unterschiedliche Signalmoleküle (Zytokine, Chemokine), entfernen sie verschiedene Synapsen mittels Komplementsystem-Usergesteuerter Phagozytose, oder beeinflussen sie unterschiedliche neuronale Schaltkreise?
- Wie beeinflussen Umweltstressoren, perinatale Ereignisse oder Entwicklungsfaktoren das Gleichgewicht zwischen diesen Mikroglia-Populationen? Frühkindliche Entzündungen oder Stress während kritischer Reifungsphasen könnten dauerhafte Verschiebungen erzeugen.
- Können periphere Immunereignisse wie Infektionen oder systemische Entzündungen das Mikroglia-Gaspedal-Bremse-Gleichgewicht umschichten und dadurch Angst auslösen oder verschlechtern? Welche Rolle spielen dabei mikrobiomabhängige Signalwege und die Interaktion von Peripherie und Zentralnervensystem?
Die Beantwortung dieser Fragen erfordert eine Kombination aus molekularem Profiling (single-cell und spatial transcriptomics), präziser Schaltkreiskartierung (z. B. mittels optogenetischer oder chemogenetischer Werkzeuge), humanen Gewebestudien und translativen Biomarker-Ansätzen. Nur so lassen sich Parallelen zwischen Mausmodellen und menschlicher Neuroimmunologie verifizieren und therapeutisch nutzbar machen.
Expert Insight
"Diese Studie betrachtet Angst als ein emergentes Phänomen von neuronaler und immunologischer Interaktion, nicht ausschließlich als neuronales Versagen", sagt Dr. Laura Mendes, eine fiktive Neuroimmunologin und Wissenschaftskommunikatorin. "Wenn wir kartieren können, welche Synapsen jeder Mikroglia-Subtyp gezielt angreift und wie sie Neurotransmittersysteme modulieren, könnten wir äußerst spezifische Interventionen entwickeln, die das Gleichgewicht mit weniger Nebenwirkungen wiederherstellen als breit wirkende Psychopharmaka." Solche Einsichten fördern die Entwicklung zielgerichteter Therapien und erhöhen die Chance, Nebenwirkungen durch systemische Immunsuppression zu vermeiden.
Mario Capecchi, PhD, Seniorautor der Studie, erläutert Diagramme zu Mikroglia auf einem Whiteboard.
What this means for patients and researchers
Für Menschen mit Angststörungen sind diese Befunde ein früher, aber hoffnungsvoller Schritt. Sie deuten auf neue Biomarker und Behandlungspunkte außerhalb des klassischen Neurotransmitterrahmens hin. Insbesondere könnten Patienten profitieren, deren Symptome nur unzureichend auf bestehende pharmakologische Therapien ansprechen, wenn sich immungesteuerte Mechanismen als zugrundeliegende Ursache erweisen.
Für Forscher öffnet die Studie ein vielversprechendes Forschungsfeld an der Schnittstelle von Immunologie, Genetik und Verhaltensneuroscience. Kombinationen aus genetischen Werkzeugen (z. B. bedingte Knockouts, CRISPR-Editing), Einzelzell-Analysen, räumlicher Transkriptomik und auf Verhalten kalibrierter Assays werden entscheidend sein, um die Mechanismen detailliert zu entschlüsseln und translationale Ansätze zu entwickeln.
Während die Feldarbeit voranschreitet, bleibt die zentrale Botschaft bestehen: Das Immunsystem des Gehirns spielt eine dynamische und mitunter entscheidende Rolle dabei, wie wir fühlen und auf die Welt reagieren. Die Integration von Immun- und Neurowissenschaft könnte künftig präzisere Diagnostik und effektivere, individualisierte Behandlungen für Angststörungen ermöglichen.
Quelle: scitechdaily

Kommentar hinterlassen