8 Minuten
Neue Forschungsarbeiten deuten darauf hin, dass eine Untergruppe von Immunzellen im Gehirn in einen schützenden Zustand umschalten kann, der die kennzeichnenden Pathologien der Alzheimer-Krankheit bei Mäusen verlangsamt. Das Verständnis dieses Umschaltmechanismus könnte auf immunotherapeutische Ansätze hinweisen, die die körpereigenen Verteidiger des Gehirns dazu anregen, die Krankheit abzuwehren. Solche Erkenntnisse sind relevant für Felder wie Neuroimmunologie, Alzheimer-Forschung und die Entwicklung neuartiger Immuntherapien gegen neurodegenerative Erkrankungen.
Wenn Verteidiger zu Beschützern werden: die überraschende Rolle der Mikroglia
Mikroglia sind die residenten Immunzellen des Gehirns: Sie beseitigen Zelltrümmer, trimmen synaptische Verbindungen und reagieren auf Verletzungen oder pathologische Veränderungen. In der Alzheimer-Krankheit erscheint ihr Verhalten ambivalent – in manchen Situationen räumen sie toxische Proteine ab, in anderen Fällen scheinen sie schädliche Entzündungsprozesse zu verstärken. Diese doppelte Rolle hat in der Forschung lange für Verwirrung gesorgt, weil Mikroglia sowohl Schutzfunktionen als auch beitragende Faktoren zur Neurodegeneration sein können.
Ein multinationales Forscherteam unter der Leitung der Neurowissenschaftlerin Pinar Ayata vom Icahn School of Medicine hat nun untersucht, wie Mikroglia in Mausmodellen der Alzheimer-Krankheit zwischen diesen gegensätzlichen Zuständen wechseln. Mithilfe hochauflösender molekularer Profilierungsverfahren, Einzelzellsequenzierung und fortschrittlicher Bildgebung konnten die Wissenschaftler nachvollziehen, welche Transkriptionsprogramme und Signalwege aktiv werden, wenn Mikroglia unterschiedlich auf amyloide Ablagerungen und tau-Pathologie reagieren. Solche Methoden schließen unter anderem Einzelzell-RNA-Analysen (single-cell RNA-seq), räumliche Transkriptomik (spatial transcriptomics) und in-vivo- oder Ex-vivo-Bildgebung ein, um Zellschicksale, Lokalisation und Zustand im krankheitsrelevanten Kontext zu verknüpfen.
Die Forschenden fanden heraus, dass Mikroglia, die zu Amyloid‑Beta-Proteinaggregate wandern – ein charakteristisches Merkmal der Alzheimer‑Pathologie – in einen klar unterscheidbaren neuroprotektiven Zustand übergehen können. In diesem Zustand scheinen die Zellen nicht nur die Ansammlung von Amyloid zu verlangsamen, sondern auch die Aggregation von Tau-Protein zu begrenzen, die beide als die zentralen toxischen Prozesse gelten, die mit dem kognitiven Abbau verbunden sind. Funktionell kann dies bedeuten, dass diese Mikroglia verstärkte Phagozytose, veränderte Zytokinprofile, eine modifizierte Interaktion mit Astrozyten und Neuronen sowie die Aktivierung bestimmter Proteasen oder Abbauwege aufweisen, die die Proteinhomöostase im Gewebe unterstützen.
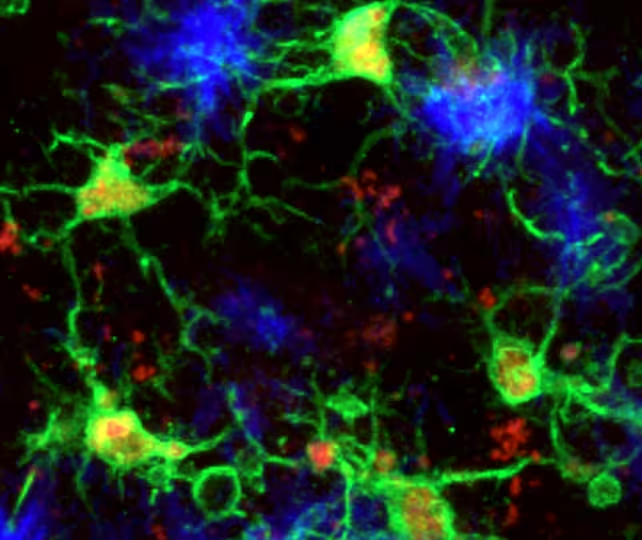
Mikroglia (grün), die auf Amyloid‑Beta‑Plaques (blau) im Mausgehirn reagieren.
PU.1 und CD28: eine molekulare Signatur des Schutzes
Die schützenden Mikroglia teilen zwei zentrale molekulare Merkmale: niedrigere Spiegel des Transkriptionsfaktors PU.1 (auch bekannt als SPI1) und eine höhere Expression des Rezeptors CD28, der normalerweise mit peripheren T‑Zellen des Immunsystems assoziiert wird. PU.1 ist ein wichtiger Regulator der Differenzierung und Funktion myeloider Zellen; Veränderungen in seiner Aktivität beeinflussen weitreichend die Genprogramme von Immunzellen. CD28 wiederum ist klassisch als kostimulatorischer Rezeptor auf T‑Zellen bekannt, seine Beobachtung auf Mikroglia ist überraschend und weist auf bislang wenig erforschte Signalwege und mögliche Quervernetzungen zwischen zentralem und peripherem Immunsystem hin.
Wenn Mikroglia diese Kombination aus reduziertem PU.1‑Niveau und erhöhtem CD28‑Ausdruck zeigen, scheinen sie besser dazu geeignet, das Wachstum von Amyloid‑Beta‑Plaques zu begrenzen und die Tau‑Aggregation zu unterdrücken – zumindest in den untersuchten Mausexperimenten. Mechanistisch könnte CD28‑Signalgebung in Mikroglia antiinflammatorische und protektive Programme aktivieren, während ein moderat reduziertes PU.1 die Balance von Aktivierungs‑ und Differenzierungspfaden so verschiebt, dass eine weniger destruktive, dafür schützende Immunidentität gefördert wird.
Um Kausalität zu prüfen, blockierte das Team genetisch die CD28‑Produktion in Mäusen. Die Folge war ein Rückfall zu einer stärker entzündungsanfälligen Mikroglia‑Population, mehr Amyloid‑Plaques und ein klarer Verlust des schützenden Phänotyps. Solche manipulativen Experimente – etwa durch bedingte Knockouts, CRISPR‑basierte Modulation oder virale Vektoren zur gezielten Genregulation – stärken die Interpretation, dass CD28‑ und PU.1‑Spiegel mitbestimmen, ob Mikroglia als Bewahrer oder als Verstärker schädlicher Prozesse wirken. Wichtig ist dabei die Nuancierung: Es geht nicht um eine einfache on/off‑Schaltung, sondern um graduelle Verschiebungen in Transkriptionsprogrammen und Signalnetzwerken, die das Zellverhalten global verändern.
Auch genetische Daten aus menschlichen Studien stützen diese Biologie: Personen mit natürlichen Varianten, die die PU.1‑Expression in bestimmten Gehirnzelltypen reduzieren, neigen dazu, später als der Durchschnitt Alzheimer zu entwickeln. Diese Korrelation bietet einen plausiblen mechanistischen Zusammenhang zwischen genetischer Prädisposition und dem Zeitpunkt des Krankheitsbeginns. Solche Assoziationen werden üblicherweise durch Populationsstudien und genomweite Assoziationsstudien (GWAS) aufgedeckt und anschließend mit funktionalen Analysen verknüpft, um die zellulären Konsequenzen der Varianten zu verstehen.
Was das für Therapien und zukünftige Forschung bedeutet
Mikroglia in langlebige Schutzakteure zu verwandeln, ist eine verlockende Idee für neue Alzheimer‑Therapien, bringt aber zahlreiche Vorbehalte mit sich. Alzheimer ist eine multifaktorielle Erkrankung – Genetik, Umweltfaktoren, vaskuläre Gesundheit, metabolische Zustände und das Alter spielen zusammen – daher wird ein erfolgreicher Therapieansatz wahrscheinlich mehrere Zielpunkte gleichzeitig ansprechen müssen. Eine alleinige Modulation von Mikroglia könnte in bestimmten Stadien oder Patientengruppen nützlich sein, doch ist die Einbettung in ein umfassenderes Behandlungsregime denkbar und wahrscheinlich erforderlich.
- Immunmodulation: Die Entwicklung von Wirkstoffen oder Biologika, die die CD28‑Signalgebung in Mikroglia erhöhen oder PU.1 modulieren, könnte die Zellen in den schützenden Zustand lenken. Solche Strategien reichen von kleinen Molekülen, die Signalwege modulieren, über Antikörper oder Fusionsproteine bis hin zu gentechnischen Ansätzen, beispielsweise RNA‑Interferenz oder gezielte Geneditierung, um das Transkriptionsnetzwerk zu verschieben.
- Sicherheit und Spezifität: Therapien müssen vermeiden, das Immunsystem allgemein zu aktivieren, denn eine breite Immunstimulation kann neuroinflammatorische Prozesse verschlimmern und Schaden verursachen. Ziel ist eine zelltypspezifische, regionale und zeitlich kontrollierte Modulation, die etwa über ligandengesteuerte Systeme, lokale Applikation oder durch Vektoren mit spezifischer Tropismussteuerung erreichbar sein könnte.
- Translation: Mikroglia von Mäusen und Menschen sind zwar ähnlich in Grundzügen, aber nicht identisch in Genexpression, Lebensdauer und Reaktionsmustern. Die Bestätigung, dass identische Schutzprogramme auch beim Menschen existieren und auslösbar sind, ist ein kritischer nächster Schritt. Dazu gehören Studien an postmortalen Geweben, humanen iPSC‑abgeleiteten Mikroglia‑Modellen, Organotypen, sowie die Analyse klinischer Biomarker in Patientenstudien.
Forschende und klinische Expertinnen und Experten in der Studie betonen sowohl das Potenzial als auch die Vorsicht. Anne Schaefer vom Icahn School of Medicine weist darauf hin, dass Mikroglia „nicht einfach destruktive Akteure in der Alzheimer‑Krankheit sind – sie können zu Beschützern des Gehirns werden“, während die Genetikerin Alison Goate anführt, dass die Arbeit dabei hilft zu erklären, warum niedrigere PU.1‑Spiegel mit einem reduzierten Alzheimer‑Risiko in Verbindung stehen. Der Epigenetiker Alexander Tarakhovsky von der Rockefeller University verknüpft den Befund mit einer breiteren Regulierung des Immunsystems und schlägt vor, dass die schützenden Mikroglia regulatorischen T‑Zellen ähneln könnten, die anderswo im Körper immunmodulatorische Funktionen übernehmen. Solche Vergleiche sollten jedoch mit Vorsicht interpretiert werden, weil die Signalumgebung und die zellulären Interaktionen im zentralen Nervensystem einzigartig sind.
Expert Insight
„Diese Studie fügt dem Alzheimer‑Puzzle ein wichtiges Stück hinzu, indem sie zeigt, dass immunologische Identität im Gehirn vorteilhaft und nicht nur schädlich sein kann“, sagt Dr. Maya Elfenbein, Neuroimmunologin und Wissenschaftskommunikatorin. „Die Herausforderung besteht nun in zweierlei Hinsicht: zu beweisen, dass derselbe Mechanismus auch beim Menschen wirkt, und anschließend präzise Methoden zu entwickeln, um Mikroglia in diesen schützenden Zustand zu versetzen, ohne dabei schädliche Entzündungen auszulösen.“
Mit Blick auf die Zukunft eröffnet die Forschung einen Weg zu immuntherapeutischen Strategien, die Alzheimer nicht nur durch das Entfernen toxischer Proteine behandeln, sondern durch die Reprogrammierung der körpereigenen Immunzellen im Gehirn. Diese Richtung könnte bestehende Ansätze ergänzen, etwa Antikörpertherapien gegen Amyloid‑Beta, kleine Moleküle, die Tau‑Aggregation hemmen, sowie präventive Maßnahmen und Lebensstilinterventionen, die das Erkrankungsrisiko verringern. Wichtig ist, dass eine Kombination aus molekularen Therapien, Biomarker‑geleiteter Patientenselektion und begleitenden nicht‑pharmakologischen Maßnahmen die Erfolgsaussichten erhöhen dürfte.
Obwohl diese mikrogliale Abwehr eine vielversprechende natürliche Barriere darstellt, betonen die Autorinnen und Autoren, dass sie alleine die Krankheitsprogression nicht aufhalten kann. Vielmehr stellt die Umprogrammierung von Mikroglia in schützende Zustände – sofern dies beim Menschen machbar ist – ein zusätzliches, kraftvolles Werkzeug im Arsenal der Alzheimer‑Forschung und ‑Therapie dar. Langfristig könnten personalisierte Ansätze, die genetische Risikomarker wie PU.1‑assoziierte Varianten berücksichtigen, zusammen mit gezielten Immunmodulatoren und etablierten Therapieformen, die Grundlage für effektivere Behandlungsstrategien bilden.
Quelle: sciencealert

Kommentar hinterlassen