8 Minuten
Bauchspeicheldrüsenkrebs wartet nicht ab. Er sammelt Verbündete im Gewebe lange bevor ein nachweisbarer Tumor sichtbar wird, und einer seiner frühesten Rekruten ist überraschend: das Nervensystem. Forschende am Cold Spring Harbor Laboratory berichten, dass Nervenfasern und spezialisierte Fibroblasten ein kooperatives Netzwerk bilden, das präkanzeröse Läsionen bei der Entwicklung zu bösartiger Erkrankung unterstützt.
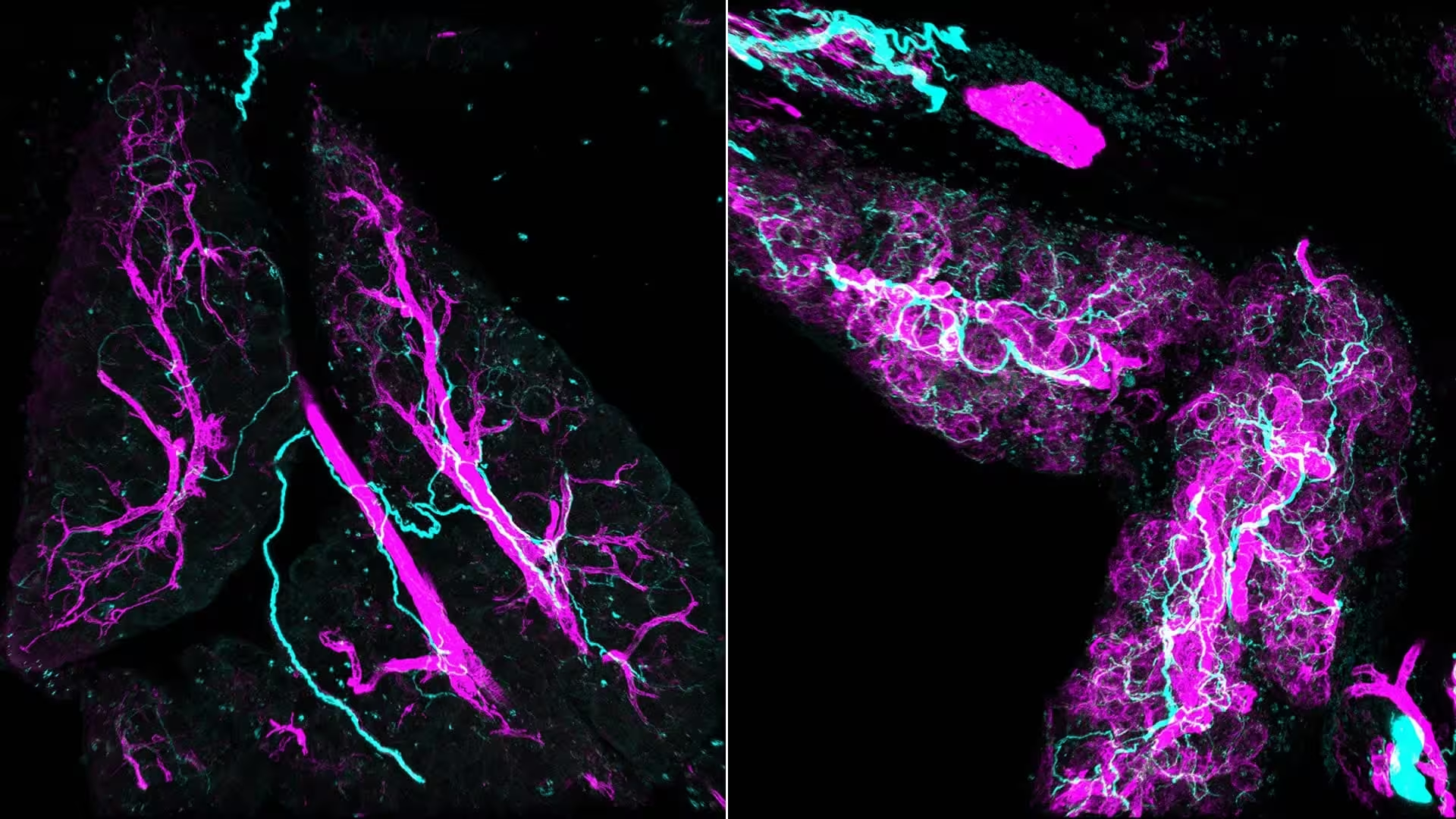
Stresssignale remodeln Gewebe während Entzündung und Krebs. Links: Normale Gewebeerhaltung. Rechts: Stresssignale schalten Fibroblasten "an" und verwandeln sie in myCAFs (lila), die aktiv Nerven (cyan) in die Bauchspeicheldrüse rekrutieren.
Man kann sich die Bauchspeicheldrüse wie eine ruhige Wohngegend vorstellen. Dann ändert sich in ein paar Häusern etwas – Zellen beginnen, sich fehlverhalten. Anstatt einer unmittelbaren Belagerung remodelt sich die Nachbarschaft: Stütz- und Strukturzellen, sogenannte Fibroblasten, wechseln in einen aktivierten Zustand; die Immunzell-Signalgebung verändert sich, und Nervenfasern wachsen in das betroffene Areal hinein. Das Ergebnis ist eine umgestaltete Tumormikroumgebung, die maligne Transformation begünstigt. Es ist also nicht nur ein Überrennen durch Krebszellen; es ist eine verdeckte Kollaboration zwischen mehreren Zelltypen und Systemen.
Das Unsichtbare mit 3D-Bildgebung sichtbar machen
Konventionelle Mikroskopie reduziert komplexe Gewebe auf dünne Schnitte. Dadurch sehen lange Nervenbahnen oft wie verstreute Punkte oder Einzelstrukturen aus. Das Team nutzte Whole-Mount-Immunfluoreszenz und volumetrische 3D-Rekonstruktionen, um Läsionen räumlich vollständig zu kartieren. Die Perspektive war aufschlussreich: dichte, verflochtene Nervenbündel, die durch aktivierte Fibroblasten – myofibroblastische tumorassoziierte Fibroblasten, kurz myCAFs – hindurchziehen und sie umschlingen. Als die Bilder auftraten, wurde den Forschenden bewusst, wie viel von der frühen Mikroumgebung für Standardmethoden bislang unsichtbar geblieben war.
Diese 3D-Rekonstruktionen sind nicht nur eindrücklich anzusehen; sie verändern die Erzählung über frühe Tumorentstehung. Nerven sind keine passiven Kabel, die später vom Tumor ausgenutzt werden. Sie sind frühe Akteure, die von chemischen Signalen der myCAFs angezogen werden und zugleich Signale zurückgeben, die die gleichen Fibroblasten weiter aktivieren. Dieser bidirektionale Dialog etabliert eine sich selbst verstärkende Schleife, die zelluläre Verhaltensweisen fördert, die mit Tumorwachstum und -invasion assoziiert sind.
Ein entscheidendes Molekül in dieser Schleife ist Noradrenalin (Norepinephrin), ein Neurotransmitter, der von sympathischen Nervenfasern freigesetzt wird. Trifft Noradrenalin auf Fibroblasten, löst es intrazelluläre Calcium-Signale aus – eine schnelle biochemische Reaktion, die pro-tumorale Funktionen der Fibroblasten verstärkt und weiteres Nervenwachstum fördert. Durch diese Rückkopplung entsteht nach und nach ein verfestigter Nischenzustand, der maligne Veränderungen begünstigt. Diese Beobachtungen erklären, wie Stresssignale und neuronale Komponenten die Tumormikroumgebung schon in sehr frühen Stadien prägen können.
Zusätzlich zur Fluoreszenz-3D-Bildgebung nutzten die Autorinnen und Autoren quantitative Analysen der Nerven- und Fibroblasten-Dichte, histologische Validierungen und molekulare Marker, um die räumliche Nähe und funktionale Beziehung zwischen Nervenfasern und myCAFs zu bestätigen. Solche kombinierten Methoden sind wichtig, um sicherzustellen, dass Beobachtungen nicht nur bildgebend, sondern auch biologisch relevant sind. Die Verbindung von strukturaler Bildgebung mit funktionellen Assays (z. B. Calcium-Imaging, Genexpressionsanalyse) stärkt die Aussagekraft der Befunde und liefert mechanistische Einsichten in den Prozess der Nervenrekrutierung.
Mechanismus und therapeutische Implikationen
Tiermodelle (Mausmodelle) und Experimente mit humanen Zellkulturen stützen dieselbe Abfolge: myCAFs sezernieren Anziehungs- und Wachstumsfaktoren; sympathische Nerven sprießen in die Läsion; Nerven setzen Noradrenalin frei; Fibroblasten reagieren, werden verstärkt aktiviert; die Läsion schreitet voran. Unterbricht man eine einzelne Verbindung in dieser Kette, schwächt das die Krankheitsprogression. In Laborversuchen reduzierte die chemische Hemmung sympathischer Aktivität – entweder durch Neurotoxine oder durch Blockade adrenerger Signalwege – die Aktivierung von Fibroblasten und verlangsamte das Tumorwachstum. In einem Bericht ging dies in bestimmten Modellen mit einer annähernd 50%igen Verringerung der Tumorgröße einher.
Diese Erkenntnis eröffnet praktische therapeutische Perspektiven. Bereits zugelassene Medikamente für andere Indikationen, wie adrenerge Blocker (zum Beispiel Doxazosin als alpha-adrenerger Antagonist oder bestimmte Beta-Blocker), könnten für eine Neukonfiguration zur Interferenz mit der nervgetriebenen Umgestaltung der Mikroumgebung geprüft werden. Kombiniert mit Chemotherapie oder Immuntherapie könnten solche Wirkstoffe das Fortschreiten während eines Zeitfensters abschwächen, in dem die Erkrankung noch lokalisiert und damit empfänglicher für Interventionen ist. Die klinische Translation erfordert sorgfältig konzipierte Studien, doch der prinzipielle Vorteil liegt auf der Hand: das Ökosystem anzugreifen, das dem Krebs seine Etablierung erleichtert, anstatt ausschließlich die Krebszellen selbst zu bekämpfen.
Zu bedenken sind jedoch mehrere kritische Punkte bei einer therapeutischen Umsetzung. Erstens: Welche adrenergen Rezeptoren spielen die dominierende Rolle in der Interaktion zwischen Nerven und myCAFs? Alpha- und Beta-Adrenozeptoren vermitteln unterschiedliche zelluläre Antworten; eine präzise pharmakologische Zielauswahl ist notwendig, um Wirksamkeit zu maximieren und unerwünschte Nebenwirkungen zu minimieren. Zweitens: Beeinträchtigt die Unterdrückung sympathischer Signalwege die normale Funktion anderer Organe (z. B. Herz-Kreislauf-System, stressbedingte Reaktionen)? Drittens: Wie lässt sich eine Kombinationstherapie optimal timen und dosieren, sodass sie synergistisch mit Chemotherapie oder Immuncheckpoint-Inhibitoren wirkt, ohne die Immunantwort zu unterdrücken?
Neben therapeutischen Optionen weist die Studie auf eine diagnostische Implikation hin: die neuronale Umgestaltung könnte als früher Biomarker dienen. Wenn es gelingt, diese Nerveninfiltration verlässlich zu detektieren oder zu bildgeben – etwa durch molekulare Bildgebung, PET-Tracer für neuronale Aktivität, MR-Neurographie oder spezielle Kontrastmittel, die neuralen Marker binden – könnten behandelnde Ärztinnen und Ärzte gefährdete Gewebebereiche früher identifizieren und intervenieren, bevor sich Tumore konsolidieren. Solche bildgebenden Verfahren müssen jedoch sensitiv und spezifisch genug sein, um zwischen entzündlich bedingter und tumoral bedingter Nervenveränderung zu unterscheiden.
Darüber hinaus bietet die Identifizierung neuronaler Umbauprozesse in der Tumormikroumgebung Möglichkeiten für kombinierte Biomarker-Strategien: molekulare Signaturen von myCAFs (Genexpressionsprofile), Serum- oder Gewebe-Biomarker für adrenerge Aktivität und Bildgebungsergebnisse könnten gemeinsam als prädiktives Panel dienen, um Progressionsrisiken besser abzuschätzen und personalisierte Interventionsfenster zu definieren. Solche multimodalen Diagnostikansätze würden die diagnostische Genauigkeit verbessern und Forschungsfragen für klinische Prüfungen konkretisieren.
Fachliche Einschätzung
„Früher dachten wir, Nerven seien vor allem für Schmerz oder für späte Invasion relevant“, sagt eine leitende Forscherin, die an der Arbeit beteiligt war. „Diese Studie kehrt diese Sicht um: Nerven sind von Anfang an aktive Architekten der Tumormikroumgebung. Ihre Signale zu blockieren könnte eine präventive Strategie sein, nicht nur eine palliative.“
Um diese Befunde in humanverträgliche Therapien zu überführen, ist ein fokussiertes, mehrstufiges Vorgehen nötig. Forschende müssen präzisieren, welche Signalmoleküle (z. B. spezifische Chemokine, Neurotrophine oder adrenerge Liganden) die Nervenrekrutierung treiben, und in welchem Maße eine Blockade der sympathischen Aktivität normale Gewebefunktionen beeinträchtigt. Parallel dazu sind prädiktive präklinische Modelle zu entwickeln, die menschliche Tumorheterogenität besser abbilden – darunter Patient-derived Xenografts (PDX) und Organoid-Systeme mit integriertem Nervengewebe.
Finanzierer und Patientenvertretungen zeigen bereits Interesse, weil neue Ansätze möglicherweise entscheidend sein könnten, um die Prognose einer Krebserkrankung zu verbessern, die berüchtigt ist für späte Diagnosen und eine geringe Ansprechrate auf Standardtherapien. Solche Initiativen könnten Studien unterstützen, die die Sicherheit und Wirksamkeit von Nerv-targetierenden Therapien in Kombination mit systemischen Behandlungen evaluieren.
Die Studie lehrt darüber hinaus eine größere Lektion: Tumoren sind Ökosysteme. Sie rekrutieren, überzeugen und okkupieren benachbartes Gewebe und Systeme – einschließlich des Nervensystems selbst. Erkennt man diese Rekrutierung frühzeitig, kann man die Interaktion stören und die "Konversation" zwischen Tumor, Stroma und Nerven möglicherweise abbrechen, bevor sie zur festen pathologischen Architektur heranwächst. Diese ökologische Perspektive auf Krebs eröffnet neue Ansätze für Prävention, Früherkennung und multimodale Therapieplanung.
Abschließend ist zu betonen, dass die Integration von Neurowissenschaften, Tumorbiologie und Bildgebung die zukünftige Forschung vorantreiben wird. Interdisziplinäre Teams, die Expertise in Neurobiologie, Onkologie, Bildanalyse und klinischer Translation zusammenführen, sind entscheidend, um diese Beobachtungen in praktikable klinische Lösungen zu übersetzen. Solche Zusammenarbeit kann helfen, robuste Biomarker zu entwickeln, optimale pharmakologische Targets zu identifizieren und Therapiekonzepte zu designen, die das Tumorökosystem nachhaltig stören – nicht nur die Tumorzellen allein.
Quelle: scitechdaily

Kommentar hinterlassen