8 Minuten
Stellen Sie sich eine Tablette vor, die gezielt in Leber und Darm einen zentralen Stoffwechsel-Schalter dämpft und dabei beobachtet, wie die Blutfettwerte deutlich sinken. Dieses Versprechen bewegt derzeit die kardiometabolische Forschung nach ersten Humanversuchen mit TLC-2716: Einem oral verabreichbaren Wirkstoff, der in einer kurzen Studie das sogenannte Remnant-Cholesterin um mehr als 60 Prozent reduzierte und die Triglyceride um nahezu 40 Prozent senkte.
Wie die Forschung zu einer gezielten Therapie führte
Der Weg zu TLC-2716 begann in der Genetik. Forscher, die große menschliche Datensätze durchforsteten, identifizierten NR1H3 — das Gen, das für den Liver X Receptor alpha (LXRα) kodiert — als einen wichtigen Regulator des Lipidstoffwechsels in Leber und Darm. Mithilfe von Mendelscher Randomisierung — einer Methode, die natürliche genetische Variation nutzt, um kausale Zusammenhänge abzuleiten — zeigten die Untersuchungen, dass eine erhöhte Expression von NR1H3 mit höheren Triglyceridwerten, Veränderungen im HDL-Cholesterin und klinischen Markern für Lebererkrankungen assoziiert ist.
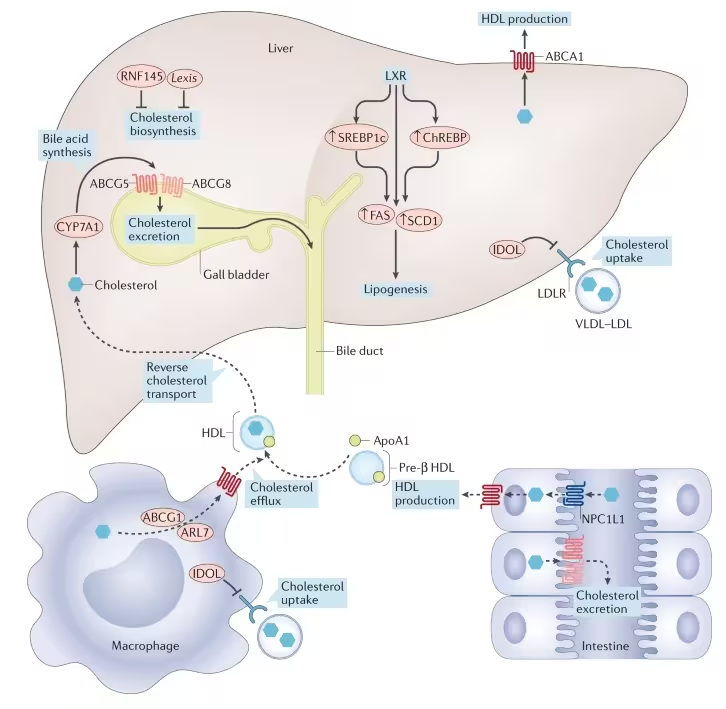
LXRα steht an einem Schaltpunkt für Fettsynthese und -transport. Eine breite Aktivierung des Rezeptors kann zwar günstige Wege zur Cholesterinentfernung in Immunzellen anstoßen, gleichzeitig jedoch die Lipogenese in Leber und Darm verstärken. Diese doppelte Wirkung stellte die Forschung lange vor das grundlegende Problem: Wie kann man die schädlichen, fettbildenden Effekte unterdrücken, ohne die protektiven Funktionen des Rezeptors in anderen Geweben zu verlieren?
Die Strategie der Entwickler war räumliche Selektivität. Anstatt einen systemweiten Blocker zu entwickeln, entwarf das Team einen Wirkstoff mit auf Leber und Darm beschränkter Aktivität. Präklinische Studien in Nagetieren, erkrankten menschlichen Leber-Organoiden und nicht-menschlichen Primaten identifizierten TLC-2716 als Kandidaten, der die hepatische Lipogenese reduzierte, die Aufnahme diätischer Fette verlangsamte und die Clearance zirkulierender Lipide verbesserte — und dabei die LXR-Funktion außerhalb dieser Gewebe größtenteils verschonte.
Mechanistisch zielt dieser Ansatz auf Prozesse wie die VLDL-Sekretion aus der Leber, die Umwandlung von Chylomikronen im Darm sowie die Bildung und Elimination von Chylomikron- und VLDL-Remnants, die nach Nahrungsaufnahme im Blut verbleiben. Durch die Verringerung der hepatischen Lipogenese werden weniger endogen erzeugte Triglyceride und VLDL-Partikel ins Blut freigesetzt; durch die Beeinflussung der intestinalen Signalwege kann die Resorption und der Enterozyten-vermittelte Transport von Nahrungsfetten moduliert werden. Zusammen führen diese Effekte zu einer Reduktion von remnant-reichen Lipoproteinen, die als hoch atherogen gelten.
Wichtig für die Translation in den Menschen waren auch pharmakokinetische Konzepte: eine geringen systemischen Exposition außerhalb von Leber und Darm, lokale Metabolisierung im Enterozyten bzw. hepatischen Zellen und eine chemische Struktur, die den Rezeptorbindungsmodus so moduliert, dass nützliche Effekte in Zielgeweben erhalten bleiben. Solche Gewebespezifität ist ein wachsender Trend in der Arzneimittelentwicklung, um Nebenwirkungen durch globale Rezeptorblockade zu vermeiden.
Erste Testung am Menschen: Was die Studie zeigte
In einer randomisierten Phase-1-Studie, veröffentlicht in Nature Medicine, erhielten etwa 100 gesunde erwachsene Freiwillige über 14 Tage täglich orale Dosen von TLC-2716 oder Placebo. Die Studie unter Leitung von Johan Auwerx an der EPFL und teils finanziell unterstützt vom Biotech-Unternehmen OrsoBio konzentrierte sich auf Pharmakologie, Sicherheit sowie kurzfristige metabolische Effekte und umfasste mehrere Dosisstufen, eine doppelt verblindete Randomisierung und standardisierte postprandiale Messungen.
Die Resultate waren für ein First-in-Human-Experiment bemerkenswert: Bei höheren Dosen reduzierte das Präparat die Nüchtern-Triglyceride um bis zu 38,5 Prozent. Das Remnant-Cholesterin — jene atherogene Fraktion, die nach dem Essen im Blut verbleibt — fiel in postprandialen Messungen um bis zu 61 Prozent. Alle Teilnehmer begannen mit normalen Lipidprofilen und nahmen keine anderen lipidsenkenden Medikamente ein. Insgesamt wurde das Medikament in den geprüften Dosisbereichen als sicher und überwiegend gut verträglich berichtet; die Häufigkeit schwerwiegender unerwünschter Ereignisse war gering und ohne klare Dosisabhängigkeit.
Die Studie dokumentierte neben den Lipidveränderungen auch pharmakokinetische Parameter wie maximale Plasmakonzentrationen (Cmax), Halbwertszeit (t1/2) und Akkumulation bei wiederholter Gabe. Laborchemisch wurden Leberenzyme, Nierenparameter und Blutbild überwacht; nennenswerte Hinweise auf hepatotoxische Effekte wurden in dieser kurzen Dauer nicht beobachtet, was jedoch mit Vorsicht zu interpretieren ist, da manche Lebertoxizitäten erst bei längerer Exposition sichtbar werden.
Warum ist Remnant-Cholesterin relevant? Lipoprotein‑Remnants, die reich an Triglyceriden sind, dringen leichter in die Arterienwand ein und tragen zur Entwicklung der atherosklerotischen Herz-Kreislauf-Erkrankung (ASCVD) bei. Epidemiologische und mechanistische Studien deuten darauf hin, dass erhöhte Remnant-Konzentrationen unabhängig von LDL-Cholesterin das Risiko für Myokardinfarkt, Schlaganfall und andere kardiovaskuläre Ereignisse erhöhen. Darüber hinaus stehen Remnants im Zusammenhang mit akutem Pankreatitisrisiko bei sehr hohen Triglyceridspiegeln und mit der Entstehung sowie Progression der metabolischen Dysfunktions-assoziierten steatotischen Lebererkrankung (MASLD, früher NAFLD/NASH).
Die orale Verabreichung des Wirkstoffs ist ein weiterer praktischer Vorteil. Eine wirksame, einmal täglich einzunehmende Tablette könnte die Therapietreue verbessern, Kosten gegenüber injizierbaren Biologika senken und die Kombination mit etablierten lipidsenkenden Therapien wie Statinen, Fibraten oder Omega-3-Fettsäure-Präparaten erleichtern. Gleichwohl müssen potenzielle Wechselwirkungen, etwa über CYP-Enzyme oder Transporter wie OATP, in weiteren Studien adressiert werden.
Folgen, Vorbehalte und der weitere Weg
Diese frühen Signale sind vielversprechend, doch geboten ist Vorsicht. Phase‑1-Studien dienen primär der Bewertung von Sicherheit und Pharmakologie in kleinen, meist gesunden Populationen; sie stellen keinen Beweis für langfristigen klinischen Nutzen bei kranken Patienten dar. Das Forschungsteam weist darauf hin, dass die beobachteten metabolischen Verbesserungen bei Probanden mit normalen Lipiden in Patienten mit Hypertriglyceridämie oder MASLD sogar stärker ausgeprägt sein könnten — diese Hypothese muss jedoch in gezielten Phase‑2- und Phase‑3-Studien überprüft werden.
Die nächsten Schritte verlängern den Zeitplan: Studien mit längerer Dauer bei übergewichtigen oder adipösen Personen mit erhöhten Triglyceriden und Fettlebererkrankung sind geplant, ebenso Dosisfindungsstudien in diversen Populationen und eine sorgfältige Überwachung möglicher Off‑Target‑Effekte, falls das Molekül die Leber‑Darm‑Kompartimente verlassen sollte. Regulatorische Behörden werden sowohl auf Wirksamkeit gegenüber harten Endpunkten — weniger Herzinfarkte, Verzögerung der Lebererkrankungsprogression, Verbesserung histologischer NASH‑Parameter — als auch auf eine nachhaltige Sicherheit achten.
Konkrete Herausforderungen liegen in mehreren Bereichen: Erstens muss gezeigt werden, dass die Lipidsenkung durch TLC-2716 tatsächlich zu einer Reduktion klinisch relevanter Ereignisse führt (z. B. MACE — Major Adverse Cardiovascular Events). Zweitens sind Langzeitdaten zur Lebergesundheit erforderlich, einschließlich Bildgebung, Biomarkern und, wenn möglich, Leberhistologie, um das Verhältnis von Nutzen und Risiko bei MASLD/NASH zu klären. Drittens sind mögliche Effekte auf das Immunsystem, auf Cholesterintransportwege (z. B. HDL‑Funktion, Cholesterin‑Efflux) und auf den enterohepatischen Kreislauf zu überwachen.
Weiterhin sollte die Auswirkung auf den Darmmikrobiom-Status untersucht werden, da Veränderungen der intestinalen Lipidverarbeitung und der lokal wirksamen Metaboliten die mikrobiellen Ökosysteme beeinflussen können, was wiederum Stoffwechselpfade moduliert. Schließlich sind Fragen zur Herstellung, Stabilität und zu Produktionskosten für ein potentielles Massenprodukt zu klären, falls spätere Studien positive Ergebnisse liefern.
Experteneinschätzung
„Was TLC-2716 interessant macht, ist seine Gewebespezifität“, sagt Dr. Elena Rossi, kardiometabolische Pharmakologin an der Universität Mailand. „LXRα nur dort zu modulieren, wo er die schädliche Fettproduktion antreibt, vermeidet den groben Hammer-Ansatz, der frühere Versuche scheitern ließ. Wenn sich diese Ergebnisse bei Patienten mit Dyslipidämie bestätigen, könnten wir eine neue Klasse oraler Therapien haben, die bestehende Mittel ergänzt, anstatt sie zu ersetzen.“
Fachleute heben hervor, dass die konsistenten metabolischen Effekte — sichtbar sowohl bei Menschen als auch in Tiermodellen — eine solide Grundlage für weiterführende klinische Prüfungen darstellen. Für Kliniker und Patientinnen sowie Patienten, die mit steigenden Raten von MASLD und remnant‑getriebenem kardiovaskulärem Risiko konfrontiert sind, bietet ein auf Leber und Darm fokussierter LXRα‑Modulator einen neuen Ansatz für ein bekanntes Problem.
Zum aktuellen Zeitpunkt bleibt TLC-2716 ein experimenteller Wirkstoff. Doch das zugrundeliegende Konzept — die gewebespezifische Modulation eines zentralen Stoffwechselreglers — könnte die Herangehensweise an komplexe Lipidstörungen verändern und bietet die Möglichkeit, unerwünschte Effekte zu minimieren, indem man gezielt die relevanten Organe adressiert. Ob sich diese Idee in klinischen Endpunkten bewährt, wird von den kommenden Studien abhängen; der derzeitige Befund ist jedoch ein ermutigender Schritt in Richtung neuer oraler Therapien für Fettstoffwechselstörungen und verwandte Lebererkrankungen.
Quelle: sciencealert

Kommentar hinterlassen