8 Minuten
Stellen Sie sich vor, Demenz würde nicht primär auf einem Gehirnscan diagnostiziert, sondern durch Befunde, die Ihr Zahnarzt, Hepatologe oder Audiologe sieht. So ungewöhnlich das klingt: Eine umfassende Übersichtsarbeit zu weltweiten Studien deutet darauf hin, dass dies näher an der Realität liegen könnte, als man erwarten würde: Etwa jeder dritte Demenzfall weltweit könnte statistisch mit Erkrankungen verbunden sein, die außerhalb des zentralen Nervensystems beginnen.
Forscherinnen und Forscher der Sun Yat-sen-Universität werteten mehr als 200 Studien aus und identifizierten bis zu 16 periphere Erkrankungen, die mit einem erhöhten Demenzrisiko verknüpft sind. Das entspricht nahezu 19 Millionen Demenzfällen, die statistisch mit Problemen an Zahnfleisch, Leber, Ohren, Augen und im Stoffwechsel in Verbindung stehen. Diese Daten beweisen nicht, dass periphere Erkrankungen Demenz verursachen. Die Muster sind jedoch konsistent genug, um Aufmerksamkeit zu verlangen und vertiefte Forschung anzustoßen.
Wie der Körper mit dem Gehirn kommuniziert
Das Gehirn wird oft wie eine Insel betrachtet: durch Blut geschützt, abgeschirmt von der Blut-Hirn-Schranke, ein Zuhause für Neurone und Synapsen allein. Dieses Bild ist tröstlich — und zugleich unvollständig. Das Nervensystem ist ein Netzwerk ständiger Kommunikation. Blutgetragene Signale, Immunmoleküle, Stoffwechselbotenstoffe und Nervenbahnen sorgen dafür, dass das Gehirn permanent mit Organen im ganzen Körper in Kontakt steht.
Betrachten wir die Parodontitis: Chronische Entzündungen des Zahnfleisches führen dazu, dass Bakterien und inflammatorische Proteine in den Blutkreislauf gelangen. Systeme der Immunantwort werden aktiviert, Zytokine steigen systemisch an und können Entzündungsreaktionen auch im Gehirn begünstigen oder verstärken. Hörverlust wiederum entzieht dem Gehirn sensorische Eingaben; neuronale Netzwerke reorganisieren sich, und Bereiche können aufgrund reduzierter Stimulation atrophieren. Leberzirrhose verändert den Abbau und die Ausscheidung von Toxinen und Metaboliten, wodurch potenziell neurotoxische Substanzen das zentrale Nervensystem stärker belasten. Typ-2-Diabetes verändert Glukoseverwertung und Insulin-Signalwege — Prozesse, von denen Neurone für ihre Energieversorgung abhängen. Jede dieser peripheren Störungen kann auf unterschiedlichen Pfaden das Gehirn in Richtung kognitiver Beeinträchtigung drängen.
Nicht jede periphere Erkrankung zeigte eine starke Verbindung zur Demenz. Die Übersicht fand schwächere oder nicht-signifikante Assoziationen für etwa zehn häufige Krankheiten — darunter Hypertonie, Adipositas, hohe Cholesterinwerte, Depression und Schilddrüsenfunktionsstörungen. Diese Nuance ist bedeutsam: Sie weist auf Komplexität hin. Manche systemische Probleme können die Kognition direkt beeinflussen, andere indirekt über gemeinsame Risikofaktoren, und einige möglicherweise gar nicht.
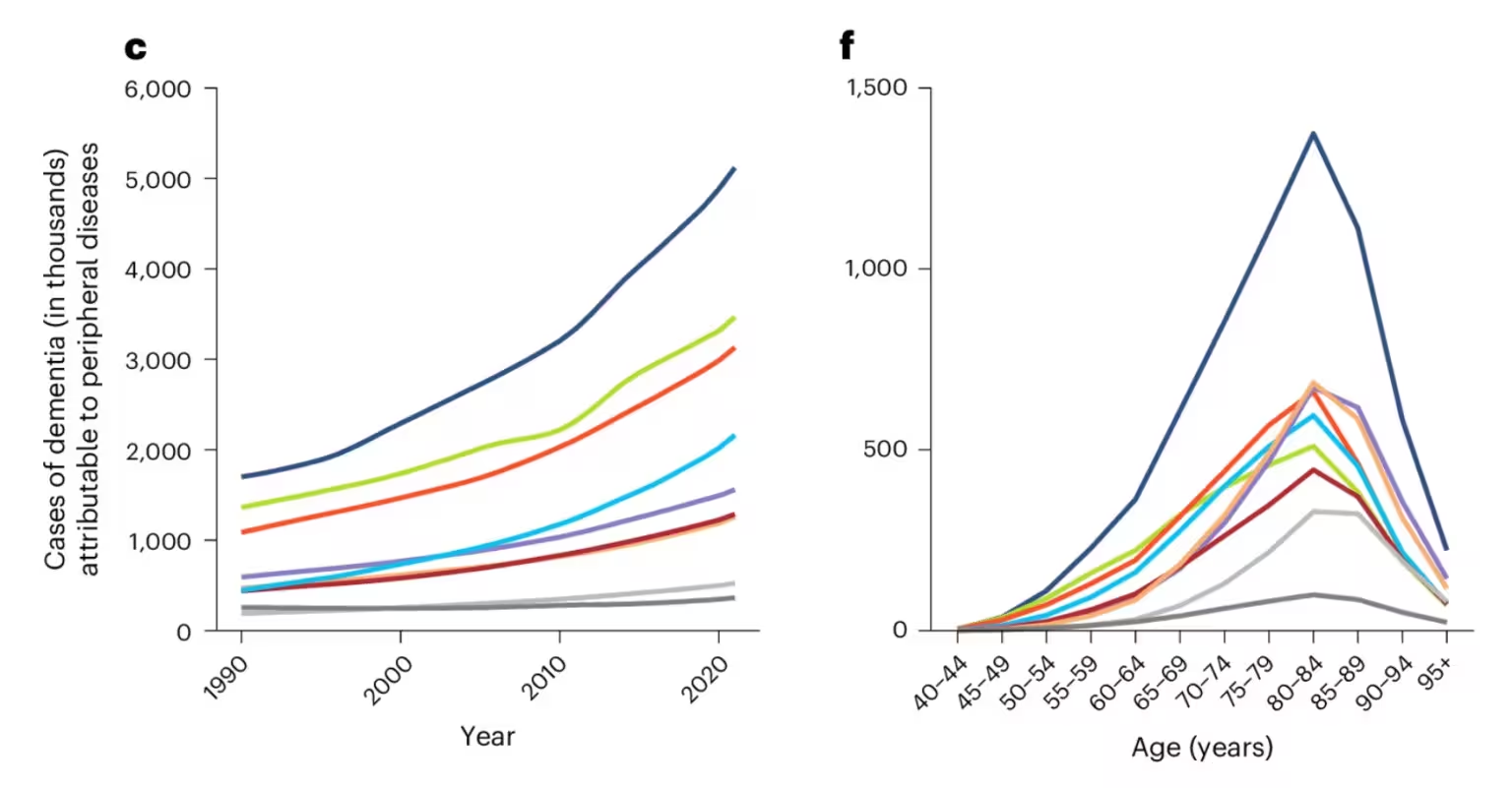
Die Analyse beinhaltet auch zeitliche Trends und Altersvariationen: Fälle von Demenz zwischen 1990 und 2021 zeigen unterschiedliche Verläufe je nach assoziierter peripherer Erkrankung. Dunkelblau steht für audiovisuelle Störungen, Grün für parodontale Erkrankungen, Rosa für Leberzirrhose und chronische Lebererkrankungen, Hellblau für Typ-2-Diabetes, Purpur für chronische Nierenerkrankungen, Rot für Osteoarthritis, Hellgrau für COPD und Dunkelgrau für immunvermittelte entzündliche Erkrankungen. Solche Farbkodierungen in epidemiologischen Übersichtsarbeiten helfen, Muster über Regionen und Altersgruppen sichtbar zu machen.
Warum rücken diese Zusammenhänge erst jetzt stärker in den Fokus? Zwei Gründe sind entscheidend: Zum einen größere, qualitativ hochwertigere Bevölkerungsstudien und Metaanalysen; zum anderen ein konzeptioneller Wandel weg von der Vorstellung, Demenz sei eine einheitliche, ausschließlich im Gehirn verankerte Erkrankung. Mit wachsenden Datensätzen treten Subtypen kognitiver Störungen hervor — einige mit molekularen und klinischen Signaturen, die sich mit Immunstörungen, metabolischem Ungleichgewicht oder chronischen Infektionen überschneiden.
Nehmen wir den Hörverlust als Beispiel: Mehrere Beobachtungsstudien deuten inzwischen auf ein geringeres Demenzrisiko bei Menschen hin, die Hörgeräte benutzen. Eine kausale Beziehung ist nicht bewiesen, doch das Ergebnis passt zu einem plausiblen Mechanismus: Wiederhergestellter auditorischer Input hilft, die kognitive Belastung zu reduzieren und soziale Teilhabe aufrechtzuerhalten — beides Faktoren, die das Gehirn schützen. In ähnlicher Weise wurde in einigen Kohorten beobachtet, dass die Behandlung von Lebererkrankungen oder eine verbesserte glykämische Kontrolle bei Typ-2-Diabetes mit günstigeren kognitiven Verläufen assoziiert ist.
Solche Befunde haben weitreichende Konsequenzen für die klinische Forschung. Jahrzehntelang zielten pharmakologische Studien zu Alzheimer und verwandten Demenzen auf neuronale Zielstrukturen — Plaques, Tau-Fibrillen, synaptische Signalwege. Viele dieser Studien blieben ohne durchschlagenden Erfolg. Eine mögliche Erklärung könnte in der Auswahl der Target-Strukturen liegen: Wenn periphere Prozesse wie Immunfehlregulation, metabolischer Stress und chronische Entzündungen das Umfeld schaffen, in dem kognitive Verschlechterung entsteht, reicht eine ausschließlich zentralnervös ausgerichtete Therapie möglicherweise nicht aus.
Experteneinsicht
„Wir haben unterschätzt, wie durchlässig die Grenze zwischen Gehirn und Körper tatsächlich ist“, sagt Dr. Elena Márquez, Neurologin und klinische Forscherin (fiktiv im Kontext). „Das heißt nicht, dass jede periphere Erkrankung zwangsläufig Demenz verursacht. Es bedeutet vielmehr, dass Organsysteme in vielfältiger Weise interagieren und die Anfälligkeit beeinflussen können. Präventivmedizin — zahnärztliche Versorgung, Wiederherstellung des Hörvermögens, Erhalt der Lebergesundheit, metabolische Kontrolle — könnte neben der Neurologie Teil umfassender Strategien zur Erhaltung kognitiver Gesundheit werden.“
Dr. Márquez betont, dass mechanistische Forschung essenziell sei: „Wir brauchen Längsschnittstudien, die periphere Biomarker und Veränderungen im Gehirn über längere Zeiträume verfolgen, sowie interventionsbasierte Trials, die prüfen, ob die Behandlung peripherer Erkrankungen kognitive Verläufe tatsächlich verändert. Nur so lässt sich von Korrelation zu Kausalität voranschreiten.“
Die Implikationen reichen über die klinische Praxis hinaus. Gesundheitsplanung, Ressourcenverteilung und Screening-Programme könnten neu ausgerichtet werden. Wenn Parodontitis oder unbehandelter Hörverlust in signifikanter Weise zum Demenzrisiko in der Bevölkerung beitragen, könnten verhältnismäßig kostengünstige Interventionen große gesundheitliche Gewinne bringen — von verbesserter Mundhygiene über breitere Zugänge zu Hörgeräten bis hin zu systematischem Management von Leber- und Stoffwechselerkrankungen.
Zugleich ist Vorsicht geboten. Assoziation ist keine Erklärung. Die Autorinnen und Autoren der Übersicht betonen selbst, dass ihre Ergebnisse "das Potenzial anzeigen, die Demenzinzidenz durch proaktive Prävention peripherer Erkrankungen zu mindern", jedoch nicht die Beweiskraft für definitive Kausalität erbringen. Das nächste Forschungsjahrzehnt muss entwirren, welche peripheren Faktoren kausale Rollen spielen, welche Marker gemeinsamen Risikos sind und welche harmlose Altersphänomene oder Begleiterkrankungen darstellen.
Ein zunehmend klarer Grundsatz lautet: Kein Gehirn ist eine Insel. Während die Medizin stärker systemisch denkt — etwa durch die Untersuchung der Darm-Hirn-Achse, der Gehirn-Immunsystem-Achse und des komplexen Zusammenspiels metabolischer und vaskulärer Gesundheit — rückt die Möglichkeit in den Mittelpunkt, dass Prävention oder Verzögerung kognitiver Verschlechterung außerhalb des Schädels ebenso erfolgversprechend sein kann wie intrazerebrale Interventionen. Ein solcher Perspektivwechsel könnte verändern, wie wir Demenzscreening, Therapie und öffentliche Gesundheitsstrategien im Alltag gestalten.
Praktische Empfehlungen, basierend auf gegenwärtiger Evidenz, könnten beinhalten: regelmäßige zahnärztliche Kontrollen und Behandlung entzündlicher Parodontalerkrankungen, frühzeitige Untersuchung und Rehabilitationsangebote bei Hörverlust, konsequentes Management von Blutzucker und Metabolismus bei Diabetes, sowie eine engmaschige Kontrolle von Leber- und Nierenerkrankungen. Diese Maßnahmen sind teils etabliert im Rahmen chronischer Krankheitsvorsorge und könnten durch ihren Einfluss auf kognitive Gesundheit zusätzlichen Nutzen stiften.
Für die Forschung ergeben sich konkrete Handlungsfelder: standardisierte periphere Biomarker-Profile, kombiniert mit Bildgebung und neuropsychologischen Längsschnittdaten; randomisierte Studien, die periphere Interventionen (z. B. aggressive Parodontaltherapie, Hörrehabilitation, metabolische Optimierung) auf kognitive Endpunkte prüfen; und molekularbiologische Untersuchungen, die Signalketten von peripheren Entzündungsreaktionen bis in das zentrale Nervensystem kartieren.
Auf der Ebene der Gesundheitspolitik sind ökonomische Analysen erforderlich: Wie verhält sich das Kosten-Nutzen-Verhältnis gezielter Präventionsprogramme, die auf periphere Erkrankungen abzielen, gegenüber rein neurologischen Interventionen? Schon heute deuten Modelle darauf hin, dass Maßnahmen mit niedrigen Kosten und hoher Reichweite — wie bessere Zahn- und Vorsorgeversorgung oder breiter zugängliche Hörgeräte — erhebliche Populationseffekte auf das Demenzgeschehen haben könnten, wenn die Assoziationen weiterhin Bestand haben.
Methodologische Herausforderungen bleiben: Heterogenität der Studiendefinitionen, unterschiedliche diagnostische Kriterien für Demenz und periphere Erkrankungen, residuale Konfounder wie Bildungsniveau oder sozioökonomischer Status, und das Problem umgekehrter Kausalität (beispielsweise, dass frühe neurodegenerative Veränderungen Gesundheitsverhalten beeinflussen). Fortschritte in digitalen Gesundheitsdaten, Biobanking und vernetzten Kohortenstudien bieten jedoch neue Möglichkeiten, diese Hürden zu adressieren.
Zusammenfassend: Die wachsende Evidenzbasis legt nahe, dass periphere Erkrankungen — von Parodontitis über Leberkrankheit bis zu Hörverlust und Stoffwechselstörungen — Teil des komplexen Risikofelds für kognitive Erkrankungen sein können. Für Klinik, Forschung und Gesundheitspolitik eröffnet dies Chancen, Prävention und Behandlung zu erweitern und ganzheitlicher zu denken. Während die finale Klärung kausaler Mechanismen noch aussteht, ist die Botschaft pragmatisch: Ein integrierter, organsystemübergreifender Ansatz könnte helfen, die Belastung durch Demenzerkrankungen in kommenden Jahrzehnten zu reduzieren.
Quelle: sciencealert

Kommentar hinterlassen