6 Minuten
Naujas Aarhuso universiteto laboratorinis tyrimas atskleidžia mechanizmą, kuriuo alfa‑sinukleino oligomerai — smulkios baltymo grandinės, jau siejamos su Parkinsono liga — gali fiziškai prasiskverbti per ląstelių membranas ir suformuoti laikinus porus. Šie mikroskopiniai plyšiai leidžia nekontroliuojamai pratekėti jonams ir mažoms molekulėms, kas gali sutrikdyti ląstelės cheminę pusiausvyrą ir prisidėti prie neuronų funkcinių sutrikimų. Tyrimo rezultatai pateikia detalesnį vaizdą, kaip baltymų sankaupos gali pakenkti smegenų ląstelėms ir siūlo naujus taikinius terapijai.
Scientific background: alpha‑synuclein, oligomers and neurodegeneration
Alfa‑sinukleinas yra įprastas neuronų baltymas, dalyvaujantis sinapsinių vezikulų pernašoje ir neuroperdavimo procesuose. Parkinsono ligos atveju jis gali netinkamai sulankstytis ir kauptis į didesnes fibriles, žinomas kaip Lėvijų kūneliai. Kartu su šiomis fibrilėmis dažnai pastebimos mažesnės tirpios jungtys, vadinamos oligomerais — daugelis tyrėjų laiko būtent oligomerus ypač toksiškais. Naujas tyrimas koncentruojasi į tuos oligomerus ir jų fizinį sąlyčio su lipidiniu dvisluoksniu, kuris yra pagrindinis ląstelių membranos struktūrinis elementas, pobūdį.
Anksčiau buvo pasiūlyta, kad oligomerai gali suardyti membranas, tačiau Aarhuso komanda panaudojo supaprastintą, gerai kontroliuojamą membranos modelį, kad vizualizuotų šį procesą precedento neturinčiame detalume. Izoliuodami šią sąveiką, jie galėjo užfiksuoti žingsninius pokyčius, vedančius nuo sąlyčio iki poros susidarymo.
Experimental setup and key observations
Naudodami sintetinius membranų modelius, atitinkančius neuronų lipidų sudėtį, tyrėjai pridėjo alfa‑sinukleino oligomerų ir stebėjo membranos vientisumą aukštos raiškos vaizdavimo bei elektros matavimų pagalba. Komanda aprašo trijų stadijų procesą: pradinį oligomerų prisitvirtinimą ant membranos paviršiaus, dalinį įsiskverbimą į lipidinį dvisluoksnį ir galutinį persitvarkymą į poros struktūrą, persmelkiančią membraną.
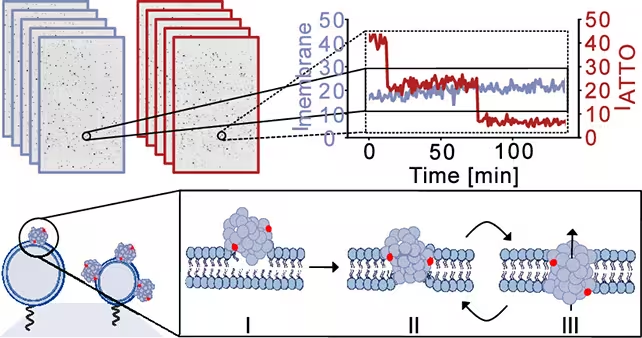
Tyrėjai fiksavo modeliavimo ląstelių membranų momentines nuotraukas, kad stebėtų, kaip jos blevyzgė ir kokį nutekėjimą tai sukėlė. (Bro̷chner et al., ACS Nano, 2025)
Vartojus poras, jos nebuvo statiškos skylės. Priešingai, jos rodė dinaminį elgesį — trumpais intervalais pakartotinai atsidarinėjo ir užsidarinėjo. Toks permainingumas yra svarbus, nes jis gali sukelti epizodinius jono srautus, kurie palaipsniui trikdo ląstelių homeostazę, užuot sukėlę akimirkos katastrofą.
Membrane curvature preference and mitochondrial vulnerability
Reikšmingas pastebėjimas buvo oligomerų polinkis prie labiau išlinkusių membranų. Labai išlinkusios membranos būdingos viduląsteliniams organoidams, tokiems kaip mitochondrijos. Mitochondrijos yra esminės neuronų energijos gamybai ir kalcio reguliacijai; jeigu jų membranos kartojasi suardomos, tai gali sukelti energetinį nepakankamumą, oksidacinį stresą ir tolesnius kelius, susijusius su neurodegeneracija.
Implications for Parkinson’s disease mechanisms and therapy
Jei alfa‑sinukleino oligomerai in vivo suformuoja laikinus porus neuronų membranose, tai pateiktų tiesioginį mechanizmą, paaiškinantį, kaip baltymų sankaupos gali sukelti funkcijų pablogėjimą dar prieš ląstelės žūtį. Laikiniai jonų disbalansai, kartojami per laiką, gali sutrikdyti sinapsinį signalavimą, pažeisti kalcio homeostazę ir palaipsniui silpninti neuronų atsparumą. Porų dinamiškas, grįžtamasis pobūdis taip pat gali paaiškinti, kodėl neuronai Parkinsono ligos atveju dažnai lieka gyvybingi ilgą laiką nepaisant progresuojančio funkcijų praradimo.
Molekulinės biologės Bo Volf Brøchner, vieno iš tyrimo bendraautorių, nuomone, porų atsidarymas ir užsidarymas gali leisti ląstelių pompoms laikinai kompensuoti, atidedant greitą žlugimą. Toks kompensacinis langas gali būti galimybė terapijoms atstatyti pusiausvyrą arba blokuoti porų susidarymą.
Aarhuso komanda jau tyrinėjo molekulinius žymeklius, vadinamus nanokūnais (angl. nanobodies) — mažomis antikūnų dalimis, kurios gali atpažinti oligomerizuotą alfa‑sinukleiną po jo susidarymo. Nors šie nanokūnai yra naudingi aptikimui, jie dar nėra pavykę užkirsti kelio porų formavimuisi. Ateities terapinės strategijos galėtų siekti:
- Stabilizuoti alfa‑sinukleiną nekenksmingose konformacijose
- Tiesiogiai blokuoti porų susidarymą mažosiomis molekulėmis arba antikūnais
- Apsaugoti arba atkurti mitochondrijų membranas
- Stiprinti ląstelių gebėjimą šalinti oligomerus per proteostazės ir autofagijos kelius
Limitations and next steps
Eksperimentai buvo atlikti švariuose, sintetiniuose sistemose, kad būtų izoliuoti vieni kintamieji. Toks eksperimentinis aiškumas yra privalumas, tačiau dabar rezultatai turi būti patvirtinti gyvuose neuronuose ir gyvūnų modeliuose, kur membranų sudėtis, baltymų partneriai ir ląstelės gynybinės priemonės yra sudėtingesnės. Tyrėjams reikės įrodyti, ar oligomerų sukeltos poros iš tikrųjų atsiranda nepažeistoje smegenų aplinkoje, kaip dažnai tai vyksta ir kuri neuronų potipė yra labiausiai pažeidžiama.
Tolesni darbai turėtų kiekybiškai įvertinti porų dydį, trukmę ir jonišką selektyvumą bei ištirti, kaip jos sąveikauja su ląstelės taisomosiomis sistemomis. Jei tai bus patvirtinta in vivo, tokios poros galėtų tapti matuojamu ankstyvo neurono streso biomarkeriu ir taikiniu liga modifikuojančioms terapijoms.
Expert Insight
Commentary from a practising neuroscientist
Dr. Elena Marquez, vyresnioji neurobiologijos dėstytoja (fiktyvi), komentuoja: "Šis tyrimas pateikia įtikinamą mechanistinį ryšį tarp oligomerinio alfa‑sinukleino ir membranos disfunkcijos. Žingsnis po žingsnio vizualizuojamas prisitvirtinimo, įsiskverbimo ir porų susidarymo procesas padeda sujungti biocheminį toksiškumą su fiziologiniais padariniais — epizodine jono dereguliacija, o ne tiesiogine nekroze. Iš vertimo perspektyvos dabar iššūkis yra įrodyti šiuos įvykius nepažeistuose neuronuose ir sukurti molekules, kurios arba užkirstų kelią porų formavimuisi, arba greitai užtaisytų trumpalaikius pažeidimus. Lygiagrečiai taikant mitochondrijų membranos apsaugą, ypač svarbu atsižvelgti į oligomerų polinkį į išlinkusias membranas."
Related technologies and future prospects
Keli papildomi technologiniai sprendimai galėtų pagreitinti šių atradimų vertimą į terapiją ar diagnostiką:
- Pažangus gyvų ląstelių vaizdavimas, fiksuojantis trumpalaikes porų atsiradimo akimirkas neuronuose
- Biosensoriai jonų srautams ir mitochondrijų membranos potencialui matuoti
- Aukšto pralaidumo skaitymo platformos mažosioms molekulėms, blokuojančioms porų susidarymą
- Nanokūnų platformų tobulinimas, neutralizuojant oligomerus dar prieš jų sąveiką su membrana
Bendrai šie metodai galėtų atvesti prie ankstyvo etapo intervencijų, kurios lėtintų ligos progresavimą užkertant kelią pasikartojančiam subletaliniam membranos pažeidimui.
Conclusion
Aarhuso universiteto tyrimas praplėtė mūsų supratimą apie Parkinsono ligą, parodydamas, kad alfa‑sinukleino oligomerai gali formuoti dinamiškas poras modelinėse membranose per prisitvirtinimo–įsiskverbimo–poros susidarymo seką. Šie laikini pažeidimai, kuriems būdingas polinkis į išlinkusias membranas, tokias kaip mitochondrijų paviršiai, gali sukelti epizodinius jonų sutrikimus, kurie kaupiantis virsta neuronų disfunkcija. Nors reikalingas tolimesnis patvirtinimas gyvose sistemose, rezultatai pabrėžia naujus mechanistinius taikinius — nuo oligomerų neutralizavimo iki membranos apsaugos — kurie gali nukreipti būsimą terapinį ir diagnostinį vystymą. Tyrimas, publikuotas ACS Nano, atveria naują kryptį, kaip smulkios baltymų sankaupos prisideda prie neurodegeneracijos ir kaip šį procesą būtų galima nutraukti prieš neišvengiamą funkcijos praradimą.
Quelle: sciencealert

Kommentar hinterlassen