8 Minuten
Sie werden die Zeit im Auge prüfen. Kurzer Satz. Kühnes Vorhaben.
Life Biosciences, ein in Boston ansässiges Startup, hat von der U.S. Food and Drug Administration (FDA) die Zulassung erhalten, die erste klinische Studie am Menschen für eine Therapie zu beginnen, die darauf abzielt, zelluläres Altern rückgängig zu machen. Das Projekt mit dem Codenamen ER-100 nutzt eine kontrollierte Form der zellulären Reprogrammierung — ein Verfahren, das darauf abzielt, alte oder geschädigte Zellen durch Zurücksetzen epigenetischer Schalter in einen jüngeren, funktionelleren Zustand zu versetzen. Das unmittelbare Ziel ist eng und konkret: die Behandlung des Glaukoms, einer Erkrankung, bei der erhöhter Augeninnendruck den Sehnerv schädigt und irreversible Erblindung verursachen kann.
Wie die Therapie wirkt und warum das Auge zuerst behandelt wird
Im Kern von ER-100 steht ein molekularer Trick, der erstmals vor zwei Jahrzehnten in Nobel-prämierten Arbeiten angedeutet wurde: Eine kleine Zahl von Faktoren kann ausgereifte Zellen zurück in einen embryonalähnlichen, plastischeren Zustand führen. Shinya Yamanakas Arbeiten zu den sogenannten Yamanaka-Faktoren (häufig als OSKM bezeichnet) haben gezeigt, dass Zellen ihre Identität bis zu einem gewissen Grad zurückgewinnen oder erneuern können. Life Biosciences verwendet eine partielle und zeitlich begrenzte Version dieser Methode, sodass die Zellen ihre Gewebeidentität nicht vollständig verlieren. Stattdessen sollen die Zellen jünger und leistungsfähiger innerhalb des Gewebes werden, dem sie bereits angehören.
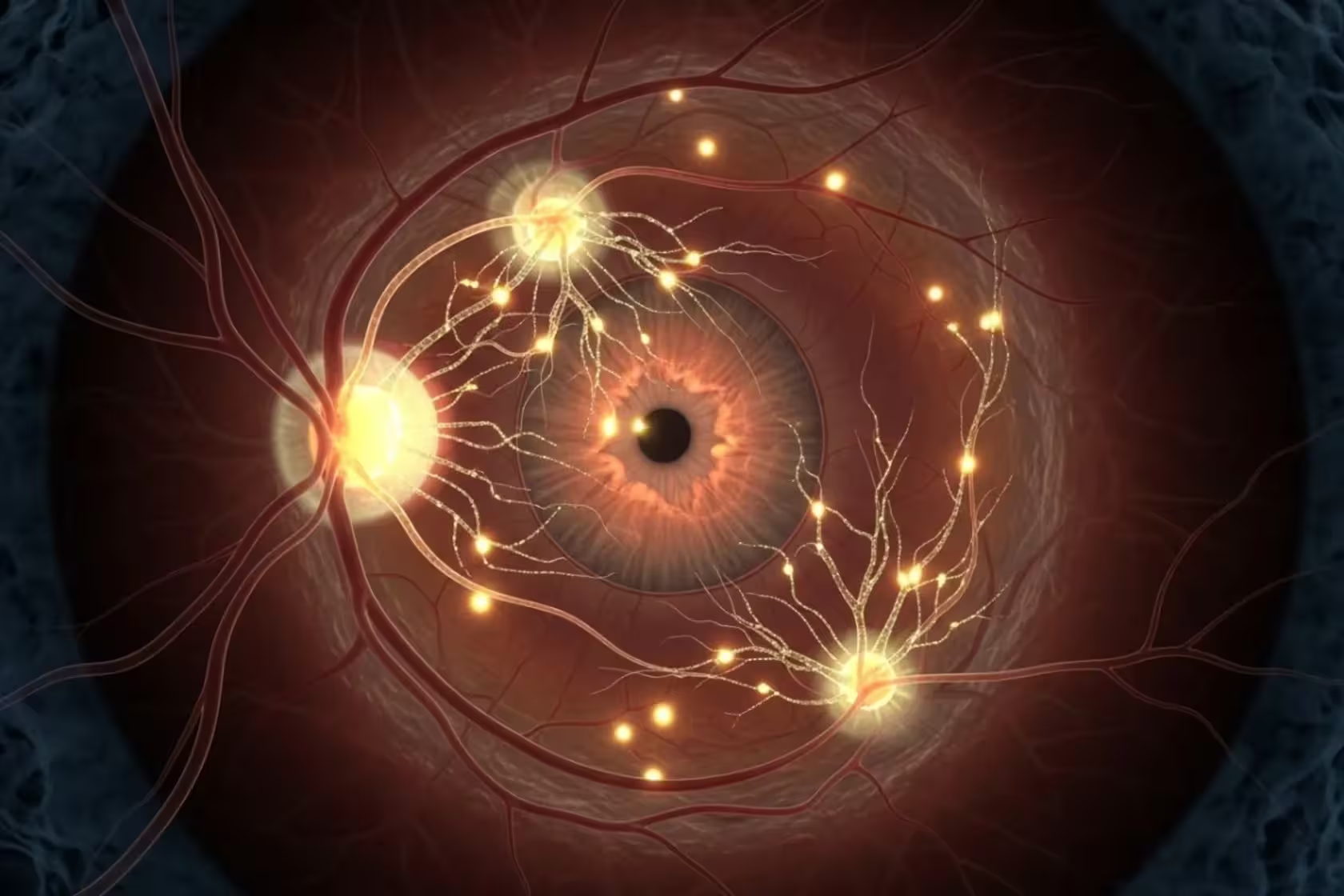
Technisch wird das Unternehmen drei regenerative Gene in das Netzhautgewebe einbringen, indem virale Vektoren eingesetzt werden. Solche viralen Vektoren sind in der Gentherapie gebräuchlich und umfassen typischerweise adeno-assoziierte Viren (AAV) oder verwandte Plattformen, die eine effiziente, aber relativ gezielte Gentransduktion ermöglichen. Die eingeführten Gene bleiben inaktiv, bis Patientinnen und Patienten eine vorgeschriebene Dosis des Antibiotikums Doxycyclin einnehmen, das als Sicherheitsschalter dient und die Genexpression auslöst. Dieses induzierbare System (ähnlich dem bekannten Tet-On/Tet-Off-Prinzip) soll das Risiko unkontrollierten Zellwachstums oder einer Onkogenese reduzieren.
Warum das Auge? Weil es relativ geschlossen ist. Der Bulbus bietet ein lokalisiertes, immun-privilegiertes Milieu und begrenzt die systemische Exposition, was frühe Tests am Menschen sicherer macht als ein sofortiger Versuch an einem ganzen Organ oder systemischen Ansatz. Die Augenhöhle erlaubt zudem eine genau überwachte, wiederholbare Beurteilung der Funktion — Messgrößen wie Sehschärfe, Gesichtsfeldtests, OCT (optische Kohärenztomographie), ERG (elektroretinographie) und die Messung der Nervenfaserschicht ermöglichen eine präzise Erfassung von Effekten und Nebenwirkungen.
Die Auswahl des Auges als Testorgan hat außerdem praktische Vorteile: die Möglichkeit gezielter Injektionen in den Glaskörper oder unter die Netzhaut, vergleichsweise niedrige systemische Dosen des Induktors (Doxycyclin) und etablierte Verfahren zur postoperativen Überwachung und Behandlung lokaler Entzündungen oder immunologischer Reaktionen. Zusammen machen diese Faktoren das Auge zu einem konservativen, aber technisch sinnvollen Startpunkt für eine translative Anwendung von zellulärer Reprogrammierung und retinaler Gentherapie.
Studiendesign, Sicherheitsfragen und frühere Ergebnisse
Die Erstkohorte wird rund ein Dutzend Patientinnen und Patienten mit fortgeschrittenem Glaukom umfassen. Forschende werden standardisierte Parameter der visuellen Funktion, den Zustand des Sehnervs und Anzeichen lokaler oder systemischer Immunaktivierung überwachen. Sicherheit steht im Mittelpunkt: Die virale Übertragung und die Verwendung von genteknologischen Kontrollmechanismen, die aus Bakterien oder Bakteriophagen adaptiert wurden, werfen berechtigte Fragen auf. Potenzielle Risiken, die genau beobachtet werden müssen, umfassen Immunreaktionen, Entzündungen, unerwünschte Genintegration, Off-Target-Effekte und theoretisch auch Tumorentstehung.
Das Studiendesign wird in mehreren Bereichen konservativ angelegt sein: dosiseskalierende Kohorten, klare Abbruchkriterien, engmaschige ophthalmologische Kontrollen und zusätzliche Systemkontrollen wie Laborwerte, Bildgebung und möglicherweise Biomarker in Blut oder Liquor zur Erkennung unerwünschter systemischer Effekte. Zu den primären Endpunkten gehören Sicherheitsparameter; sekundäre Endpunkte erfassen funktionelle Verbesserungen wie Zunahme der Sehschärfe, Stabilisierung des Gesichtsfelds und positive Veränderungen in OCT-Messungen der Nervenfaserschicht (RNFL) oder der Ganglienzell-Schicht.
Es gibt Tierversuchs-Vorläufer: 2020 berichtete David Sinclair, Mitgründer von Life Biosciences und Professor an der Harvard Medical School, über die Wiederherstellung von Sehfuktion bei Mäusen durch eine ähnliche Reprogrammierungsstrategie. Diese Ergebnisse führten zu erheblicher Aufmerksamkeit — sowohl positiver Erwartung als auch kritischer Prüfung — und waren ein wichtiger wissenschaftlicher Impuls für die weitere Entwicklung. Die Diskussionen rund um diesen Befund wurden zusätzlich befeuert, nachdem öffentliche Äußerungen von bekannten Persönlichkeiten (unter anderem auf dem Davos-Forum) die Idee einer möglichen Umkehr des Alterns als realistisch darstellten. Solche öffentlichen Kommentare lenkten Medien- und Investoreninteresse auf das Unternehmen und das Forschungsfeld der zellulären Reprogrammierung.
Sollte ER-100 in der klinischen Studie ein günstiges Sicherheitsprofil zeigen und Anzeichen einer Wiederherstellung nervaler Funktion im Auge liefern, wären die Implikationen weitreichend. Wissenschaftlerinnen, Kliniker und Investoren denken bereits an Anwendungen in anderen Geweben — möglicherweise in der Leber, im Herzmuskel oder sogar in komplexeren Organen. Ein solcher Transfer auf andere Organe würde jedoch zusätzliche Herausforderungen bedeuten: unterschiedliche Immunumgebungen, komplexere Zelltypenzusammensetzungen und höhere Risiken bei systemischer Applikation. Erfolg im Auge wäre jedoch ein entscheidender Proof-of-Concept und ein wertvoller Schritt hin zu breiter anwendbaren Strategien der altersbezogenen Medizin und regenerativen Gentherapie.
Ethische und regulatorische Landschaft
Die regulatorische Aufsicht wird streng sein. Ethikkommissionen (Institutional Review Boards) und die FDA werden detaillierte Sicherheitsüberwachung, transparente Berichterstattung und klare Pläne für das Risikomanagement verlangen. Klinische Prüfungen dieser Art stehen unter besonderer Beobachtung, weil sie das Potenzial haben, die Grenzen traditioneller Therapieansätze zu verschieben und grundlegende Fragen zur Anwendung von Technologien, die biologische Alterungsprozesse beeinflussen, aufzuwerfen.
Ethische Fragen sind vielfältig: Wer erhält Zugang zu solchen Therapien, wenn sie sich als wirksam erweisen? Wie wird ein bedeutender klinischer Nutzen gemessen — Veränderungen in Biomarkern, funktionelle Verbesserungen oder verlängerte gesundheitsbezogene Lebenszeit? Welche Langzeitnachsorge ist erforderlich, um spätauftretende Effekte wie unerwünschte Mutationen oder späte Immunkomplikationen zu erkennen? Außerdem existieren gesellschaftliche Debatten über Ungleichheit im Zugang zu potenziell lebensverlängernden Interventionen und über die Implikationen einer möglichen, ungleichen Verteilung medizinischer Fortschritte.
Regulatoren werden voraussichtlich strenge Anforderungen an Studiendesign, Wirksamkeitsnachweis und Langzeitbeobachtung stellen. Klinische Studien in frühen Phasen sind in erster Linie dazu da, Sicherheit zu testen; sie sind nicht darauf ausgelegt, eine allgemeine „Jungbrunnen“-Heilung zu demonstrieren. Forschende betonen deshalb Vorsicht und Transparenz gegenüber Teilnehmenden, medizinischer Gemeinschaft und Öffentlichkeit.
Expertinnen- und Experteneinschätzung
„Dies ist der natürliche nächste Schritt für eine Technologie, die sich im Labor weiterentwickelt hat“, sagt Dr. Laura Keane, eine Klinikerin im Bereich regenerative Medizin und Dozentin an einer großen Forschungsuniversität. „Die Wahl des Auges ist konservativ und klug. Sie erlaubt es Wissenschaftlern, biologische Verjüngung in einem begrenzten System zu evaluieren, in dem funktionelle Endpunkte — wie das Sehen — messbar und unmittelbar sind.“ Ihre Stimme bleibt ruhig, wenn sie ergänzt: „Wir müssen Immunevents und Off-Target-Aktivitäten genau beobachten, aber eine saubere Sicherheitsbilanz hier würde einen Wendepunkt für die translationale Altersforschung markieren.“
Weitere Expertinnen und Experten unterstreichen die Notwendigkeit unabhängiger Replikation der präklinischen Ergebnisse und betonen die Bedeutung standardisierter Messmethoden. Replication-Studien, offene Daten und Peer-Review werden entscheidend sein, um Vertrauen in die Ergebnisse aufzubauen und die Grundlage für weiterführende klinische Programme zu schaffen. Gleichzeitig ist die Kommunikation mit Patientengruppen und Fachgesellschaften wichtig, um Erwartungen realistisch zu halten und ethische Bedenken frühzeitig zu adressieren.
Es bleiben viele Unbekannte: Zeitpläne hängen davon ab, wie die ersten Patientinnen und Patienten reagieren, ob Nebenwirkungen auftreten und ob unabhängige Forscher die Ergebnisse reproduzieren können. Dennoch ist eines bereits offensichtlich: Die zelluläre Reprogrammierung hat sich vom Konzept und den Mausmodellen in Richtung humaner Testung bewegt. Dieser Übergang bringt eine Welle wissenschaftlicher, ethischer und kommerzieller Fragestellungen mit sich, die die Zukunft der Medizin und der Alternsforschung wesentlich prägen werden.
Für die klinische Gemeinschaft bedeutet dies auch, neue Protokolle für Sicherheitsüberwachung, Risikokommunikation und langfristige Nachverfolgung zu entwickeln. Für Patientinnen und Patienten sowie Interessierte ist es wichtig, fundierte Informationen zu erhalten: klare Aufklärung über Risiken und mögliche Nutzen, transparente Studienergebnisse und ein realistisches Bild von Zeitrahmen und Erfolgsaussichten. Nur so kann eine verantwortungsvolle Entwicklung solcher innovativen Therapien gewährleistet werden.
Schließlich eröffnet die Forschung rund um ER-100 und ähnliche Ansätze ein größeres Gespräch über die Ziele der Medizin im 21. Jahrhundert: Geht es primär um das Behandeln einzelner Krankheiten, oder streben wir zunehmend auch Therapien an, die altersbedingte Funktionsverluste auf zellulärer Ebene adressieren? Die Antwort wird sowohl wissenschaftliche Prioritäten als auch politische, regulatorische und gesellschaftliche Entscheidungen beeinflussen.
Quelle: smarti


Kommentar hinterlassen