8 Minuten
Eine kleine Tablette pro Tag kann Leben retten — und sie kann gelegentlich auch dazu führen, dass Muskeln brennen, verkrampfen oder versagen. Bei etwa einer von zehn Personen, die Statine zur Senkung des LDL-Cholesterins einnehmen, werden unerklärliche Schmerzen und tiefe Erschöpfung zu einem tatsächlichen Grund, die Therapie abzubrechen. Diese Muskelbeschwerden werden häufig als Statin-assoziierte Muskelsymptome (SAMS) bezeichnet und reichen von leichter Myalgie bis zu schweren Muskelschäden.
Forscher der Columbia University und der University of Rochester haben viele dieser Symptome auf einen einzelnen molekularen Fehltritt zurückgeführt: bestimmte Statine scheinen in Skelettmuskelzellen einen Kalziumkanal aufzuziehen. Bleibt dieses Tor einen Spalt offen, flutet Kalzium in die Fasern, Enzyme werden aktiviert, und eine Kaskade von Schäden kann folgen — angefangen bei chronischer Muskelzärtlichkeit und Schwäche bis hin zu seltenen, aber katastrophalen Syndromen wie der Rhabdomyolyse.
Wie ein Cholesterinmedikament mit einem Muskeltor kollidiert
Statine verrichten ihre Hauptarbeit in der Leber. Sie hemmen die HMG-CoA-Reduktase, ein Enzym, das für die Cholesterinbiosynthese essenziell ist. Durch diese Hemmung sinkt vor allem das Low-Density-Lipoprotein (LDL), ein maßgeblicher Faktor für Atherosklerose und Herzinfarkte. Allerdings ist die Biologie komplex: Moleküle, die für ein Zielprotein entworfen wurden, können auch andere Proteine beeinflussen — sogenannte Off-Target-Effekte.
Hier kommt RyR1 ins Spiel — der Ryanodin-Rezeptor 1 — ein pilzförmiger Kalziumkanal, der in das sarkoplasmatische Retikulum um Muskelfasern eingebettet ist. Man kann sich RyR1 wie den Türsteher in einem überfüllten Club vorstellen: Er steuert, wann Kalzium in die „Tanzfläche“ strömen darf und somit die Muskelkontraktion auslöst. Zu wenig Kalzium führt zu Bewegungsdefiziten; zu viel Kalzium kann das Gewebe schädigen und letztlich selbstzerstörerische Prozesse in Gang setzen.
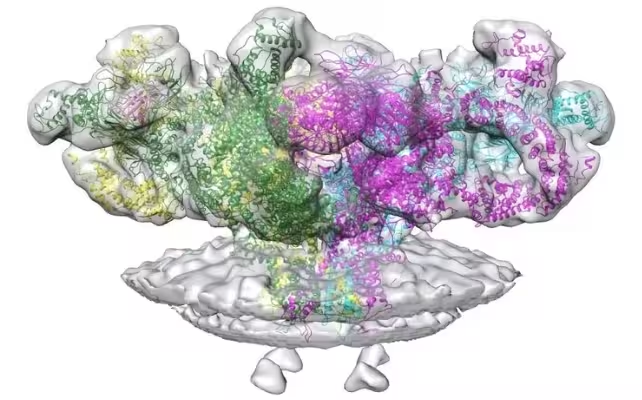
Struktur von RyR1, einem Proteinkanal, der Kalzium in Muskeln entweichen lassen kann.
Mit Kryo-Elektronenmikroskopie (cryo-EM) an Mausgewebe konnten die Forscher Statinmoleküle auf RyR1 positioniert sehen und nachvollziehen, wie sich die Form des Kanals dadurch verändert. Cryo-EM friert Proben ein und kartiert die Elektronenstreuung, um annähernd atomare Strukturen sichtbar zu machen; in diesem Fall zeigte die Methode, wie Simvastatin und verwandte Verbindungen einen offen stabilisierten Zustand des Kanals begünstigen können, der einen kontinuierlichen Kalziumleckstrom in Muskelzellen erlaubt.
Ein anhaltender Kalziumfluss erklärt viele der häufig berichteten Beschwerden: persistierende Muskelschmerzen (Myalgien), Druckschmerzhaftigkeit, Krämpfe und ein anhaltendes Gefühl von Schwäche. Kalziumaktivierung schaltet proteolytische Enzyme und mitochondriale Stresswege ein, die zu Energiedefiziten in Muskelfasern führen und so die Leistungsfähigkeit stark beeinträchtigen können.
Bei Personen mit bestimmten genetischen Varianten von RyR1 erhöhen sich die Risiken weiter. Diese Varianten machen die Kanäle anfälliger für übermäßiges Öffnen. Betroffene Patienten sind bekannt dafür, unter Umständen eine maligne Hyperthermie zu entwickeln, wenn sie bestimmten auslösenden Medikamenten (wie bestimmten Anästhetika) ausgesetzt werden, oder eine Zwerchfellschwäche zu erleben, die die Atmung beeinträchtigen kann. Solche genetischen Prädispositionen erklären, warum nicht alle Statin-Nutzer gleichermaßen betroffen sind.
Es gibt auch seltenere, gravierendere Folgen: Die Rhabdomyolyse — ein Zustand, bei dem Muskelfasern aufbrechen und toxische Inhalte in den Blutkreislauf freigesetzt werden — kann infolge schwerer RyR1-vermittelter Schäden auftreten und akut zum Nierenversagen führen. Ebenfalls beschrieben ist eine autoimmune nekrotisierende Myositis, bei der das Immunsystem Muskelzellen angreift und zerstört; dieser Mechanismus scheint jedoch getrennt von direktem RyR1-Leck zu sein und deutet auf multiple mögliche Ursachen für statinassoziierte Muskelschäden hin.
Auswirkungen, Behandlungsmöglichkeiten und nächste Schritte
Die Entdeckung erklärt nicht jede Form von Statin-assoziierten Muskelsymptomen (SAMS), bietet aber einen konkreten pathophysiologischen Weg, der getestet und gegebenenfalls therapeutisch angegangen werden kann. Für Kliniker bedeutet die Erkenntnis, dass eine genetische Untersuchung auf RyR1-Varianten in Kombination mit einer differenzierten klinischen Beurteilung der Muskelbeschwerden helfen könnte, echte Statinintoleranz von unzusammenhängenden Schmerzen zu unterscheiden.
Zwei therapeutische Strategien erscheinen besonders vielversprechend. Erstens die medikamentöse Chemie: Statine so umzudesignen, dass sie weiterhin die Leber-spezifische Hemmung der Cholesterinproduktion bewirken, aber ihre Affinität zu RyR1 verlieren. Solche Leber-gezielten Formulierungen oder neu strukturierte Wirkstoffe könnten das Nutzen-Risiko-Profil verbessern. Zweitens die pharmakologische Rettung des Kanals: In Tiermodellen, die gegenüber Simvastatin intolerant gemacht wurden, stellte eine experimentelle Wirkstoffklasse namens Rycals das geschlossene Kanalverhalten wieder her und verhinderte Muskelkraftverlust.
Rycals sind kleine Moleküle, die die Stabilität des RyR1-Kanals in seiner geschlossenen Konformation fördern und so pathologisches Kalziumleck reduzieren. In präklinischen Studien führten Rycals zu einer Normalisierung der Kalziumhomöostase und schützten Muskelkraft und -integrität. Ob und wie sich diese Ergebnisse auf den Menschen übertragen lassen, ist Gegenstand laufender Forschung und erfordert sorgfältig geplante klinische Studien.
Für die Versorgungspraxis ergeben sich mehrere umsetzbare Empfehlungen, gestützt auf die aktuellen Erkenntnisse:
- Sorgfältige Anamnese: Erfragen des zeitlichen Zusammenhangs zwischen Statineinleitung und Beginn der Muskelsymptome, vorherige Reaktionen auf Medikamente (z. B. Anästhetika) und familiäre Erkrankungen wie maligne Hyperthermie.
- Laboruntersuchungen: Bestimmung von Kreatinkinase (CK) bei Verdacht auf Myopathie, regelmäßiges Monitoring bei Symptomen und Abklärung bei erhöhter CK mit Wiederholung und ergänzenden Tests.
- Genetisches Screening: Bei wiederholten, schwerwiegenden SAMS oder familiärer Vorgeschichte einer RyR1-Erkrankung kann eine genetische Testung auf RyR1-Varianten ratsam sein, um Risikopersonen zu identifizieren und präventive Maßnahmen zu planen.
- Therapeutische Anpassungen: Dosisanpassung, Wechsel auf verschiedene Statin-Präparate mit geringerem RyR1-Affinitätsprofil, intermittierende Therapie (so genanntes „statin holiday“) oder alternative lipidsenkende Strategien wie PCSK9-Inhibitoren oder Ezetimib in Erwägung ziehen, wenn Symptome persistieren.
Andrew Marks, der Kardiologe der Columbia University, der die Studie leitete, fasst die klinische Dringlichkeit zusammen: „Ich habe Patienten gesehen, denen Statine verschrieben wurden und die die Einnahme wegen der Nebenwirkungen ablehnten. Das ist der häufigste Grund, warum Patienten die Statintherapie beenden — ein reales Problem, das einer Lösung bedarf.“ Die Aussage unterstreicht, dass Nebenwirkungen nicht nur individuell belastend sind, sondern auch bevölkerungsbezogene Konsequenzen haben können.
Die öffentlichen Gesundheitsfolgen sind relevant: Schätzungsweise 40 Millionen Erwachsene in den Vereinigten Staaten nehmen Statine. Wenn auch nur ein kleiner Teil dieser Gruppe unter klinisch bedeutsamen SAMS leidet, gehen Gelegenheiten verloren, Herzinfarkte und Schlaganfälle zu verhindern, während Betroffene vermeidbare Schmerzen und Einschränkungen ertragen müssen. Eine verbesserte Diagnostik und sicherere Therapien könnten diese Lücke schließen.
Fachliche Einschätzung
„Diese Arbeit liefert uns ein testbares Ziel“, sagt Dr. Elena Morales, eine Muskelphysiologin an einem großen medizinischen Zentrum, die nicht an der Studie beteiligt war. „Aus translationaler Sicht können wir Medikamente frühzeitig auf RyR1-Bindung screenen, und Kliniker können die Funktion von RyR1 in Betracht ziehen, wenn Statinmyopathie auftritt. Es ist eine Brücke von struktureller Chemie zu Entscheidungen am Krankenbett.“
Aus wissenschaftlicher Perspektive verwandelt die Forschung ein langjähriges Rätsel in einen greifbaren Mechanismus. Das eröffnet Wege zu sichereren Cholesterintherapien und gezielten Behandlungen, die den Nutzen von Statinen für Patienten, die davon profitieren, erhalten könnten. Insbesondere die Kombination aus strukturbasierter Arzneimittelentwicklung, genetischer Risikostratifizierung und neuen Kanal-stabilisierenden Wirkstoffen kann das Feld voranbringen.
Welche Richtung Kliniker und Arzneimittelentwickler einschlagen werden, hängt von weiteren Studien ab: von reproduzierenden experimentellen Daten, toxikologischen Bewertungen, Wirksamkeitsnachweisen in klinischen Studien und schließlich von regulatorischen Entscheidungen. Solange bleiben wichtige Fragen offen, etwa welche Statine besonders stark RyR1 beeinflussen, welche genetischen Varianten das höchste Risiko tragen und wie neue Medikamente in verschiedenen Patientengruppen abschneiden.
Praktisch lässt sich sagen: Patienten mit Muskelbeschwerden unter Statinen sollten dies offen mit ihren behandelnden Ärzten besprechen, ohne die Therapie eigenmächtig abzusetzen. Ein strukturierter Ansatz — Anamnese, Laborwerte, ggf. genetische Untersuchung und therapeutische Anpassungen — kann helfen, unnötige Risiken zu vermeiden und die kardiovaskulären Vorteile der Statine bestmöglich zu nutzen.
Die Entdeckung stellt einen wichtigen Schritt dar, aber sie ist nur ein Teil des größeren Puzzles: Verstehen, wie Medikamente in komplexen molekularen Netzwerken wirken, ist entscheidend für die Entwicklung personalisierter und sicherer Therapien. In diesem Zusammenhang ist RyR1 ein vielversprechender Kandidat, um Statin-Nebenwirkungen besser zu erklären und künftig zu verhindern.
Welche Wege Forscher und Entwickler letztlich wählen werden — Modifikation existierender Statine, Entwicklung neuer Leber-zielgerichteter Wirkstoffe, oder die Einführung Kanal-stabilisierender Begleitmedikationen wie Rycals — bleibt abzuwarten. Zeit, zusätzliche experimentelle Studien und sorgfältig geplante klinische Prüfungen werden zeigen, welche Ansätze praktikabel und sicher sind.
Bis dahin bieten die aktuellen Erkenntnisse Orientierung für Ärzte, Forscher und Patienten gleichermaßen: Ein klarer molekularer Mechanismus, praktische Vorschläge für Diagnostik und Management, und konkrete klinische Forschungsfragen für die kommenden Jahre.
Quelle: sciencealert

Kommentar hinterlassen