6 Minuten
Neuer neuronaler Schaltkreis verbindet Schlaf und Reparatur
Im Schlaf schaltet der Körper in einen Reparaturmodus: Wachstumshormon (GH) wird freigesetzt, um Muskeln und Knochen wieder aufzubauen und Stoffwechselprozesse zu regulieren. Bis vor Kurzem bestimmten Wissenschaftler GH-Konzentrationen anhand von Blutproben, die während des Schlafs entnommen wurden. Welche neuronalen Schaltkreise jedoch die Freisetzung auslösen und modulieren, blieb weitgehend ungeklärt. Ein Forscherteam unter Leitung der University of California, Berkeley, hat nun die neuronale Aktivität bei Mäusen über mehrere Schlaf‑Wach‑Zyklen kontinuierlich aufgezeichnet und einen Schaltkreis identifiziert, der die zeitliche Steuerung der GH‑Freisetzung in REM‑ und Non‑REM‑Schlaf unterschiedlich regelt.
Wissenschaftlicher Hintergrund und experimenteller Ansatz
Die Arbeitsgruppe kombinierte in vivo‑Aufzeichnungen der neuronalen Aktivität mit hormonellen Messungen, um die Korrelation spezifischer neuronaler Populationen mit GH‑Pulsen zu kartieren. Dazu verwendeten die Forscher kontinuierliche Elektrophysiologie, Fiber‑Photometry sowie gezielte opto‑ und chemogenetische Manipulationen, ergänzt durch hochsensible immunoassay‑Messungen für Wachstumshormon. Indem sie Aktivitätsmuster im Hypothalamus und in Gehirnknoten verfolgten, die den Erregungszustand beeinflussen, beobachteten die Wissenschaftler unterschiedliche Mechanismen der GH‑Regulation in der rapid eye movement (REM)‑Phase gegenüber dem Non‑REM‑Schlaf. Die Arbeit, publiziert in Cell im Jahr 2025, baut auf langjährigen Befunden auf, dass Schlafqualität direkt die endokrine Funktion und die metabolische Gesundheit beeinflusst.
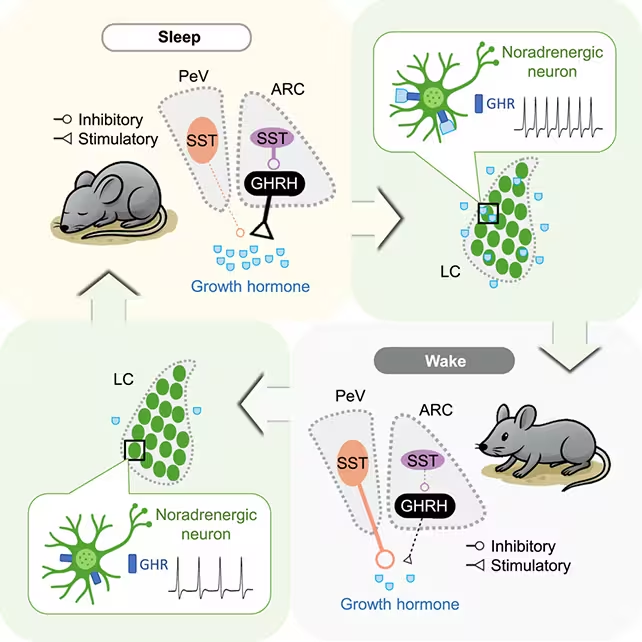
Die Forschenden analysierten die Freisetzung von Wachstumshormon bei Mäusen während Schlaf‑/Wachzyklen.
Wichtige technische Details
- Kontinuierliche elektrophysiologische und optogenetische Aufzeichnungen ermöglichten eine präzise zeitliche Zuordnung zwischen neuronaler Feuerrate und GH‑Pulsen.
- Die Studie unterschied Neuronen, die die GH‑Freisetzung fördern, von solchen, die sie hemmen, und zeigte dynamische Veränderungen dieser Einflüsse über verschiedene Schlafstadien hinweg.
- Wesentlich ist die Erkenntnis, dass die Locus coeruleus—ein Hirnstammkern, der zentral für Wachheit und noradrenerge Modulation ist—eine Rückkopplungsschleife mit den GH‑regulierenden Schaltkreisen bildet.
Hauptergebnisse und physiologische Implikationen
Wachstumshormon stieg sowohl während REM‑ als auch während Non‑REM‑Schlafphasen an, doch die treibenden und hemmenden neuronalem Komponenten, die diese Freisetzung steuern, veränderten ihr relatives Gewicht je nach Schlafstadium. Konkret fanden die Forschenden, dass hypothalamische Neuronen, die GHRH (Growth Hormone‑Releasing Hormone) exprimieren, während bestimmter Non‑REM‑Phasen besonders aktiv waren und GH‑Pulse auslösten. Im Gegensatz dazu trugen in REM‑Phasen andere Zelltypen—einschließlich somatostatin‑expressierender Neurone und noradrenerger Eingänge aus dem Locus coeruleus—zur phasenabhängigen Modulation bei. Die Entdeckung einer reziproken Schleife mit dem Locus coeruleus deutet auf ein fein austariertes System hin: Schlaf fördert die GH‑Freisetzung, und GH wiederum beeinflusst über Rückkopplungsmechanismen den Erregungszustand.
Wird dieses Gleichgewicht gestört—etwa durch chronischen Schlafmangel, fragmentierten Schlaf oder eine Fehlfunktion der beteiligten Schaltkreise—können metabolische Konsequenzen folgen. Wachstumshormon ist nicht nur für Wachstum und Gewebereparatur essenziell; es moduliert auch Glukose‑ und Lipidstoffwechsel. Eine unzureichende oder zeitlich verschobene GH‑Freisetzung, wie sie bei fragmentiertem Schlaf auftreten kann, ist mit einem erhöhten Risiko für Adipositas, Insulinresistenz, Typ‑2‑Diabetes und kardiovaskuläre Erkrankungen assoziiert. Die neuen Erkenntnisse auf Schaltkreisebene verbinden somit grundlegende Aspekte der Schlafneurobiologie mit der endokrinen Regulation und langfristiger Gesundheit.
Aus physiologischer Sicht liefern die Ergebnisse Einblicke in die zeitliche Architektur der Hypothalamus‑Hypophysen‑Achse: Die pulsatile Natur der GH‑Sekretion ist entscheidend für die Signalinterpretation in peripheren Geweben, etwa über IGF‑1‑Produktion in der Leber. Änderungen in Pulsfrequenz oder -amplitude können dadurch weitreichende Wirkungen haben. Die Studie verwendet quantitative Analysen, darunter Kreuzkorrelationsmatrizen zwischen neuronaler Aktivität und GH‑Pulszeitpunkten sowie kausale Netzwerkmodelle, um die Richtungsbeziehung zwischen Hirnstamminsulten und hypothalamischen Treibern zu demonstrieren.
Mögliche klinische und Forschungsanwendungen
Das Verständnis der neuronalen Schaltkreise, die die GH‑Freisetzung zeitlich steuern, eröffnet neue therapeutische Möglichkeiten. Zielgerichtete Pharmakologie oder neuromodulatorische Interventionen könnten normale GH‑Rhythmen bei Menschen mit Schlafstörungen oder metabolischen Erkrankungen wiederherstellen. Die Forschenden schlagen vor, dass der Locus coeruleus ein vielversprechendes Ziel sein könnte: Eine Reduktion seiner Übererregbarkeit könnte die GH‑Timing‑Balance wiederherstellen und die Schlafkontinuität verbessern.
Konkrete Implementierungsstrategien könnten Folgendes umfassen:
- Pharmakologische Modulatoren der noradrenergen Transmission, die spezifisch die Aktivität des Locus coeruleus dämpfen, ohne systemische Nebenwirkungen zu verursachen.
- Nichtinvasive neuromodulatorische Techniken wie transkranielle Wechselstromstimulation (tACS) oder vagale Stimulation, abgestimmt auf Schlafstadien zur Modulation hypothalamischer Aktivität.
- Zelltypspezifische Gentherapieansätze in präklinischen Modellen (z. B. DREADDs), um die Rolle definierter neuronaler Populationen experimentell zu testen.
Die Übertragung der Mausdaten auf den Menschen erfordert weitere Validierung, doch die konservierte Rolle hypothalamischer und hirnstammnaher Strukturen in der Schlaf‑ und Hormonsteuerung bietet einen plausiblen Pfad. Klinische Studien könnten Polysomnographie, serielle Blutentnahmen für GH und IGF‑1, sowie funktionelle Bildgebung (fMRI/PET) kombinieren, um die Relevanz der entdeckten Schaltkreise für die menschliche Physiologie zu prüfen. Darüber hinaus könnte untersucht werden, ob eine veränderte GH‑Schlaf‑Rückkopplung zu neurodegenerativen Erkrankungen wie Alzheimer beiträgt, bei denen Schlafstörungen und gestörte metabolische Regulation häufig sind.
Expertensicht
„Diese Aufzeichnungen geben uns einen mechanistischen Einblick, wie Übergänge zwischen Schlafstadien hormonelle Pulse steuern“, sagt Dr. Elena Martinez, eine auf Schlaf spezialisierte Neurowissenschaftlerin, die nicht an der Studie beteiligt war. „Wenn ähnliche Schaltkreise beim Menschen existieren, bieten sich klare Möglichkeiten, Behandlungen zu verfeinern, die sowohl die Schlafqualität als auch die metabolische Gesundheit adressieren—zwei miteinander verknüpfte Probleme in modernen Gesellschaften.“
Dr. Martinez ergänzt, dass neuere Werkzeuge wie zelltypspezifische Genmodulation und nichtinvasive Hirnstimulation genutzt werden könnten, um zu testen, ob die Anpassung der Locus coeruleus‑Aktivität normale Wachstumshormonrhythmen wiederherstellt, ohne größere Nebenwirkungen zu verursachen. Sie betont außerdem die Notwendigkeit strenger Sicherheitsstudien, da eine unspezifische Unterdrückung noradrenerger Systeme kognitive oder kardiovaskuläre Effekte haben kann.
Limitationen und nächste Schritte
Die Studie legt eine solide Grundlage, beweist jedoch nicht, dass die Schaltkreisdynamiken identisch beim Menschen ablaufen. Langfristige humanexperimentelle Studien, die Polysomnografie, serielle Hormonmessungen und bildgebende oder neuromodulatorische Methoden kombinieren, sind notwendig, um Übertragbarkeit und klinische Relevanz zu klären. Außerdem müssen Forschende untersuchen, wie Alterungsprozesse, Adipositas und neurodegenerative Veränderungen diesen Schlaf‑GH‑Kreislauf modifizieren.
Weitere offene Fragen umfassen:
- Welche molekularen Mechanismen innerhalb hypothalamischer Neurone bestimmen die Phasenspezifität der GH‑Freisetzung (z. B. Rezeptorprofile, Ionenkanalexpression)?
- Wie interagieren periphere Signale—Leptin, Insulin, Glukokortikoide—mit dem zentralen Schaltkreis zur Feinabstimmung von GH‑Pulses in unterschiedlichen metabolischen Zuständen?
- Welche langfristigen Effekte haben chronische Störungen dieses Kreislaufs auf Gewebehomöostase, altersbedingte Degeneration und kardiometabolische Risiken?
Methodisch wäre es wertvoll, die Auflösung der Hormonmessungen weiter zu erhöhen (z. B. Mikro‑Dialyse kombiniert mit Echtzeitbiosensoren) und multimodale Aufnahmen (optogenetische Stimulation plus simultane Calcium‑Imaging und GH‑Assays) zu nutzen, um direkte Kausalzusammenhänge mit noch größerer Präzision herzustellen.
Fazit
Die Studie kartiert einen neuronalen Schaltkreis, der die zeitliche Freisetzung von Wachstumshormon über verschiedene Schlafstadien steuert, und identifiziert den Locus coeruleus als Feedbackknoten, der endokrine Signale mit dem Erregungsniveau verknüpft. Indem sie aufzeigt, wie REM‑ und Non‑REM‑Schlaf unterschiedliche Förderer und Hemmer der GH‑Freisetzung aktivieren, überbrückt die Arbeit die Bereiche Schlafphysiologie und metabolische Gesundheit. Weiterführende Untersuchungen könnten zu gezielten Therapien für Schlafstörungen, metabolische Erkrankungen und Zustände führen, die mit gestörtem Schlaf und Hormonhaushalt verbunden sind. Insgesamt stärkt die Studie das wachsende Verständnis, dass Schlaf kein passiver Ruhezustand ist, sondern ein dynamischer Regulator zentraler physiologischer Achsen—ein Aspekt, der sowohl für Grundlagenforschung als auch für klinische Anwendungen hohe Relevanz besitzt.
Quelle: sciencealert


Kommentar hinterlassen