8 Minuten
Stellen Sie sich eine kontraintuitive Wendung in der Krebsbiologie vor: sehr alte Tiere zeigen weniger Krebs, nicht mehr. Neue Forschungsergebnisse der Stanford University zeigen, dass Mäuse im sehr hohen Alter weniger und kleinere Lungentumoren entwickeln als jüngere Tiere mit denselben krebserregenden Mutationen. Die Resultate stellen die einfache Annahme in Frage, dass das Krebsrisiko unaufhörlich mit der Zeit steigt, und deuten auf altersbedingte Veränderungen hin, die paradox erscheinen mögen, aber das Tumorwachstum unterdrücken können.
Die Forscher hinter der Studie erklären, dass die Befunde helfen, ein lange beobachtetes Muster beim Menschen zu erklären: Die Inzidenz von Krebs steigt bis ins späte Erwachsenenalter, flacht aber bei Hochbetagten häufig ab oder nimmt sogar ab. Das Stanford-Team nutzte genetisch veränderte Mausmodelle und sorgfältige molekulare Analysen, um zu untersuchen, welche Aspekte des Alterns das Krebswachstum einschränken könnten und wie sich bestimmte Mutationen im Verlauf des Lebens unterschiedlich verhalten.
Ein überraschendes Muster bei alten Mäusen: weniger, kleinere Lungentumoren
Die Gruppe aus Stanford verglich die Tumorentstehung in zwei Alterskohorten von Labormäusen: "jung" (vier bis sechs Monate alt) und sehr alt (20 bis 21 Monate, was ungefähr dem menschlichen Äquivalent von sehr hohem Alter entspricht). Um Lungenkrebs auszulösen, verwendeten die Forscher ein gezieltes, eingeatmetes Gen-Transfersystem, das Tumoren fluoreszent markiert und so präzise Bildgebung und Messungen erlaubt.
Nach der Krebsinduktion und einer Beobachtungszeit von 15 Wochen zeigte sich ein deutlicher Unterschied. Junge Mäuse entwickelten ungefähr das Dreifache an Tumorlast, gemessen am Lungengewicht und der fluoreszenten Fläche, und sie wiesen auch etwa dreimal so viele einzelne Tumoren auf. Die Tumoren bei jungen Tieren waren zudem größer und wuchsen schneller. Kurz gesagt: Nach allen verwendeten Kennzahlen zeigten jüngere Mäuse eine aggressivere Erkrankung.
Diese Ergebnisse spiegeln epidemiologische Beobachtungen beim Menschen wider: Krebserkrankungen nehmen bis ins mittlere und späte Leben zu, sinken aber bei Menschen ab etwa 85 Jahren oft oder erreichen ein Plateau. Bislang war umstritten, ob dieser Rückgang auf weniger Untersuchungen und damit Unterdiagnosen bei Hochbetagten zurückzuführen ist oder ob biologische Faktoren die Tumorentstehung tatsächlich verringern. Die neuen Mausdaten deuten auf einen echten, altersgebundenen biologischen Effekt hin, der die Tumorinitiation und das Wachstum hemmt.
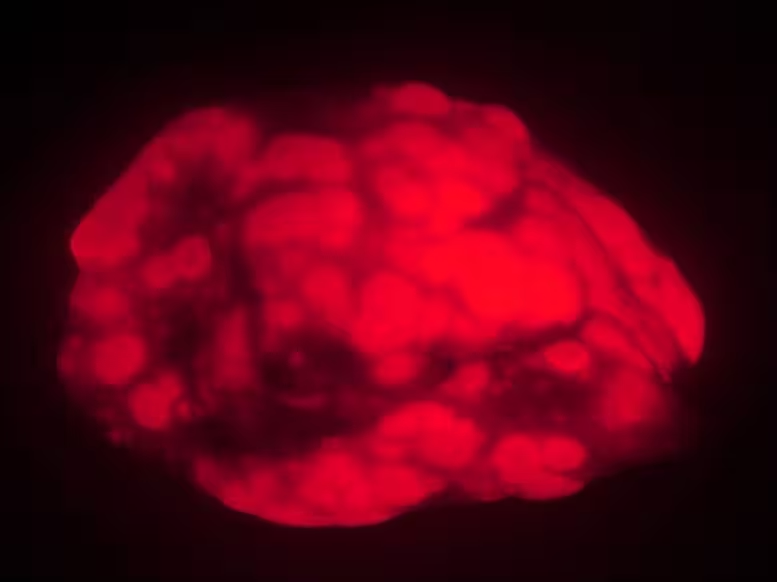
Alte Mäuse entwickeln in diesem Krebsmodell weniger und kleinere Lungentumoren (rot) als jüngere Tiere. Die Befunde legen nahe, dass der Alterungsprozess bei sehr alten Tieren oder Menschen die Krebsentstehung dämpfen kann.
Welche altersbedingten Veränderungen könnten Krebs blockieren?
Auf den ersten Blick scheint Altern das Krebsrisiko zu begünstigen: Jede Zellteilung birgt das Risiko von DNA-Schäden, und viele Alterungsmerkmale — genomische Instabilität, veränderte DNA-Methylierungsmuster und Umlagerungen der mitochondrialen DNA — scheinen fruchtbarer Boden für maligne Transformation zu sein. Während eines großen Teils des Erwachsenenalters korreliert diese Anhäufung von Schäden tatsächlich mit einer steigenden Krebsinzidenz.
Dennoch argumentiert das Stanford-Team, dass einige altersassoziierte Veränderungen für Neoplasien feindselig werden können. Die Studie prüfte, wie die Inaktivierung eines Panels von 25 bekannten Tumorsuppressorgenen die Tumorentstehung in jungen versus alten Mäusen beeinflusste. Tumorsuppressoren sind Gene, deren Proteinprodukte normalerweise unkontrolliertes Zellwachstum hemmen; gehen diese Gene verloren oder werden sie deaktiviert, entstehen Tumore leichter.
Zwar führte das Abschalten vieler Tumorsuppressoren in beiden Altersgruppen zu einem Anstieg der Tumoren, doch war das Ausmaß dieses Effekts in fast allen Fällen bei jungen Mäusen größer. Anders gesagt: Derselbe genetische Schlag führte in der Jugend zu einem schwerwiegenderen Ergebnis. Ein Gen stach besonders hervor: PTEN. Die Inaktivierung von PTEN hatte einen deutlich stärkeren tumorfördernden Effekt in jungen Tieren als in alten, was nahelegt, dass der biologische Kontext des gealterten Gewebes die Funktionsweise eines wichtigen Krebswegs verändert.
Um Mechanismen zu untersuchen, sequenzierten die Forschenden Expressionsmuster von Genen in Krebszellen aus alten und jungen Mäusen sowie in Tumoren mit und ohne PTEN. Unerwartet war, dass selbst schnell teilende Krebszellen aus alten Tieren molekulare Signaturen des Alterns behielten. Diese altersassoziierten Transkriptionsmuster wurden abgeschwächt, wenn PTEN inaktiviert war, und PTEN-defiziente Krebszellen in alten Mäusen ähnelten dem Genexpressionsprofil junger Tumoren — ein faszinierendes Indiz dafür, dass einige Altersmerkmale verschwinden können, wenn zentrale Signalwege gestört werden.
Eine kurze Anmerkung zum technischen Kontext
Die Studie nutzte fluoreszente Markierung zur Quantifizierung der Tumorlast, kontrollierte Instrumente zur Geninaktivierung, um die Effekte von Tumorsuppressoren zu testen, und RNA-Profiling, um zu prüfen, wie Alterungssignaturen in transformierten Zellen persistieren. Das experimentelle Design erforderte einen langen Zeitrahmen — die Forscher warteten fast zwei Jahre, bis die Mäuse hohes Alter erreichten, was verdeutlicht, warum Altersforschung experimentell anspruchsvoll und zeitintensiv ist.
Warum die Ergebnisse für Krebsforschung und Behandlung wichtig sind
Die praktischen Schlussfolgerungen sind erheblich. Erstens erfassen häufig verwendete Krebsmodelle — die oft auf jungen erwachsenen Mäusen beruhen — möglicherweise nicht die wichtigen altersabhängigen biologischen Veränderungen. Das kann vorklinische Tests neuer zielgerichteter Therapien verzerren, denn diese Wirkstoffe könnten in älteren Geweben anders wirken, in denen sich die molekulare Landschaft verändert hat.
Zweitens legt die Studie nahe, dass Altern nicht durchgängig tumorfördernd ist. Bestimmte Aspekte der gealterten Mikro-Umgebung oder zellintrinsische Veränderungen können die Tumorinitiierung behindern oder das Fortschreiten verlangsamen. Das Verständnis dieser schützenden Mechanismen könnte neuartige Therapiestrategien hervorbringen: Wenn Altern Gewebe so umprogrammiert, dass es gegen Krebs resistenter wird, lässt sich diese "Verdrahtung" eventuell pharmakologisch nachahmen?
Drittens warnt der unterschiedliche Effekt der PTEN-Inaktivierung davor, dass bestimmte Treibermutationen und darauf ausgerichtete Behandlungen je nach Patientenalter unterschiedlich wirken können. Präzisionsonkologie koppelt Medikamente üblicherweise an Mutationsprofile — doch der altersbedingte Kontext kann die Wirkung dieser Mutationen modulieren und damit die Wirksamkeit der Therapien verändern.
Monte Winslow, außerordentlicher Professor für Genetik und Pathologie und einer der leitenden Autoren der Studie, betont, dass die Ergebnisse ein Umdenken bei der Modellauswahl für translationale Forschung verlangen. Dmitri Petrov, ein weiterer Senior-Autor, sieht den Befund noch weiter gefasst: Altern könne unterschätzte Vorteile mit sich bringen, die Wissenschaftler nutzen lernen könnten.
Expert Insight
Dr. Lena Morales, eine fiktive Forscherin im Bereich Geroscience (University Center for Aging Biology), kommentiert: "Diese Daten unterstreichen, dass Altern kein linearer, einheitlicher Abbau ist. Manche zellulären Signalwege, die sich mit dem Alter verändern, können Mikro-Umgebungen schaffen, die weniger permissiv für Tumorinitiation sind. Das heißt nicht, dass Altern insgesamt schützend wirkt — ältere Menschen sind oft gebrechlicher und leiden an weiteren Krankheiten — aber es öffnet eine wertvolle Forschungsrichtung: Welche schützenden Eigenschaften gealterter Gewebe können wir isolieren und in Therapien übersetzen?"
Ihre Einschätzung macht ein zentrales Forschungsproblem deutlich: nützliche versus schädliche altersassoziierte Veränderungen zu trennen und dann zu entscheiden, welche davon pharmakologisch sicher nachgebildet werden können, ohne neue Risiken zu schaffen.
Breitere Implikationen und nächste Schritte
- Modellentwicklung: Labore sollten gealterte Tiere in präklinische Pipelines integrieren, um altersabhängige Effekte auf Tumorbiologie und Therapieansprechen zu erfassen. Dies betrifft sowohl Standardtests für Wirkstoffkandidaten als auch die Validierung neuer Targeting-Strategien.
- Mechanistische Forschung: Wissenschaftler müssen herausfinden, welche Alters-Signaturen — epigenetische Markierungen, metabolische Umstellungen, immunologische Umstrukturierungen — die Tumorsuppression in alten Geweben antreiben. Solche Mechanismen könnten von veränderten Makrophagen-Aktivitäten über Cytokin-Milieus bis zu Wachstumsfaktor-Rezeptoren reichen.
- Klinische Translation: Werden altersverknüpfte Schutzmechanismen validiert, könnten sie als Vorlage für Wirkstoffe dienen, die diesen Zustand in jüngeren Patienten nachahmen oder die Therapie älterer Patienten so anpassen, dass Alterungsbedingte Unterschiede berücksichtigt werden. Das erfordert sorgfältige Studien zur Sicherheit und Wirksamkeit sowie zur pharmakokinetischen Anpassung bei älteren Patienten.
Die Studie, geleitet von Erstautorin Emily Shuldiner und veröffentlicht am 4. November in Nature Aging, stellt eine der ersten kontrollierten Demonstrationen dar, dass Altern die Tumorinitiation und das Wachstum in einem Säugetiermodell aktiv unterdrücken kann. Sie zeigt außerdem, dass altersassoziierte molekulare Signaturen in sich teilenden Krebszellen persistieren können, was Annahmen darüber, wie "junge" Krebszellen auf Transkriptom-Ebene aussehen sollten, verkompliziert.
Insgesamt rückt die Arbeit das Altern in der Krebsforschung in ein neues Licht: Anstatt Alter allein als Akkumulation von Schäden zu betrachten, sollten Wissenschaftler es als komplexe, systemische Verschiebung sehen, die manchmal neue Grenzen für maligne Zellen setzt. Dieser Gedanke kann zu innovativen Strategien für Prävention und Therapie führen, die sich an der Biologie unterschiedlicher Altersgruppen orientieren und die Präzisionsonkologie um einen altersbezogenen Kontext erweitern.
Für die klinische Forschung bedeutet das: Studien sollten die Altersstruktur der Patientenkohorten bewusster berücksichtigen, Biomarker für altersabhängige Gewebezustände entwickeln und bei der Wirkstoffentwicklung sowohl junge als auch alte biologische Systeme testen. Nur so lassen sich sichere, effektive und altersadäquate Therapien entwickeln, die sowohl die molekularen Treiber als auch die altersspezifischen Gegenkräfte berücksichtigen.
Quelle: scitechdaily

Kommentar hinterlassen