8 Minuten
Forscher in Spanien haben eine kleine Gruppe von Neuronen in der Amygdala identifiziert, die Angst‑ähnliches Verhalten bei Mäusen auslösen kann — und die sich durch gezielte Ausbalancierung wieder umkehren lässt. Indem das Team das Gen GRIK4 und sein Proteinprodukt GluK4 adressierte, wurden normales Sozialverhalten wiederhergestellt und depressive Auffälligkeiten bei genetisch angstbetonten Tieren reduziert, was einen präzisen Weg für künftige Therapien eröffnet.
Wie wenige Zellen das emotionale Gleichgewicht verändern
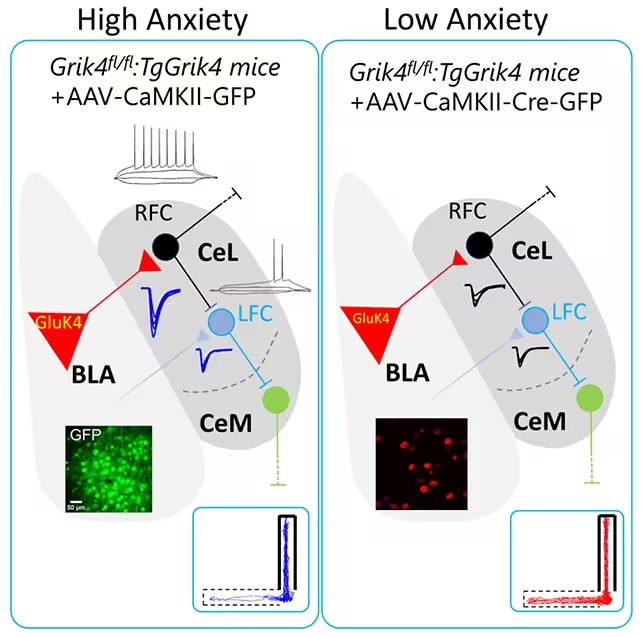
Die Studie, geleitet vom spanischen Nationalen Forschungsrat (CSIC) und der Miguel Hernández Universität von Elche (CSIC‑UMH) und publiziert in iScience (2025), konzentrierte sich auf die basolaterale Amygdala (BLA) — einen zentralen Hirnbereich für Angst, Entscheidungsprozesse und emotionale Gedächtnisbildung. Anstatt nach großflächigen Veränderungen im ganzen Gehirn zu suchen, verfolgten die Forschenden die Aktivität einer spezifischen neuronalen Population innerhalb der BLA und stellten fest, dass ein Ungleichgewicht dort allein bereits ausreichend war, um pathologische Angstzustände und soziale Defizite hervorzurufen.
Bei Überexpression des GRIK4‑Gens stieg die Produktion des GluK4‑Proteins. Mäuse mit erhöhtem GluK4 zeigten vermeidendes Verhalten in offenen Bereichen, sozialen Rückzug und depressive Verhaltensmuster. Zusätzlich hatten diese Tiere Schwierigkeiten bei Objekt‑Erkennungsaufgaben (novel object recognition), was darauf hindeutet, dass die Auswirkungen über die BLA hinaus auf vernetzte Schaltkreise reichen können.
Geneditierung beruhigt ängstliche Hirne bei Mäusen
Um das Verhalten zu korrigieren, nutzte das Team gezielte Geneditier‑Werkzeuge, um überschüssige Kopien von GRIK4 in der BLA zu entfernen und damit die GluK4‑Spiegel zu senken. Das Ergebnis war eindrucksvoll: Angst‑ähnliche Verhaltensweisen und soziale Defizite verschwanden, und die behandelten Mäuse kehrten zu typischen Erkundungs‑ und Interaktionsmustern zurück. Wie der Neurowissenschaftler Álvaro García zusammenfasste: »Diese einfache Anpassung war ausreichend, um angst‑ und sozialdefizitäres Verhalten umzukehren, was bemerkenswert ist.«
Wichtig ist, dass die gleiche Intervention auch bei nicht gentechnisch veränderten Mäusen mit natürlicherweise höherer Ängstlichkeit wirksam war, was zeigt, dass der Ansatz außerhalb transgener Modelle funktioniert. Dennoch zeigten die behandelten Tiere weiterhin Probleme bei der Objekterkennung, was darauf hinweist, dass einige kognitive Folgen von Angst durch andere Gehirnregionen vermittelt werden, die von der Behandlung nicht adressiert wurden.
Methodische Details und experimentelle Nachweise
Die experimentelle Strategie kombinierte mehrere etablierte Methoden der Neurobiologie und Verhaltensforschung:
- Genetische Manipulation: gezielte Überexpression und selektive Knockdown/Knockout von GRIK4 in der BLA.
- Vektorbasierte Zustellung: Einsatz von viralen Vektoren zur regionalspezifischen Modulation von Genexpression.
- Verhaltensassays: offene Feld‑Tests, soziale Interaktionsparadigmen und Novel‑Object‑Recognition‑Tests zur Bewertung von Angst, Sozialverhalten und kognitiven Funktionen.
- Neuronale Aktivitätsmessung: elektrophysiologische Aufzeichnungen und indirekte Marker für neuronale Erregbarkeit, um funktionelle Veränderungen in der Zielpopulation zu bestätigen.
Die Kombination dieser Methoden stärkt die Schlussfolgerung, dass GRIK4/GluK4‑Regulierung in einer definierten BLA‑Neuronengruppe kausal mit Angst‑ und Sozialverhalten verknüpft ist. Außerdem lieferte die Arbeit Hinweise auf veränderte synaptische Plastizität und glutamaterge Signalübertragung als zugrundeliegende Mechanismen.
Warum das wichtig ist — und was wir noch nicht wissen
Die Identifikation einer spezifischen neuronalen Population, deren Aktivität allein pathologische Angst auslösen kann, verschiebt die Perspektive für die Behandlung affektiver Störungen: Statt systemischer, breit wirkender Medikamente könnten gezielte Eingriffe an diskreten Schaltkreisen lokal wirksame, nebenwirkungsärmere Therapien ermöglichen.
Gleichwohl bleibt die Übertragbarkeit auf den Menschen spekulativ. Mäuse sind wertvolle präklinische Modelle, doch das menschliche Gehirn ist komplexer — in seiner Vernetzung, Zellheterogenität und in der psychosozialen Einbettung von Angststörungen. So warnen die Autoren davor, direkte klinische Schlüsse zu ziehen, bevor Mechanismen, Sicherheit und Wirksamkeit in größeren Tiermodellen und ergänzenden Studien geklärt sind.
»Wir wussten bereits, dass die Amygdala an Angst und Furcht beteiligt ist, doch nun haben wir eine spezifische Population von Neuronen identifiziert, deren unausgeglichene Aktivität allein ausreicht, pathologische Verhaltensweisen auszulösen«, erklärte Co‑Autor Juan Merma. Ein weiterer Forscher, Lerma, ergänzte, dass das gezielte Eingreifen in diese Schaltkreise »eine effektive und stärker lokalisierte Strategie zur Behandlung affektiver Störungen« werden könnte.
Mechanismen: GRIK4, GluK4 und glutamaterge Signalgebung
Das GRIK4‑Gen kodiert für eine Untereinheit von Kainat‑Rezeptoren (GluK4), die zu den ionotropen Glutamatrezeptoren zählen. Kainat‑Rezeptoren modulieren synaptische Übertragung und Plastizität und können sowohl postsynaptisch als auch präsynaptisch die Erregbarkeit von Neuronen beeinflussen. Eine Dysregulation von GluK4‑haltigen Rezeptoren kann das Gleichgewicht zwischen Erregung und Hemmung in lokalen Netzwerken der BLA verschieben — ein plausibler Mechanismus für die beobachteten Verhaltensänderungen.
Technisch gesehen legen elektrophysiologische Daten und Marker für synaptische Veränderungen nahe, dass erhöhte GluK4‑Expression die Synapsen in einem Zustand erhöhter Erregbarkeit hält. Durch Reduktion der GluK4‑Menge normalisierten sich diese Parameter, was wiederum die Verhaltenskorrektur erklären kann.
Limitierungen und offene Fragen
Wichtige Einschränkungen der Studie sind:
- Modellbegrenzungen: Mausmodelle bilden Aspekte menschlicher Angst ab, aber nicht die gesamte klinische Komplexität von Angststörungen oder Komorbiditäten wie PTSD und Major Depression.
- Teilwirksamkeit: Die Persistenz der Objekt‑Erkennungsdefizite zeigt, dass kognitive Folgen von Angst zusätzlich andere Regionen (z. B. Hippocampus, präfrontaler Kortex) einbeziehen.
- Sicherheitsaspekte: Regionale Genmodifikation kann Off‑Target‑Effekte haben; langfristige Folgen auf neuronale Netzwerke sind unklar.
- Lieferung und Translation: Die sichere, effiziente und kontrollierbare Zustellung genetischer Interventionen im menschlichen Gehirn stellt eine erhebliche Hürde dar.
Zukünftige Richtungen und therapeutische Aussichten
Als nächste Schritte schlagen die Autoren vor:
- Systematische Kartierung: Bestimmen, wie GluK4‑Dysregulation vernetzte Regionen beeinflusst (z. B. Hippocampus, medialer präfrontaler Kortex, periaquäduktales Grau) und wie diese Wechselwirkungen Verhalten modulieren.
- Skalierungstests: Erproben der Intervention in größeren Tiermodellen (Ratten, nicht‑menschliche Primaten), um Dosis‑Antwort, Sicherheit und Nebenwirkungen zu evaluieren.
- Zustellungsstrategien: Entwicklung sicherer, kontrollierbarer Vektoren (z. B. AAV‑Serotypen) oder nicht‑viraler Methoden zur regionalspezifischen Genregulation.
- Pharmakologische Alternativen: Suche nach selektiven Liganden oder allosterischen Modulatoren für GluK4‑haltige Kainat‑Rezeptoren als niederschwellige therapeutische Option ohne invasive Geneditierung.
Methodenähnlich wie in der vorliegenden Arbeit — präzise Genmodulation in gezielten Hirnregionen — könnten langfristig in adaptierter Form für den Menschen praktikabel werden, sei es durch klassische Gentherapieansätze, weiterentwickelte virale Vektoren oder durch sehr selektive Pharmaka, die GluK4‑haltige Rezeptorkomplexe modulieren.
Kontextualisierung im Feld: Was unterscheidet diese Studie?
Die Studie zeichnet sich durch mehrere differenzierende Faktoren aus, die sie gegenüber generischen Veröffentlichungen hervorheben:
- Fokussierung auf eine definierte neuronale Population statt auf breite Hirnregionen.
- Direkter kausaler Nachweis zwischen Genexpression (GRIK4), Proteinwirkung (GluK4) und Verhalten.
- Nachweis, dass Interventionen auch bei natürlicher Ängstlichkeit wirksam sind, nicht nur in transgenen Modellen.
- Integration von Genetik, Verhaltensphänotypen und neuronaler Funktion, die zusammen ein kohärentes mechanistisches Bild ergeben.
Diese Kombination aus molekularer Zieldefinition und verhaltensbiologischer Evidenz erhöht die Relevanz für Forscher, die neuartige Therapien für Angststörungen entwickeln wollen, und liefert konkrete Ansatzpunkte für Translation und Medikamentenentwicklung.
Implikationen für klinische Forschung und Gesundheitsversorgung
Falls sich die Ergebnisse langfristig in höheren Modellsystemen und klinischen Kontexten reproduzieren lassen, eröffnen sich mehrere klinische Perspektiven:
- Gezielte Therapien könnten Wirksamkeit erhöhen und systemische Nebenwirkungen reduzieren.
- Biomarker‑Entwicklung: GRIK4/GluK4‑Signaturen oder funktionelle Bildgebung der BLA könnten Patienten identifizieren, die besonders von circuit‑orientierten Interventionen profitieren.
- Personalisierte Medizin: Kombination von genetischer Profilierung, neuroimaging und Verhaltensassessment könnte individualisierte Behandlungsstrategien ermöglichen.
Allerdings sind ethische, regulatorische und praktische Fragestellungen zu adressieren — etwa die langfristige Stabilität genetischer Eingriffe, mögliche Auswirkungen auf Persönlichkeit und Emotion sowie Zugangsfragen zu teuren, hochspezialisierten Therapien.
Fazit
Die Arbeit liefert ein klareres mechanistisches Bild: kleine neuronale Ungleichgewichte in der Amygdala können überproportionale emotionale Effekte erzeugen, und die Korrektur solcher Ungleichgewichte kann viele — aber nicht alle — Symptome umkehren. Diese Differenzierung ist zentral: sie lenkt die weitere Grundlagenforschung und die Entwicklung der nächsten Therapiegeneration für Angststörungen auf präzise, circuit‑orientierte Strategien.
Kurz gesagt: Die Identifikation und gezielte Modulation von GRIK4/GluK4 in einer definierten BLA‑Neuronengruppe stellt einen bedeutsamen Fortschritt in der präklinischen Forschung zu Angststörungen dar. Zugleich bleibt der Weg zur klinischen Anwendung lang und erfordert multidisziplinäre Anstrengungen — von Neurobiologie über Vektorengineering bis hin zu Ethik und klinischer Testung.
Quelle: sciencealert

Kommentar hinterlassen