6 Minuten
Forscher haben eine spezialisierte Klasse von CD4-Immunzellen identifiziert, die seneszente Zellen erkennen und zerstören — die sogenannten „Zombie“-Zellen, die sich mit zunehmendem Alter ansammeln und chronische Entzündungen antreiben. Die Entdeckung unter Leitung der Ben-Gurion University of the Negev legt nahe, dass das Immunsystem sich an das Altern anpasst und gezielte Effektorzellen hervorbringt, die Gewebeschäden begrenzen. Diese Ergebnisse sind relevant für Altersforschung, Immunologie und potenzielle therapeutische Strategien gegen Alterungsprozesse wie inflammaging und altersassoziierte Multimorbidität.
Wie das Immunsystem sich an das Altern anpasst
Zellen, die in den Zustand der Seneszenz eintreten, hören zwar auf sich zu teilen, sondern geben weiterhin ein breites Spektrum entzündlicher Moleküle ab, das die Umgebung nachhaltig verändert. Dieser sogenannte SASP (senescence-associated secretory phenotype) umfasst Zytokine, Chemokine, Proteasen und Wachstumsfaktoren, die über Jahre hinweg zu Vernarbung, Organfunktionsverlust und einer chronischen, niedriggradigen Entzündung beitragen — ein Phänomen, das oft als inflammaging bezeichnet wird. Die Rolle des Immunsystems bei der Eliminierung solcher schädlicher Zellen wurde zwar vermutet, aber die genauen zellulären Akteure und Mechanismen blieben lange unklar.
Die neue Studie benennt eine Variante von Helfer-T-Zellen, die CD4-Eomes-Zellen, als vorrangige Abwehr gegen seneszente Zellen. Diese Zellen exprimieren das Transkriptionsfaktor-Protein Eomesodermin (Eomes), das für zytotoxische Programme bekannt ist. Durch den Vergleich von Immunzellen junger und alter Mäuse fanden die Forschenden zwei entscheidende Muster: Zum einen führen vorhandene seneszente Zellen dazu, dass CD4-T-Zellen ein CD4-Eomes-Expressionsprofil annehmen; zum anderen akkumulierten Mäuse, denen diese Spezialisierung genetisch fehlte, signifikant mehr seneszente Zellen. Kurz gesagt scheinen CD4-Eomes-Zellen eine adaptive Reaktion auf die wachsende Last seneszenter Zellen im Laufe des Alterns darzustellen.
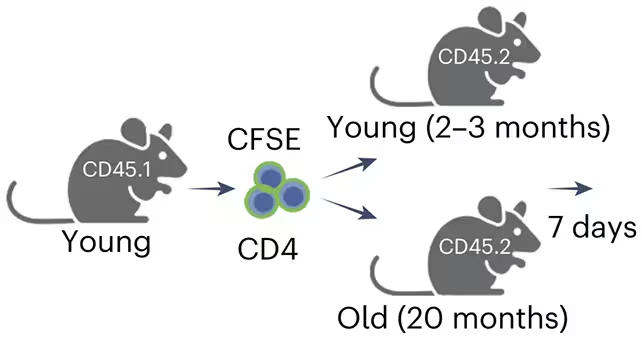
Belege aus Experimenten und Krankheitsmodellen
Zur Funktionsprüfung überführten die Forschenden CD4-T-Zellen aus jungen Tieren in sowohl junge als auch alte Empfänger und verfolgten die Folgen über Zeit. Dort, wo die CD4-Eomes-Spezialisierungen vorhanden waren, sanken die Zahlen seneszenter Zellen und Biomarker für Gewebeschäden verbesserten sich. Die schützende Wirkung zeigte sich nicht nur in gesunden Kontexten, sondern auch in Krankheitsmodellen: In einem Mausmodell für Leberzirrhose begrenzte das Vorhandensein von CD4-Eomes die Vernarbung und reduzierte die Menge seneszenter Zellen im geschädigten Lebergewebe. Solche Modelle nutzen typischerweise reizinduzierte Fibrose (etwa durch CCl4 oder Gallengang-Obstruktion), um relevante Pathomechanismen nachzubilden, und die Beobachtungen lassen sich mit veränderten Kollagenablagerungen, einem Rückgang von α-SMA-positiven Myofibroblasten und reduzierten Entzündungsmarkern korrelieren.
Diese Experimente liefern direkte funktionelle Hinweise darauf, dass CD4-Eomes-Zellen helfen, seneszente Zellen in Schach zu halten. Werden diese Immunspezialisierungen genetisch entfernt oder blockiert, zeigen die Tiere eine Zunahme seneszenter Zellen, verstärkte Gewebedegeneration und verschlechterte Organfunktionen. Methodisch stützen sich die Daten auf multiparametrische Durchflusszytometrie, Einzelzell-RNA-Sequenzierung (scRNA-seq), adoptive Transfer-Versuche sowie histologische und molekulare Marker der Seneszenz wie p16INK4a, p21 und SA-β-Gal. Zusammen untermauern diese Befunde die Idee, dass ein spezialisierter CD4-Subtyp für die Gewebshomöostase im Alter von zentraler Bedeutung ist.
Warum das für die Anti-Aging-Forschung wichtig ist
Viele Strategien zur Verjüngung zielen darauf ab, ein altes Immunsystem wieder in einen jugendlichen Zustand zurückzuversetzen, um altersbedingten Abbauprozessen entgegenzuwirken. Die Ergebnisse des Ben-Gurion-Teams warnen jedoch vor einer eins-zu-eins-Neujustierung: Ein Immunprofil, das CD4-Eomes-Zellen einschließt, könnte gerade bei älteren Individuen vorteilhaft sein. Ein zu radikales „Zurücksetzen“ könnte adaptive, nützliche Abwehrmechanismen eliminieren und dadurch das Gewebsmanagement verschlechtern.
Die Studienautoren schlagen vor, das Ziel sollte nicht ein künstlich hyperaktives Immunsystem sein, sondern eines, das für die jeweilige Lebensphase richtig abgestimmt ist — effektiv beim Entfernen seneszenter Zellen, ohne schädliche autoimmunähnliche Entzündungen anzustoßen. Diese differenzierte Sicht steht im Einklang mit aktuellen Konzepten der präzisionsmedizinischen Altersforschung: Statt pauschaler Immunsuppression oder -aktivierung sollten interventionsgestützte Strategien entwickelt werden, die die Balance zwischen Clearance schädlicher Zellen und Vermeidung von Gewebeschäden halten.
Nächste Schritte und translationale Perspektiven
Wesentliche Fragen bleiben offen: Bilden menschliche Immunsysteme CD4-Eomes-Zellen in vergleichbarer Weise aus, und wie beeinflussen Genetik, Umweltfaktoren, chronische Infektionen (z. B. CMV), Mikrobiom und Vorerkrankungen deren Aktivität? Das Forschungsteam plant, CD4-Eomes-Antworten in menschlichen Geweben systematisch zu kartieren — beispielsweise in Blut, Leberbiopsien und altersassoziierten Organproben — und zu untersuchen, ob eine Verstärkung dieser Zellen die Clearance seneszenter Zellen sicher verbessern kann.
Wenn sich Therapien entwickeln lassen, die CD4-Eomes-Funktionen gezielt erhöhen, könnten sie bestehende Ansätze wie Senolytika — Wirkstoffe, die selektiv seneszente Zellen abtöten — ergänzen. Kombinierte Strategien sind denkbar, bei denen senolytische Medikamente kurzfristig die Last seneszenter Zellen reduzieren, während modulierte Immuntherapien langfristig für eine immunologische Nachsorge sorgen. Gleichwohl betonen die Autoren die Notwendigkeit von Vorsicht: Die Übertragung von Mausbefunden auf Menschen verlangt sorgfältige Validierung in präklinischen Modellen und frühen klinischen Studien, um unerwünschte Off-Target-Effekte, übermäßige Entzündungsreaktionen oder Autoimmunität zu vermeiden.
Praktische Forschungsansätze könnten umfassen: die Identifikation von Oberflächenmarkern für CD4-Eomes-Zellen zur Entwicklung von Diagnostika; die Prüfung von Cytokin- oder Wachstumsfaktor-basierten Adjuvantien, die Differenzierung in Richtung Eomes-Expression fördern; adoptive Transfer-Strategien mit ex vivo expandierten CD4-Eomes-ähnlichen Zellen; sowie die Kombination mit gezielten Senolytika und Anti-Fibrose-Maßnahmen. Ebenso wichtig sind robuste Biomarker für Treatment-Response und Sicherheit, z. B. quantitative Messungen seneszenter Zellmarker im Blut, nichtinvasive Bildgebung von Organschäden und funktionelle Endpunkte in klinischen Studien.
In der regulatorischen Perspektive müssten neuartige Immuntherapien umfassend auf Immuntoxizität, on-target/off-target Effekte und langfristige Auswirkungen auf das Immungedächtnis geprüft werden. Studien sollten verschiedene Altersgruppen und Komorbiditäten berücksichtigen, da die Immunantwort auf Interventionen alters- und gesundheitsspezifisch variieren kann.
Zusammengefasst stellt die Entdeckung einen wichtigen Schritt dar: Sie beschreibt Altern nicht nur als passive Ansammlung zellulärer Schäden, sondern als dynamisches Zusammenspiel zwischen zunehmendem seneszenten Zellstress und adaptiven Immunantworten, das neue therapeutische Ansatzpunkte eröffnet. Die Betonung liegt auf einer fein abgestimmten Immunmodulation, die die natürliche Fähigkeit des Körpers nutzt, schädliche Zellen zu kontrollieren, ohne die Gefahren einer übermäßigen Immunaktivierung zu erzeugen.
Quelle: sciencealert

Kommentar hinterlassen