6 Minuten
Ein seit Jahrzehnten eingesetztes Blutdruckmedikament, Hydralazin, hat eine überraschende molekulare Wirkung offenbart, die Behandlungen von schwangerschaftsbedingtem Bluthochdruck und sogar bestimmten Gehirntumoren neu ausrichten könnte. Forschende betonen, dass diese Entdeckung die Tür zu sichereren, gezielteren Therapien öffnet und die Arzneimittelentwicklung durch die Repositionierung eines bekannten Wirkstoffs beschleunigen kann. Die Kombination aus etablierten Sicherheitsdaten und neu gewonnenem molekularem Verständnis macht Hydralazin zu einem vielversprechenden Kandidaten für die Translation in neue klinische Anwendungen, darunter Präeklampsie, chronischer Schwangerschaftsbluthochdruck und potenziell auch aggressive Tumoren wie das Glioblastom.
Wie ein etabliertes Medikament einen verborgenen Mechanismus offenbarte
Wissenschaftlerinnen und Wissenschaftler, die untersuchten, weshalb Hydralazin bei Präeklampsie — einem gefährlichen Blutdruckanstieg während der Schwangerschaft — helfen kann, entdeckten einen bislang unbekannten molekularen Signalweg, den das Medikament beeinflusst. Durch die sorgfältige Kartierung der biochemischen Interaktionen von Hydralazin konnten Forschungsteams die klinischen Vorteile des Wirkstoffs besser erklären und beginnen, Varianten zu entwerfen, die die Wirksamkeit erhalten, gleichzeitig aber Nebenwirkungen minimieren. Solche Untersuchungen nutzen heute häufig Methoden der Proteomik, chemischen Biologie und Massenspektrometrie, um direkte Bindungspartner, veränderte Signalwege und zelluläre Konsequenzen auf systemischer Ebene zu identifizieren.
Wie die Chemikerin Megan Matthews von der University of Pennsylvania erklärt, liefert das Verständnis von Hydralazin auf molekularer Ebene eine konkrete Roadmap für die Entwicklung sichererer, selektiverer Behandlungsoptionen bei schwangerschaftsbedingtem Bluthochdruck. Dieses mechanistische Wissen erlaubt es, Struktur-Wirkungs-Beziehungen zu analysieren, Biomarker für Zielwirksamkeit zu definieren und Angriffspunkte für medizinalchemische Optimierungen zu identifizieren. Für die Arzneimittelentwicklung ist das ein erheblicher Vorteil: Hydralazin ist bereits zugelassen und weltweit gebräuchlich, weshalb modifizierte Derivate oder verbesserte Formulierungen schneller in Patientenstudien überführt werden könnten als vollständig neue Substanzen. Zudem erleichtert die vorhandene Datenlage zu Pharmakokinetik, Pharmakodynamik und Nebenwirkungsprofilen die Planung von Phase-I/II-Studien und beschleunigt regulatorische Entscheidungsprozesse, insbesondere wenn Wirkstoffrepositionierung als Strategie gewählt wird.
Warum das für Glioblastom und gezielte Therapien relevant ist
Über die Geburtshilfe hinaus deuten die neuen Erkenntnisse auf Schwachstellen im Glioblastom hin, einem sehr aggressiven Gehirntumor mit hoher Mortalität. Die Forschung legt nahe, dass Hydralazin zelluläre Signalwege stört, auf die Glioblastomzellen angewiesen sind, um Stress zu bewältigen, Reparaturmechanismen zu aktivieren oder sich gegen zytotoxische Einflüsse zu schützen. Wenn es gelingt, den Wirkstoff so zu modifizieren, dass er selektiv genau diese Abwehrmechanismen von Tumorzellen ausschaltet, könnte Hydralazin oder ein Derivat eine effektive Ergänzung zu etablierten Onkologie‑Therapien darstellen — etwa in Kombination mit Bestrahlung, Chemotherapie oder modernen zielgerichteten Medikamenten.
Dabei sind mehrere Aspekte entscheidend: Zum einen müssen Forschungsteams die molekularen Zielstrukturen und Signalnetzwerke klar benennen, die bei Glioblastom-Subtypen am verwundbarsten sind. Zum anderen spielt die Überwindung der Blut-Hirn-Schranke (BHS) eine zentrale Rolle, denn viele potenziell wirksame Substanzen erreichen das Tumorgewebe nur eingeschränkt. Strategien könnten daher sowohl in der chemischen Modifikation von Hydralazin liegen — etwa durch Erhöhung der Lipophilie, Nutzung spezifischer Transportmechanismen oder Prodrug-Ansätze — als auch in lokalen Verabreichungsmethoden wie intratumoraler Applikation oder nanopartikelbasierter Tumorbindung, um die Wirksamkeit zu steigern und systemische Nebenwirkungen zu reduzieren. Precision-Oncology‑Ansätze, die Patienten anhand molekularer Marker selektieren, könnten die Erfolgswahrscheinlichkeit von klinischen Studien weiter verbessern.
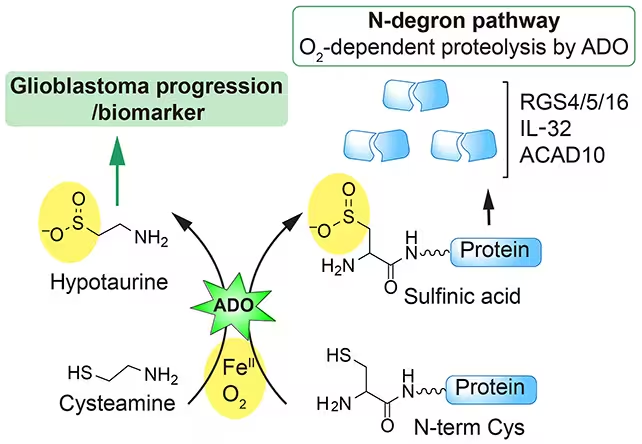
Potenz und Sicherheit in Einklang bringen
Die Repositionierung eines bestehenden Arzneimittels bringt einen wichtigen Vorteil mit sich: weitgehend bekannte Sicherheitsprofile. Hydralazin wird seit Jahrzehnten in der kardiovaskulären Medizin eingesetzt und hat etablierte Daten zu Wirkung, Dosierung und Nebenwirkungen. Dennoch betonen Forschende, dass für Indikationen wie Gehirntumoren oder Schwangerschaftskomplikationen ein sorgfältiges Abwägen zwischen Wirksamkeit gegen Zielzellen und dem Schutz gesunder Gewebe erforderlich ist. Insbesondere bei der Behandlung Schwangerer müssen Risiken für Mutter und Fetus minimiert werden, während bei der Neuroonkologie die neurotoxische Belastung und mögliche systemische Effekte im Blick bleiben müssen.
Medizinalchemische Optimierungen sind daher essenziell: durch gezielte Modifikation der Molekülstruktur lassen sich Selektivität und Affinität für neu identifizierte molekulare Ziele verbessern, während unerwünschte Interaktionen, die z. B. zu Hypotonie oder dem bekannten, wenn auch seltenen medikamenteninduzierten Lupus-ähnlichen Syndrom führen können, reduziert werden. Ergänzende Strategien umfassen die Entwicklung von Formulierungen mit verlängerter Freisetzung, Träger-Systemen mit Tumor-Targeting oder Kombinationstherapien, bei denen niedrigere Dosen des Repositionierungswirkstoffs synergistisch mit anderen Wirkmechanismen eingesetzt werden, um die Gesamttoxizität zu senken. Präklinische Studien müssen daher sowohl pharmakologische Wirksamkeit als auch Toxizitätsprofile in geeigneten Tiermodellen und ex vivo-Systemen detailliert durchleuchten.
Wie geht es weiter für Patientinnen, Patienten und Forschende?
Das Team veröffentlichte die Ergebnisse in Science Advances und skizziert klare nächste Schritte: Verfeinerung der Selektivität des Wirkstoffs, präklinische Tests mit fokussierten Glioblastom-Modellen, die Bewertung von Pharmakokinetik und Distribution im Zentralnervensystem sowie geplante klinische Studien zur Verbesserung der Outcomes von Frauen mit Präeklampsie. Auf der Agenda stehen zudem die Identifikation von Biomarkern zur Patientenselektion, Kombinationstests mit Standardtherapien und die Untersuchung möglicher Resistenzen. Die Repositionierung erlaubt dabei oft schnellere Weg von der Laborbank zum Patientenbett, denn viele regulatorische und sicherheitsrelevante Hürden sind bereits dokumentiert — dennoch bleiben robuste Wirksamkeitsdaten und sorgfältig designte klinische Prüfungen entscheidend.
Stellen Sie sich eine Zukunft vor, in der ein altes kardiovaskuläres Medikament, anhand moderner molekularer Erkenntnisse neu konstruiert, sowohl werdenden Müttern als auch Patientinnen und Patienten mit Hirntumoren hilft — ein effizienter Weg von der Grundlagenforschung zur klinischen Anwendung. Solche translationalen Ansätze kombinieren Wirkstoffrepositionierung, medizinalchemische Optimierung und präzisionsmedizinische Konzepte, um therapeutische Lücken schneller zu schließen.
„Es ist selten, dass ein klassisches Antihypertensivum neue Strategien in der Neuroonkologie beleuchtet“, so Matthews, „und wir hoffen, dass dies der Beginn weiterer disziplinübergreifender Durchbrüche ist, die in reale Behandlungsoptionen münden.“ Interdisziplinäre Zusammenarbeit zwischen Chemikern, Molekularbiologen, Klinikern und regulatorischen Experten wird entscheidend sein, um aus dieser Entdeckung tatsächlich sichere, wirksame Therapien zu entwickeln. Insgesamt steht die Forschung an einem Punkt, an dem Wirkmechanismus-Aufklärung, Wirkstoffrepositionierung und moderne klinische Testdesigns zusammenwirken können, um Patientinnen und Patienten schneller evidenzbasierte Behandlungen zur Verfügung zu stellen.
Quelle: sciencealert

Kommentar hinterlassen