9 Minuten
Neue Forschungsergebnisse aus Yale liefern eine eindeutige biochemische Erklärung für eine seit Langem beobachtete Tatsache: regelmäßige Bewegung senkt das Krebsrisiko. Bei Mäusen mit Brustkrebs oder Melanom veränderte körperliche Aktivität die Verteilung von Glukose und Energie im Körper, stärkte die Muskelstoffwechselaktivität und beschränkte gleichzeitig den Brennstoff, der den Tumoren zur Verfügung steht. Das Ergebnis war ein verlangsamtes Tumorwachstum, besonders ausgeprägt bei Tieren auf fettreichen Diäten, die freiwillig gelaufen sind.
Wie das Experiment aufgebaut war und was die Wissenschaftler maßen
Das Team um den Arzt-Wissenschaftler Brooks Leitner verfolgte die Stoffwechselaktivität bei Mäusen mit implantierten Brustkrebs- oder Melanomtumoren. Die Tiere wurden nach Ernährung und Aktivitätsniveau eingeteilt: Einige hatten Zugang zu einem Laufrad, andere blieben inaktiv. Die Forschenden setzten molekulare Tracer ein, die sichtbar machen, wo Glukose in lebendem Gewebe verstoffwechselt wird, wodurch sichabbildungen erzeugen ließen, die den Energiefluss zwischen Organen, Muskeln und Tumoren kartieren.
Die Methodik umfasste kombinierte Ansätze aus Radiotracer-Tracking, stabilen Isotopen und Bildgebung sowie detaillierter Metabolom- und Transkriptomanalysen. Solche Techniken erlauben nicht nur Quantifizierung von Glukoseaufnahmen, sondern auch die Identifikation von Stoffwechselwegen wie Glykolyse, oxidativer Phosphorylierung und Fettsäureoxidation, die in verschiedenen Geweben unterschiedlich reguliert werden. In dieser Studie wurden zudem Genexpressionsprofile erstellt, um molekulare Antworten auf körperliche Aktivität im Tumor und in peripheren Geweben zu vergleichen.
Nach vier Wochen zeigten aktive Mäuse auf fettreicher Diät eine auffällige Reduktion der Tumorgröße im Vergleich zu ihren inaktiven Artgenossen. Wie die Autorinnen und Autoren festhalten: „Fettleibige Mäuse, die nach Tumorinjektion vier Wochen freiwillig im Laufrad liefen, wiesen nahezu eine 60-prozentige Verringerung der Tumorgröße auf.“ Tumoren waren in den aktivierten Gruppen durchgehend kleiner. Die hier gezeigten Daten stammen von Mäusen mit Melanomtumoren. (Leitner et al., PNAS, 2025)
Was die metabolischen Daten offenlegen
Die molekularen Tracer machten deutlich, dass Bewegung Glukose vermehrt in Richtung Skelettmuskulatur umlenkt und sie so den Tumoren entzieht. Muskelzellen werden bei anhaltender körperlicher Aktivität metabolisch aktiver, verbrennen mehr Glukose und andere Brennstoffe und erhöhen die mitochondriale Aktivität sowie die Kapazität zur Fettsäureoxidation. Tumoren, die für schnelles Wachstum stark auf Glukose angewiesen sind (Warburg-Effekt), scheinen dadurch von dieser leicht verfügbaren Energiequelle abgeschnitten zu werden und schalten in einen hochgradig stressinduzierten Überlebensmodus.
Auf zellulärer Ebene lässt sich diese Umverteilung dadurch erklären, dass aktive Muskeln sowohl die Glukoseaufnahme als auch die Insulinsensitivität verbessern, was die kompetitive Wettbewerbsfähigkeit der Muskulatur für systemische Glukose erhöht. Gleichzeitig kann Bewegung Hormone und Zytokine modulieren, die den systemischen Metabolismus beeinflussen — etwa durch Aktivierung von AMPK, Veränderung des Insulin/IGF-Signalings und Reduktion von Entzündungsmarkern, die alle indirekt auf Tumorzellen wirken können.
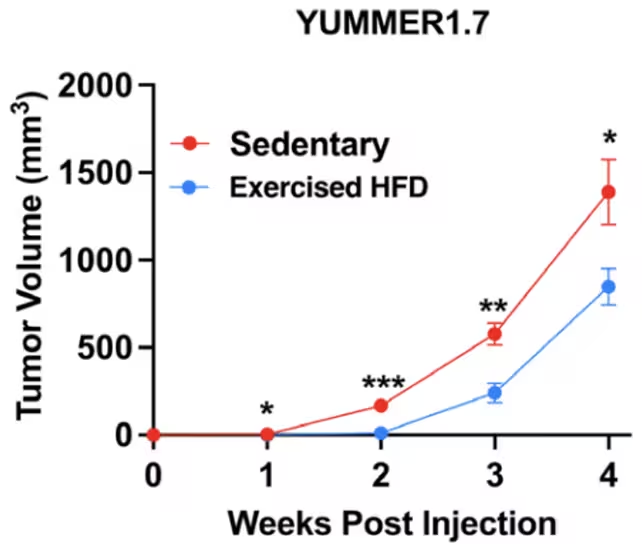
Tumoren waren durchgehend kleiner bei Mäusen, die sich bewegten. Die gezeigten Daten beziehen sich auf Mäuse mit Melanomtumoren. (Leitner et al., PNAS, 2025)
Genetisch identifizierte das Team 417 stoffwechselrelevante Gene, die in aktiven Mäusen anders exprimiert wurden als in inaktiven, schlanken Kontrolltieren. Eine auffällige Veränderung war die verminderte Aktivität des mTOR-Protein-Signalwegs innerhalb der Tumoren. mTOR ist ein zentraler Regulator von Zellwachstum und Stoffwechsel; seine Herunterregulation kann Tumorproliferation und Überleben einschränken. Insgesamt identifizieren die Daten Glukose als einen Schlüsselmediator der tumorreduzierenden Effekte von Bewegung und deuten auf einen molekularen Mechanismus hin, über den körperliche Aktivität das Fortschreiten von Krebs verlangsamen kann.
Detaillierte Analysen zeigten zusätzlich Unterschiede in Signalnetzwerken, die mit Stressantworten, Autophagie und oxidativem Stress verbunden sind. Beispielsweise konnten erhöhte Marker für mitochondrialen Stoffwechsel in Muskelproben neben einer Verschiebung in der Expression von Genen für Glukosetransporter (GLUT-Familie) gefunden werden. Diese kombinierte Veränderung in Transkriptom und Metabolom unterstreicht die Rolle des systemischen Energiemanagements als Vermittler zwischen körperlicher Aktivität und Tumorbiologie.
Warum das für Prävention und potenzielle Therapien wichtig ist
Diese Ergebnisse bedeuten nicht, dass Bewegung allein Krebs verhindern oder heilen kann. Krebs ist eine vielschichtige Erkrankung mit genetischen, umweltbedingten und immunologischen Treibern. Die Studie ergänzt jedoch die epidemiologischen Belege, dass ein aktiver Lebensstil das Auftreten und die Sterblichkeit von Krebs reduziert, um eine starke mechanistische Erklärung. Der Effekt war in zwei Tumortypen bei Mäusen sichtbar, was darauf hindeutet, dass der metabolische Vorteil von Bewegung möglicherweise nicht auf eine einzelne Krebsart beschränkt ist.
Wichtig ist, dass die Forschenden Dosis- und Zeitfaktoren betonen. Die metabolische Beziehung zwischen Muskeln und Tumoren sowie die Fähigkeit von Bewegung, Tumorwachstum zu bremsen, können davon abhängen, wie lange und wie häufig Tiere aktiv sind. Mäuse, die zwei Wochen vor der Tumorimplantation bereits trainierten, entwickelten ebenfalls kleinere Tumoren als inaktive Mäuse, was darauf hindeutet, dass eine vorbestehende Fitness oder frühe Aktivität protektive Effekte haben könnte. Solche Erkenntnisse unterstützen die Idee der primären und sekundären Prävention durch regelmäßige körperliche Aktivität.
Aus translationaler Sicht weisen diese metabolischen Verschiebungen auf potenzielle therapeutische Ansatzpunkte hin. Wenn Bewegung Tumoren durch Umleitung von Glukose und Herunterregulierung von Signalwegen wie mTOR unterdrückt, könnten Interventionen, die diese Effekte nachahmen, Patienten zugutekommen, die aufgrund von Krankheit oder Behinderung nicht ausreichend körperlich aktiv sein können. Dazu zählen pharmakologische mTOR-Inhibitoren (z. B. Rapamycin), Metformin, das den Glukosestoffwechsel beeinflusst, oder neuere „Bewegungsmimetika“, die zielgerichtet metabolische Signalwege aktivieren.
Gleichzeitig müssen mögliche Nebenwirkungen und Kontextabhängigkeiten berücksichtigt werden: Die Hemmung von mTOR beeinflusst nicht nur Tumorzellen, sondern auch normale Gewebe und das Immunsystem. Eine präzise Kombination aus Bewegung, medikamentöser Modulation und eventuell ernährungsmedizinischen Maßnahmen könnte nötig sein, um günstige Effekte zu maximieren und unerwünschte Wirkungen zu minimieren. Die Autoren schlagen vor, dass vertiefte Studien zu durch Bewegung veränderten molekularen Pfaden neue Ziele für die präzisionsmedizinische Onkologie offenbaren könnten.
Nächste Schritte: Überprüfung der Befunde am Menschen
Die zentrale Frage ist, ob die gleiche Umleitung von Glukose und die beobachteten Genexpressionsänderungen auch beim Menschen auftreten. Die Yale-Gruppe plant, ihre Arbeit auf menschliche Tumoren auszuweiten und kontrollierte Studien durchzuführen, die Art, Intensität und Dauer der körperlichen Aktivität variieren. Solche Studien sollen klären, wie Fitnessniveaus molekulare Signalwege verändern und ob diese Wege therapeutisch nutzbar sind.
Für die Translation in die klinische Forschung bieten sich verschiedene Messgrößen an: FDG-PET-Bildgebung zur Bestimmung der Glukoseaufnahme in Tumoren, hochauflösende Metabolomik aus Blut- und Gewebeproben, sowie Transkriptomanalysen von Tumorbiopsien vor und nach definierten Trainingsinterventionen. Klinische Studien könnten außerdem unterschiedliche Trainingsmodalitäten vergleichen — Ausdauertraining versus hochintensives Intervalltraining (HIIT) versus Widerstandstraining — um herauszufinden, welche Form die stärksten metabolischen Effekte auf Tumorgewebe ausübt.
Darüber hinaus sind patientenbezogene Faktoren wie Alter, Komorbiditäten, Körperzusammensetzung (z. B. Adipositas) und medikamentöse Begleittherapien relevant, da sie die metabolische Antwort auf Bewegung modulieren können. Die vorliegenden tierexperimentellen Daten legen nahe, dass besonders bei adipösen Individuen die Umverteilung von Glukose durch Bewegung ausgeprägt sein könnte, was Implikationen für Risikogruppen und personalisierte Präventionsstrategien hat.
Expert Insight
„Diese Arbeit liefert uns ein greifbares metabolisches Bild davon, wie Aktivität gegen Krebs wirkt“, sagt ein klinischer Onkologe, der mit der Studie vertraut ist. „Wir empfehlen Bewegung bereits für die allgemeine Gesundheit; nun haben wir mechanistische Gründe, sie auch als Ergänzung zu Therapien zu untersuchen, insbesondere wenn metabolische Signalwege wie mTOR involviert sind.“
Experten weisen darauf hin, dass solche mechanistischen Einsichten klinische Entscheidungen nicht automatisch ersetzen, aber sie können dabei helfen, gezielte Kombinationen aus Bewegungstherapie und medikamentösen Interventionen zu entwickeln. Beispielsweise könnten Patienten, bei denen therapeutische Optionen eingeschränkt sind, durch strukturierte Trainingsprogramme oder pharmakologische Mimetika einen zusätzlichen Nutzen erfahren.
Zusammengefasst stärken die Mausdaten ein wachsendes Argument: Regelmäßige körperliche Aktivität formt den gesamten Stoffwechsel des Körpers so um, dass Tumorwachstum eingeschränkt werden kann. Die unmittelbare klinische Botschaft bleibt vorsichtig — Bewegung ist vorteilhaft, aber kein eigenständiges Heilmittel — doch die gefundenen metabolischen Hinweise eröffnen neue Wege für Präventionsstrategien und die Entwicklung von Arzneimitteln, die die tumorverhungerte Wirkung von Bewegung nachahmen.
Für die Praxis bedeutet dies konkret: Förderung von körperlicher Aktivität als Teil der Krebsprävention und -nachsorge, Integration von Trainingsprogrammen in onkologische Versorgungsangebote, und verstärkte Forschung zu Biomarkern, die die metabolische Wirkung von Bewegung messen. Langfristig könnten individualisierte Bewegungspläne, ergänzt durch metabolisch wirkende Medikamente, das Behandlungsspektrum in der Onkologie erweitern und patientenzentriertere Präventionsstrategien ermöglichen.
Die nächsten Forschungsschritte sollten kontrollierte Interventionsstudien beim Menschen, longitudinale Beobachtungen der Auswirkung von Fitness auf Tumorprogression und kombinierte Therapieansätze umfassen. Darüber hinaus ist die Erforschung der Wechselwirkung zwischen Bewegung, Immunantwort und Tumormikroumgebung ein besonders vielversprechender Bereich, da das Immunsystem eine Schlüsselrolle in der Krebsabwehr spielt und ebenfalls stark vom metabolischen Zustand des Wirts beeinflusst wird.
Insgesamt liefert die Studie wichtige mechanistische Belege dafür, dass der Glukosestoffwechsel und Signalwege wie mTOR zentrale Vermittler für die krebshemmende Wirkung von körperlicher Aktivität sein könnten. Diese Erkenntnisse erweitern das Verständnis von Prävention und eröffnen konkrete Richtungen für die Entwicklung neuer therapeutischer Ansätze — von Trainingsprotokollen bis zu molekularen Mimetika — die das Ziel verfolgen, Tumoren gezielt den Nährstoff zu entziehen, den sie für schnelles Wachstum benötigen.
Quelle: sciencealert


Kommentar hinterlassen