10 Minuten
Ein Spermaspender, der eine seltene Krebsvorstufe im Gen TP53 trug, steht nach Angaben des dänischen öffentlich-rechtlichen Senders in Verbindung mit nahezu 200 Kindern, die in mehreren Ländern geboren wurden. Dieser Fall macht die Grenzen routinemäßiger genetischer Testungen sichtbar, zeigt Probleme grenzüberschreitender Reproduktionsmedizin auf und verdeutlicht die besonderen Herausforderungen durch Mosaikmutationen, die nur in einem Teil der Spermien auftreten.
Wie der Fall bekannt wurde
Die European Sperm Bank (ESB) in Dänemark, einer der größten Samenlieferanten weltweit, erhielt im April 2020 die Information, dass ein mit gespendetem Sperma gezeugtes Kind an Krebs erkrankt war und eine genetische Mutation trug. Erste Tests an den gelagerten Proben des Spenders zeigten diese Mutation zunächst nicht, woraufhin die Bank den Verkauf der Samen vorübergehend aussetzte, während weitergehende Analysen durchgeführt wurden. Nach der ersten Prüfungsrunde wurden die Verkäufe wieder aufgenommen. In der Folgezeit wurden interdisziplinäre Laboruntersuchungen und genetische Analysen geplant, um mögliche Ursachen für die Diskrepanz zwischen dem betroffenen Kind und den gespeicherten Proben zu identifizieren.
Drei Jahre später wurde die ESB erneut informiert, dass mindestens ein weiteres mit demselben Spender gezeugtes Kind an Krebs erkrankt sei. Vertiefende Tests an mehreren Proben — einschließlich neuer Analysen mit empfindlicheren Methoden wie hochauflösender Next-Generation-Sequencing-Technik (NGS) — deuteten darauf hin, dass der Spender eine bislang nicht beschriebene Mutation im Tumorsuppressorgen TP53 trug. Angesichts dieser Ergebnisse sperrte die Bank die weitere Nutzung seiner Samen Ende Oktober 2023. Behörden wurden eingeschaltet, klinische Register überprüft, und die ESB begann in Zusammenarbeit mit Gesundheitsbehörden und genetischen Fachkliniken, das Ausmaß der Verbreitung sowie mögliche Betroffene zu ermitteln.
Was Forscher unter einer ‚seltenen‘ TP53-Mutation verstehen
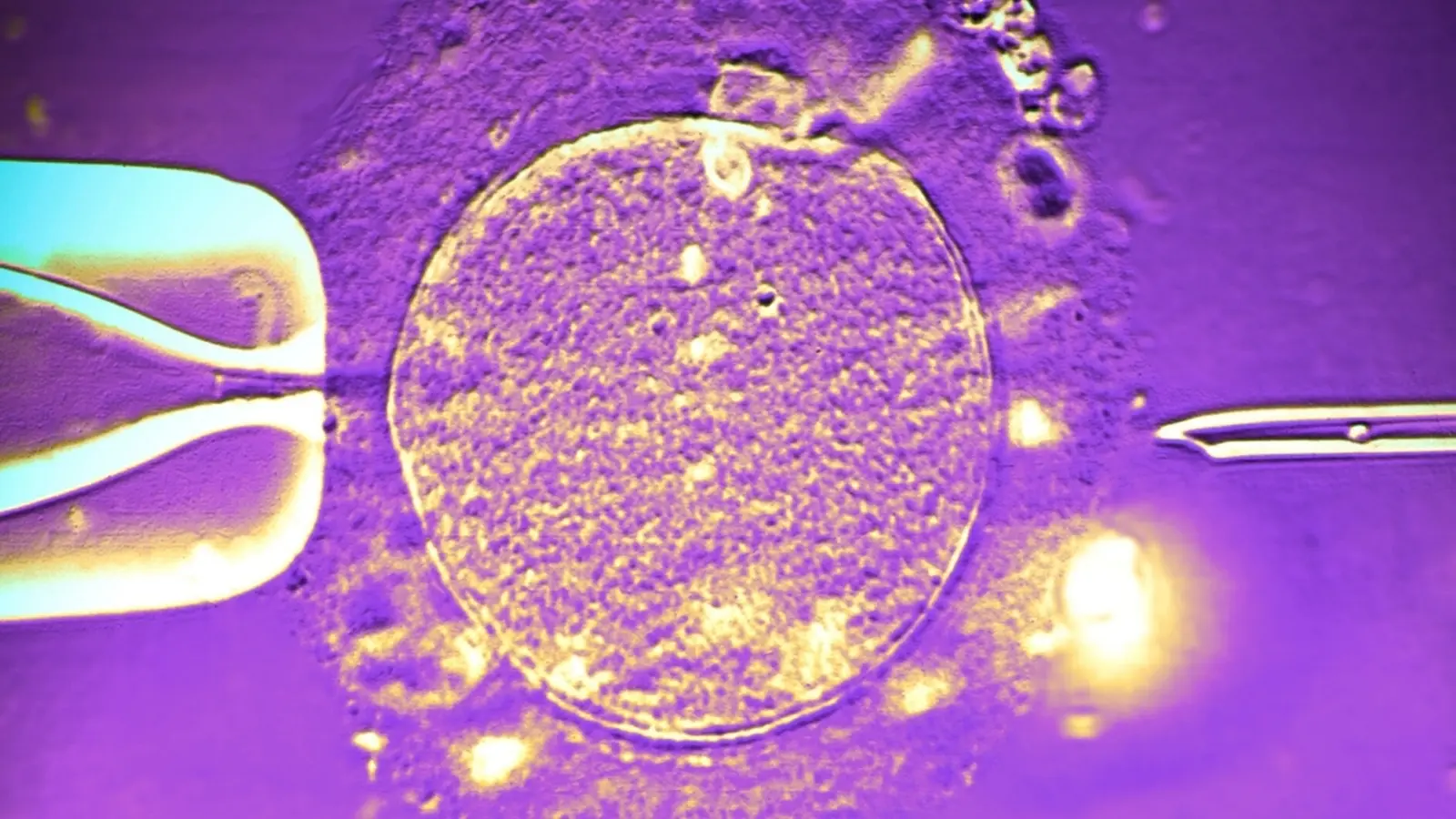
Die ESB und dänische Gesundheitsbehörden beschrieben die Veränderung als selten und ungewöhnlich. Nach Angaben der Bank wurde die spezifische TP53-Variation nur in einem kleinen Bruchteil der Spermienzellen des Spenders nachgewiesen und war im übrigen Körper nicht feststellbar. Anders formuliert: Der Spender zeigte keine offensichtlichen Symptome, weil die Mutation überwiegend auf die Keimbahn beschränkt war — ein Beispiel für Gonaden- oder Keimbahn-Mosaik (Keimbahn‑Mosaikismus).
TP53 ist ein zentral wichtiges Gen in der Krebsbiologie, das an der Reparatur geschädigter DNA beteiligt ist oder bei irreparablen Schäden den programmierten Zelltod (Apoptose) einleitet. Keimbahnmutationen in TP53 sind klassisch mit dem Li‑Fraumeni‑Syndrom verbunden, einer erblichen Veranlagung mit stark erhöhtem Krebsrisiko über verschiedene Tumorarten hinweg. Mosaikmutationen hingegen treten nur in einem Teil der Körperzellen auf — in diesem Fall in einem Teil der Spermien — und sind deshalb bei standardmäßigen Spenderuntersuchungen schwerer zu entdecken, weil diese Untersuchungen meist auf Blut- oder einzelnen Samenproben mit begrenzter Sensitivität beruhen.

Zahlen, Testgrenzen und rechtliche Lücken
Die dänische Patientensicherheitsbehörde meldete, dass in Dänemark 99 Kinder nach Behandlungen mit dem Samen dieses Spenders geboren wurden; die ESB gab gegenüber den Behörden an, dass das Gametenmaterial in 67 Kliniken in 14 Ländern verwendet worden sei. Der öffentlich-rechtliche Sender DR schätzte die Gesamtzahl der gezeugten Kinder auf mindestens 197, bevor die Auffälligkeit entdeckt wurde. Diese Zahlen illustrieren, wie schnell sich genetische Risiken bei international gehandeltem Spendenmaterial verteilen können und wie komplex das Nachverfolgen über Grenzen hinweg wird.
Fortpflanzungskliniken führen in der Regel genetische Screenings durch, um das Risiko der Weitergabe schwerer vererbbarer Krankheiten zu verringern. Üblicherweise konzentrieren sich diese Routinetests auf häufige oder bereits als pathogen bekannte Varianten und setzen voraus, dass vorhandene Mutationen in der untersuchten Probe nachweisbar sind. Bei Mosaikmutationen, die nur in einer Teilmenge der Spermien vorkommen und möglicherweise eine sehr geringe Allelfrequenz haben, können standardisierte Tests fehlschlagen. Die Sensitivität hängt von der Probenart, der Anzahl untersuchter Proben, der Sequenziertiefe und den angewandten bioinformatischen Filtern ab — Faktoren, die in klinischem Alltag oft begrenzt sind.
Ein weiteres Problem ist die Regelung der Spenderbegrenzung: In einzelnen europäischen Ländern gibt es nationale Vorgaben, die die Zahl der zulässigen Nachkommen pro Spender limitieren, doch einen einheitlichen internationalen Grenzwert gibt es nicht. Die ESB teilte mit, dass sie in zwei Jahrzehnten an über 70.000 Geburten beteiligt gewesen sei und Ende 2022 intern eine Obergrenze von 75 Familien pro Spender eingeführt habe. Der grenzüberschreitende Versand von Spendersamen und die variierenden nationalen Regularien erschweren die Kontrolle und das Tracking deutlich, sobald Material international verteilt wird. Dies wirft Fragen zum Risikoausgleich, zur Haftung und zur Verantwortlichkeit der Samenbanken sowie der behandelnden Kliniken auf.
Regulatorische und ethische Implikationen für betroffene Familien
Für Familien und Kliniken wirft der Fall konkrete und schwierige Fragestellungen auf: Wie informiert man Empfängerinnen und Empfänger angemessen über ein potenzielles Risiko? Wie lässt sich grenzüberschreitend nach möglicherweise betroffenen Kindern suchen, ohne Persönlichkeitsrechte unangemessen zu verletzen? Wann sollte man Vorsorgeuntersuchungen, gezielte genetische Tests oder genetische Beratung anbieten? Gesundheitsbehörden müssen hier ein sensibles Spannungsfeld aus Datenschutz, Betroffenenrechte und öffentlicher Gesundheit abwägen.
Praktische Optionen umfassen gestufte Informationsstrategien, individuelle genetische Beratung, Angebot von gezielten Tests für potenziell betroffene Kinder und Erwachsene sowie langfristige medizinische Nachsorge, wenn ein relevantes Risiko besteht. Gleichzeitig sind rechtliche Fragen zu klären: Besteht ein Melderecht der Samenbank gegenüber nationalen Registern? Welche Pflichten haben die klinischen Einrichtungen gegenüber Empfängerfamilien? Und wie kann man Transparenz herstellen, ohne die Privatsphäre der Spender zu verletzen? Internationale Kooperationen, gemeinsame Registernormen und klare Meldewege zwischen Banken, Kliniken und Gesundheitsbehörden könnten Teile der Lösung darstellen.

Fachliche Einordnung und Empfehlungen
Fachleute betonen, dass der Fall exemplarisch für strukturelle Schwächen in der aktuellen Spenderüberwachung steht. Für die genetische Diagnostik bedeutet dies konkret: Höhere Sensitivität durch tiefere Sequenzierung (höhere Read‑Depth) und die Analyse mehrerer Samenproben zu verschiedenen Zeitpunkten könnten das Risiko unentdeckter Mosaikmutationen reduzieren. Darüber hinaus kann die Verwendung von Methoden zur Detektion von low‑frequency‑Varianten, etwa spezialisierter bioinformatischer Filter, die Wahrscheinlichkeit erhöhen, dass auch seltene Allele erkannt werden. Solche Maßnahmen sind jedoch kostenintensiv und erfordern konsistente Qualitätsstandards sowie klare Interpretationsleitlinien für sogenannte Varianten unklarer Bedeutung (Variants of Uncertain Significance, VUS).
Auf politischer und organisatorischer Ebene empfehlen Expertinnen und Experten, nationale und internationale Rahmenwerke zu stärken: verbindliche Obergrenzen für die Anzahl von Familien pro Spender, nachvollziehbare Register zur Rückverfolgbarkeit von Spenden, verpflichtende Meldestandards bei entdeckten Pathologien sowie internationale Austauschmechanismen zwischen Banken und Kliniken. Darüber hinaus sollten betroffene Familien leichteren Zugang zu genetischer Beratung und psychosozialer Unterstützung erhalten. Solche Maßnahmen würden nicht nur Transparenz schaffen, sondern auch die Patienten- und Kindersicherheit verbessern.
Wissenschaftlicher Kontext: Mosaikmutationen und Testmethodik
Mosaikmutationen entstehen, wenn während der Embryonalentwicklung oder später in einem Gewebezyklus Mutationen in einer Zelllinie auftreten, die dann nur ein Subset aller Körperzellen trägt. Im Fall eines Keimbahn‑Mosaiks sind primär die Keimzellen betroffen, sodass eine Mutation vor allem in Ei‑ oder Samenzellen vorhanden sein kann, während Blut oder andere somatische Gewebe diese Mutation nicht zeigen. Aus diagnostischer Sicht ist das problematisch, weil viele genetische Screenings Blutproben verwenden und so Keimbahnmutationen übersehen können. Die Detektion erfordert häufig die direkte Analyse der Spermien beziehungsweise von mehreren verschiedenen Proben und höhere Sequenziertiefen, um low‑frequency‑Varianten zu erkennen.
Methodisch können Techniken wie digitales PCR‑Verfahren (dPCR), ultra‑tiefes NGS oder gezielte Sequenzierungsansätze die Sensitivität erhöhen. Allerdings sind auch diese Technologien nicht unfehlbar: Interpretation von Artefakten, Kontaminationsschutz und die Unterscheidung zwischen klinisch relevanten und benignen Varianten bleiben anspruchsvoll. Deshalb ist die Einbettung von technischen Ergebnissen in eine genetische Beratung und klinische Kontextualisierung entscheidend, insbesondere wenn Empfehlungen für Vorsorge oder Früherkennung ausgesprochen werden sollen.
Auswirkungen auf klinische Praxis und Politik
Für Fruchtbarkeitskliniken und Samenbanken bringt der Fall unmittelbaren Handlungsbedarf: interne Prüfprozesse für Spender sollten überprüft und wenn möglich erweitert werden, Informations- und Meldeketten mit nationalen Behörden gestärkt werden, und die Kommunikation zu Empfängern und potenziell betroffenen Nachkommen muss klar, zeitnah und rechtssicher erfolgen. Politisch sind harmonisierte Richtlinien sinnvoll, etwa gemeinsame Mindeststandards für genetische Tests bei Spendern, Meldepflichten für entdeckte Pathologien und Regeln für die maximale Verbreitung von Spendergameten.
Auch die Frage der Haftung kann relevant werden: Wenn eine Bank oder Klinik bekannte Risiken nicht ausreichend kommuniziert oder angemessene Tests unterlässt, könnten rechtliche Ansprüche denkbar sein. Gleichzeitig besteht die Gefahr, dass eine zu restriktive Regulierung die Verfügbarkeit von Spendersamen einschränkt und Familien den Zugang zu reproduktiven Behandlungen erschwert. Eine ausgewogene Regulierung sollte deshalb sowohl Sicherheit als auch Verfügbarkeit berücksichtigen.
Praktische Hinweise für betroffene Familien
Für Eltern und erwachsene Nachkommen, die möglicherweise betroffen sind, sind folgende Schritte ratsam: Erstens, Kontaktaufnahme mit der behandelnden Klinik oder der Samenbank, um Informationen zur konkreten Spenderkennung und zu bereits durchgeführten Tests zu erhalten. Zweitens, Einholung genetischer Beratung, um individuelle Risiken, mögliche Screening‑Strategien und medizinische Vorsorgemaßnahmen zu besprechen. Drittens, wenn indiziert, gezielte genetische Tests und geeignete Vorsorgeuntersuchungen (z. B. regelmäßige Krebsfrüherkennungsuntersuchungen) in Absprache mit Fachärzten durchführen lassen.
Wichtig ist auch psychosoziale Unterstützung: Die Nachricht über ein potenziell erhöhtes Krebsrisiko kann erhebliche psychische Belastungen hervorrufen. Beratungsangebote, Selbsthilfegruppen oder spezifische psychosoziale Interventionen sind daher wesentliche Ergänzungen zur medizinischen Versorgung.
Expertinnen- und Experteneinschätzung
Dr. Emily Carter, klinische Genetikerin an einem großen Universitätsklinikum, betonte, dass der Fall die Grenzen standardmäßiger Screenings deutlich mache: "Wenn eine Mutation nur in einem Teil der Spermien vorkommt, können Routinetests — die oft auf einer einzigen Probe basieren — diese verändern übersehen. Das ist Mosaikismus in der Praxis. Für die Reproduktionsmedizin sollte die Antwort unter anderem eine intensivere Nachverfolgung von Spendern, klarere Meldewege zwischen Kliniken international und ein verfügbares Angebot an genetischer Beratung für betroffene Familien umfassen."
Während die assistierte Reproduktion zunehmend international vernetzt und skaliert wird, plädieren zahlreiche Fachleute für bessere internationale Standards zur Spendernachverfolgung, transparente Berichterstattung genetischer Befunde und überarbeitete Screeningprotokolle, die Mosaikmutationen — wo technisch und ethisch vertretbar — mitberücksichtigen. Solche Maßnahmen könnten das Sicherheitsniveau für Empfängerinnen, Empfänger und gezeugte Kinder erhöhen, ohne die Verfügbarkeit von reproduktiven Optionen unnötig einzuschränken.
Quelle: sciencealert

Kommentar hinterlassen