9 Minuten
Neue Laborarbeiten legen nahe, dass die Reduktion einer einzelnen essenziellen Aminosäure in der Ernährung – Isoleucin – das Altern verlangsamen und die Lebensspanne von Mäusen verlängern kann. Dieser Befund wirft die Frage auf, ob gezielte Aminosäure-Interventionen auch die menschliche Langlebigkeit und Healthspan verbessern könnten. Die Übertragung von Mausresultaten auf Menschen erfordert jedoch sorgfältige Forschung und Validierung.
Warum eine Aminosäure im Zentrum der Alternsforschung steht
Isoleucin ist eine von drei verzweigtkettigen Aminosäuren (BCAAs), die der Körper zur Proteinsynthese und zur Erhaltung von Gewebe nutzt. Da Menschen Isoleucin nicht selbst herstellen können, muss es über proteinreiche Nahrungsmittel wie Eier, Milchprodukte, Soja und Fleisch aufgenommen werden. Diese biochemische Notwendigkeit macht Isoleucin einerseits essenziell, andererseits potenziell zu einem Stellrad für metabolische Veränderungen.
Forscher wissen seit einiger Zeit, dass nicht alle Kalorien gleich sind – einzelne Nährstoffe können Stoffwechsel und Gesundheit über ihren reinen Energiegehalt hinaus modulieren. Eine Bevölkerungsstudie aus Wisconsin (2016–2017) fand zuvor eine Assoziation zwischen höherer Aufnahme von Isoleucin in der Nahrung und ungünstigeren metabolischen Parametern, insbesondere bei Menschen mit höherem Body‑Mass‑Index. Solche Befunde legten nahe, dass Isoleucinaufnahme mit Adipositas und metabolischen Dysfunktionen zusammenhängen könnte und motivierten gezielte Tierversuche.
Aus epidemiologischen Beobachtungen allein lassen sich jedoch keine kausalen Schlüsse ziehen. Deshalb sind kontrollierte Experimente nötig, die einzelne Nährstoffvariablen isolieren, um zu prüfen, wie spezifische Aminosäuren Stoffwechselwege wie mTOR oder Insulinsignalgebung beeinflussen. Die Idee, dass einzelne Aminosäuren als Hunger‑ bzw. Nährstoffsignal fungieren, verknüpft Ernährungsbiochemie direkt mit molekularen Alterungsprozessen.

Ein kontrolliertes Maus-Experiment, das Isoleucin isolierte
Um zu testen, wie Isoleucin das Altern beeinflusst, erhielten genetisch vielfältige Mäuse eine von drei Diäten: eine Kontrollkost mit den üblichen 20 proteinogenen Aminosäuren; eine Diät, in der alle Aminosäuren um ungefähr zwei Drittel reduziert waren; oder eine Diät, in der nur Isoleucin um denselben Faktor reduziert wurde. Die Studie begann, als die Mäuse etwa sechs Monate alt waren – was grob einem 30‑jährigen Menschen entspricht – und die Tiere konnten frei von ihrem zugewiesenen Futter fressen.
Im Gegensatz zu simplen Kalorienrestriktionsstudien isolierte dieses Experiment eine einzelne Nährstoffvariable. Endokrinologe Dudley Lamming von der University of Wisconsin, der an diesen Studien beteiligt war, betonte, dass "ein Kalorie ist nicht nur eine Kalorie" – die Zusammensetzung der Nahrung zählt. Indem sich die Forscher auf Isoleucin konzentrierten, versuchten sie herauszufinden, welche Nahrungsbestandteile altersrelevante Veränderungen antreiben.
Die Verwendung genetisch vielfältiger Mäuse erhöht die externe Validität: statt mit homogener Versuchstier‑Genetik zu arbeiten, reflektiert diese Herangehensweise eher die genetische Variabilität, die auch bei Menschen existiert. Zusätzlich waren die Diäten so formuliert, dass Mikronährstoffe und Energiegehalt konstant blieben, wodurch Effekte speziell auf die Aminosäurezusammensetzung zurückgeführt werden konnten.
Zentrale Befunde: Längeres Leben, bessere Gesundheitsmarker
Die Einschränkung von Isoleucin in der Nahrung brachte bei Mäusen auffällige Vorteile. Männliche Mäuse auf der Isoleucin‑reduzierten Diät lebten etwa 33 % länger als Kontrolltiere; bei weiblichen Mäusen zeigte sich eine Zunahme der medianen Lebensdauer von rund 7 %. Über die reine Überlebenszeit hinaus schnitten Tiere mit Isoleucinreduktion in insgesamt 26 Gesundheitsparametern besser ab, darunter Muskelkraft, Ausdauer, Blutzuckerregulation, Schwanznutzung und reduzierter Haarausfall. Bei männlichen Mäusen gab es zudem weniger altersbedingte Vergrößerung der Prostata und eine geringere Inzidenz der häufigen Tumoren, die in diesen genetisch diversen Stämmen auftreten.
Interessanterweise konsumierten Mäuse, die das isoleucinarme Futter erhielten, tatsächlich mehr Kalorien als die anderen Gruppen. Anstatt an Gewicht zuzunehmen, erhöhten sie ihren Energieverbrauch, verloren Fettmasse und behielten eine schlankere Körperzusammensetzung bei, ohne ihre körperliche Aktivität zu steigern. Wie Lamming anmerkte, verloren die Mäuse schnell Adipositas und wurden trotz höherer Kalorienzufuhr schlanker.
Diese Beobachtungen deuten darauf hin, dass Isoleucin‑Restriktion metabolische Sollwerte verändert – hin zu einer erhöhten Energieverbrennung und besserer glykämischer Kontrolle. Mechanistisch könnte das reduzierte Isoleucin Signalwege dämpfen, die für die Speicherung von Energie und anabole Prozesse verantwortlich sind, etwa mTOR‑abhängige Pfade, und gleichzeitig katabolische oder mitochondriale Funktionen anstoßen.
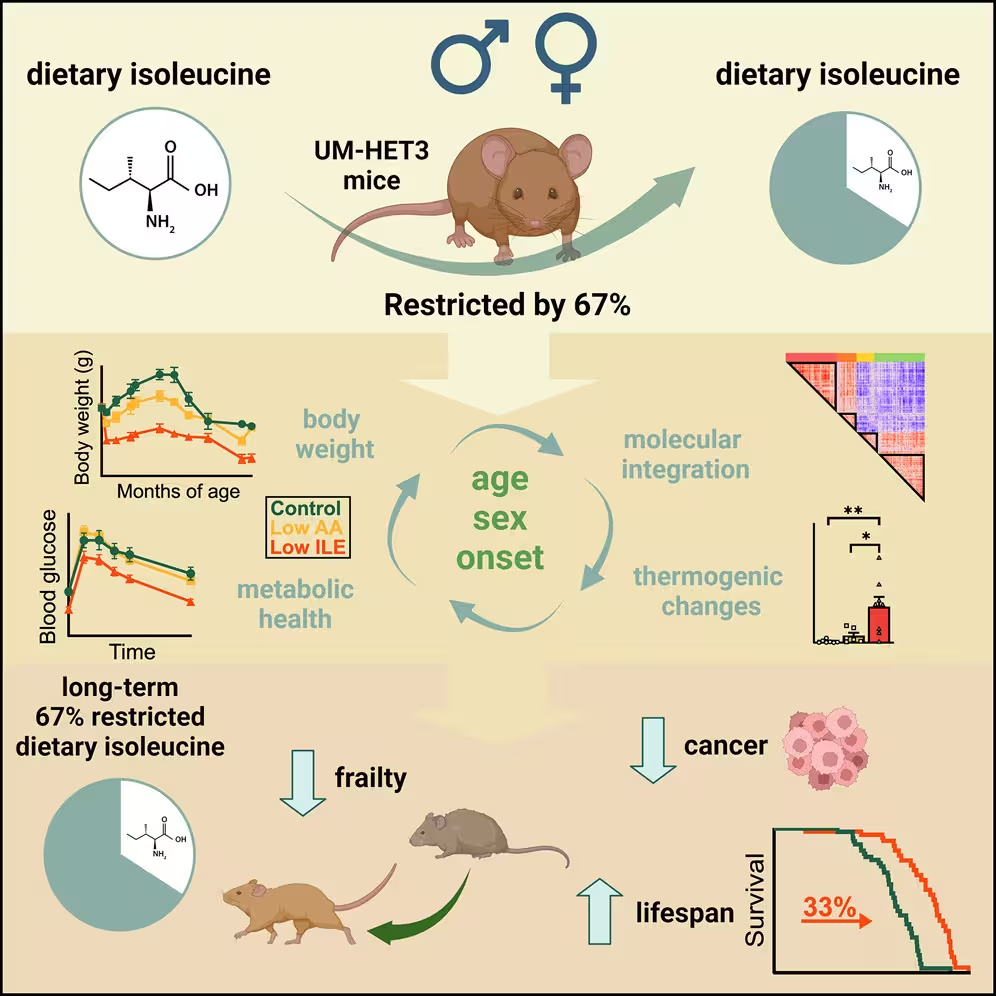
Die Studie erschien in Cell Metabolism und baut auf der Idee auf, dass die gezielte Modifikation spezifischer diätärer Aminosäuren – nicht allein Kalorienreduktion oder Proteinsenkung insgesamt – die Biologie des Alterns beeinflussen kann. Solche Ergebnisse unterstützen ein differenziertes Konzept von "qualitativem" Proteingehalt, bei dem Aminosäureprofile immunometabolische sowie altersrelevante Prozesse modulieren.
Wie sich das auf Menschen übertragen lassen könnte – und warum Vorsicht geboten ist
Mausversuche liefern wichtige mechanistische Einsichten, doch menschliche Ernährung und Physiologie sind komplexer. Die Autoren warnen davor, einfach den Verzehr proteinreicher Lebensmittel allgemein einzuschränken: eine breitere Proteindreduktion kann Wachstum, Immunfunktion und andere essentielle Prozesse beeinträchtigen; Balance und zeitliche Verteilung der Aminosäurezufuhr sind entscheidend.
Ernährung wirkt als chemisches Netzwerk – die Änderung einer Komponente kann zahlreiche nachgelagerte Pfade beeinflussen. In der Studie wurde eine präzise Reduktion von Isoleucin in einem kontrollierten Futter umgesetzt; in realen menschlichen Diäten interagieren andere Makro‑ und Mikronährstoffe sowie Lebensstilfaktoren mit jeder Aminosäurenänderung.
Trotzdem ist das Konzept, eine einzelne Aminosäure gezielt anzuvisieren, für die Arzneimittelentwicklung attraktiv. Wenn der biologische Nutzen aus spezifischen Signalwegen resultiert, die bei niedrigem Isoleucin aktiviert werden, könnten pharmakologische Blocker oder Modulatoren diese Effekte imitieren, ohne das Risiko eines essentiellen Aminosäuremangels einzugehen. Lamming sagte, die Ergebnisse näherten Forscher "den biologischen Prozessen und möglicherweise potenziellen Interventionen für Menschen, wie einem Isoleucin‑blockierenden Medikament" näher.
Für die Übertragung auf klinische Empfehlungen sind mehrere Aspekte relevant: Dosierung und Dauer der Restriktion, Altersphase bei Beginn der Intervention (z. B. junge vs. ältere Erwachsene), Geschlechtsunterschiede sowie genetische Variabilität, die die Reaktion modulieren kann. Ebenso wichtig sind Langzeitdaten zur Sicherheit, insbesondere für Immunfunktion, Wundheilung und Muskelmasse.
Biologischer Hintergrund: Verzweigtkettige Aminosäuren und Altern
BCAAs – Leucin, Isoleucin und Valin – spielen Rollen in der Muskelproteinsynthese, Energiehomöostase und in Signalwegen wie mTOR, die Nährstoffstatus mit Zellwachstum verknüpfen. Die Überaktivierung nährstoffsensitiver Signalwege wird mit Alterungsprozessen in Verbindung gebracht; die Einschränkung bestimmter Aminosäuren kann diese Signale dämpfen und Vorteile ähnlich denen der Kalorienrestriktion in experimentellen Organismen erzeugen.
mTOR (mechanistic Target of Rapamycin) agiert als zentraler Nährstoff‑Sensor, der Zellwachstum, Proteinsynthese und Autophagie steuert. Bestimmte Aminosäuren – insbesondere Leucin, aber auch Isoleucin – aktivieren mTORC1 und fördern anabole Reaktionen. Durch selektive Reduktion solcher Aminosäuren lassen sich mTOR‑abhängige Pfade potenziell modulieren, was Auswirkungen auf Proteostase, mitochondrialen Funktionserhalt und Stressresistenz haben kann.
Wichtig ist, zu verstehen, welche Aminosäuren mTOR und verbundene Signalnetzwerke beeinflussen und wie diese Effekte von Geschlecht und genetischem Hintergrund abhängen. In der Mausstudie reagierten Männchen und Weibchen unterschiedlich – was darauf hindeutet, dass optimale Interventionen geschlechtsspezifische Feinabstimmung und Berücksichtigung genetischer Diversität benötigen könnten. Hormonelle Unterschiede, Unterschiede in der Körperzusammensetzung und geschlechtsspezifische Regulationsmechanismen des Stoffwechsels können diese Diskrepanzen erklären.
Fachliche Einschätzung
Dr. Elena Rivera, eine fiktive, aber realistisch dargestellte Alternsbiologin und Wissenschaftskommunikatorin, kommentiert: "Diese Studie ist ein eleganter Proof‑of‑Concept, dass Einzelnährstoff‑Interventionen den Gesamtstoffwechsel und Altersverläufe verschieben können. Die metabolischen Verbesserungen und die verlängerte Überlebenszeit, besonders bei Männchen, zeigen uns, dass gezielte Nährstoff‑Signalgebung – nicht nur kalorische Last – ein mächtiger Hebel sein kann. Die Übertragung auf Menschen erfordert sorgfältige Dosis‑Wirkungs‑Studien, Langzeitsicherheitsdaten sowie die Berücksichtigung von Lebensphase und Geschlechtsunterschieden."
Solche Expertinnen‑ und Expertenkommentare unterstreichen, dass die Forschung zwar vielversprechend ist, aber nicht unmittelbar in allgemeine Ernährungsratschläge oder Medikamente überführt werden kann. Es bleibt ein weiter Weg von Tiermodell‑Ergebnissen über frühe klinische Studien bis hin zu evidenzbasierten Empfehlungen für die Bevölkerung.
Nächste Schritte: Studien, Medikamente und Ernährungsstrategien
Zukünftige Arbeiten müssen prüfen, ob ähnliche Interventionen bei Menschen sicher und wirksam sind. Kurzfristige Humanversuche könnten metabolische Endpunkte evaluieren – Insulinsensitivität, Fettmasse, Muskelfunktion – bevor langfristige Langlebigkeitsstudien in Betracht gezogen werden. Parallele Wirkstoffforschungsbemühungen könnten nach Molekülen suchen, die selektiv einen "niedrigen‑Isoleucin‑Zustand" nachahmen, indem sie relevante Signalachsen modulieren, ohne essentielle Aminosäurenmängel zu verursachen.
Praktische diätetische Ansätze könnten ebenfalls entstehen: die Auswahl von Proteinquellen mit vergleichsweise geringerer Isoleucin‑Dichte oder eine Anpassung der Mahlzeiten‑Timingstrategie, um die Isoleucin‑Exposition moderat zu reduzieren und gleichzeitig die Gesamtproteinversorgung zu sichern. Zu den prototypischen Proteinquellen mit unterschiedlicher Aminosäureverteilung zählen Molkereiprodukte, rotes Fleisch, Geflügel, Fisch, Hülsenfrüchte und Sojaprodukte; eine detaillierte Analyse der Isoleucin‑Anteile pro Portion wäre für konkrete Empfehlungen notwendig.
Bevor jedoch konkrete Empfehlungen formuliert werden können, sind kontrollierte Interventionsstudien am Menschen erforderlich, die nicht nur Wirksamkeit, sondern auch Sicherheit und Verträglichkeit über längere Zeiträume bewerten. Zudem sind biologische Marker (Biomarker) für die Isoleucin‑Exposition und ihre molekularen Wirkungen hilfreich, um Dosis‑Effekt‑Beziehungen zu definieren und Subgruppen zu identifizieren, die am meisten profitieren könnten.
Bis belastbare Humanstudien vorliegen, bleibt der vernünftigste Rat, sich an ausgewogene, evidenzbasierte Ernährungsleitlinien zu halten und die Entwicklung der Forschung aktiv zu verfolgen. Klinische Studien werden zunehmend nach Freiwilligen suchen; interessierte Personen sollten auf Studienregister und Ankündigungen in der Fachwelt achten.
Schließlich öffnet diese Forschung ein neues Fenster in der Altersforschung: die Möglichkeit, einzelne Nährstoffsignale gezielt zu modulieren, um metabolische Gesundheit und Lebensdauer zu beeinflussen. Ob dieser Ansatz in der Bevölkerung praktikabel wird oder eher als Ausgangspunkt für gezielte Medikamente dient, wird die nächste Forschungsdekade zeigen.
Quelle: sciencealert


Kommentar hinterlassen