8 Minuten
Forscher haben gezeigt, dass das Wiederherstellen des Aktivitätsgleichgewichts in einer sehr kleinen Gruppe von Neuronen in der Amygdala Angst und sozialen Rückzug bei Mäusen aufheben kann. Dieses Ergebnis deutet auf einen unerwartet präzisen neuronalen Mechanismus hin, der als Leitlinie für künftige, schaltkreisgezielte Therapien bei affektiven Störungen dienen könnte.
Die Untersuchung ergab, dass das Ausbalancieren der Aktivität in einem sehr kleinen Amygdala-Schaltkreis ausreichte, um Angstverhalten und sozialen Rückzug bei Mäusen umzukehren. Die Entdeckung hebt einen spezifischen neuronalen Mechanismus hervor, der als Inspiration für gezieltere Behandlungen in der Psychiatrie und Neuromodulation dienen könnte.
Wie ein einzelner Schaltkreis die emotionale Waagschale kippte
Die Studie, geleitet vom Synaptic Physiology Laboratory unter Leitung von Juan Lerma am Institute for Neurosciences (IN) — einer Zusammenarbeit zwischen dem Spanischen Nationalen Forschungsrat (CSIC) und der Miguel Hernández Universität (UMH) in Elche — lokalisierte Angst- und soziale Defizite auf eine diskrete Neuronenpopulation in der basolateralen Amygdala. Durch das Wiederherstellen der normalen Erregbarkeit innerhalb dieses Mikroschaltkreises konnten die Forschenden Verhaltenssymptome bei Mäusen umkehren, die in mehreren Aspekten dem menschlichen Angst- und Depressionsverhalten sowie sozialem Rückzug ähneln.
Die Ergebnisse zeigen, wie eng gekoppelt molekulare Signalwege, synaptische Dynamik und verhaltensrelevante Netzwerke sind. Indem das Team die lokale neuronale Aktivität präzise modulierte, konnten sie Verhaltensphänotypen verändern, was auf eine hochgradig spezifizierte Kontrolle von Emotionen durch definierte Schaltkreise hinweist. Solche Befunde sind zentral für die Diskussion über neuartige Therapieansätze, die weniger systemisch wirken, dafür aber gezielt in kritische Hirnnetzwerke eingreifen.
„Wir wussten bereits, dass die Amygdala eine zentrale Rolle bei Angst und Furcht spielt, aber diese Arbeit zeigt, dass die unausgeglichene Aktivität einer spezifischen Zellpopulation allein ausreichend ist, um pathologisches Verhalten hervorzurufen“, sagte Lerma. Die in iScience veröffentlichten Ergebnisse öffnen ein Fenster dafür, wie geringfügige Verschiebungen in neuraler Signalübertragung emotionale Zustände stark beeinflussen können.
Gentechnik, um das Ungleichgewicht zu erzeugen und dann zu korrigieren
Um den Mechanismus aufzudecken, verwendeten die Forschenden eine genetisch veränderte Mauslinie, die das Grik4-Gen überexprimiert. Diese Veränderung erhöht die Anzahl von GluK4-ähnlichen Kainat-Rezeptoren an bestimmten Neuronen und macht diese Zellen hyperexzitabel. Mäuse mit Grik4-Überexpression zeigten stark ausgeprägte Angstreaktionen und reduzierte soziale Interaktion — Phänotypen, die das Team bereits 2015 beschrieben hatte.
Mit Hilfe viral getragener Vektoren und molekularer Werkzeuge korrigierte die Gruppe anschließend selektiv die Grik4-Expression in Neuronen der basolateralen Amygdala. Diese lokal begrenzte Intervention stellte die normale Kommunikation mit einer downstream gelegenen Gruppe inhibitorischer Zellen in der centrolateralen Amygdala — den sogenannten "regular firing neurons" — wieder her und normalisierte so das exzitatorisch‑inhibitorische Verhältnis im gesamten Mikroschaltkreis.
Die gezielte Genkorrektur nutzt molekulare Werkzeuge wie CRE-Rekombinase und spezifische Promotoren, um nur definierte Zellpopulationen zu erreichen. Diese Kombination aus genetischem Modell, Viralvektoren und Schaltkreis-spezifischer Manipulation erlaubt einen sehr hohen Grad an räumlicher und zellulärer Spezifität, was für die Interpretation von Kausalzusammenhängen zwischen Genexpression, Synapsenfunktion und Verhalten entscheidend ist.
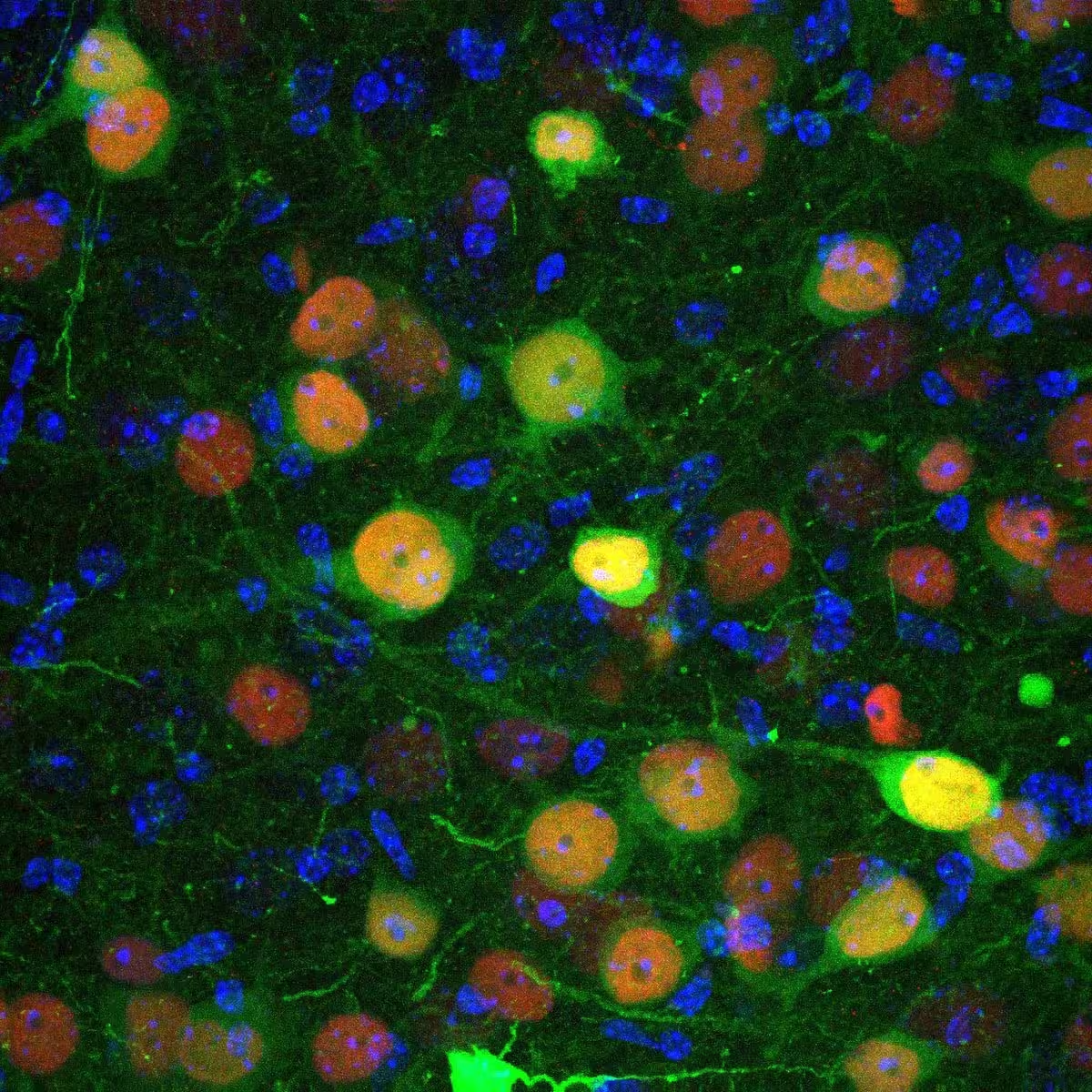
Konfokales Mikroskopie-Bild, das basolaterale Amygdala-Zellen zeigt, die von einem Virus infiziert wurden, das so konstruiert ist, die CRE-Rekombinase (rot) und das fluoreszierende Protein GFP (grün) einzubringen und so die Visualisierung der Infektion zu ermöglichen.
Parallele Messung von Schaltkreisen und Verhalten
Das Team kombinierte elektrophysiologische Aufzeichnungen mit einer Reihe standardisierter Verhaltensassays, um synaptische Veränderungen direkt mit dem Verhalten der Mäuse zu verknüpfen. In vitro- und in vivo-Messungen bestätigten, dass die Korrektur der Grik4-Expression die Feuerraten und synaptischen Antworten in der basolateral‑centrolateralen Amygdala-Pipeline normalisierte. Funktionell zeigten die behandelten Tiere eine erhöhte Bereitschaft, offene Bereiche zu erkunden, und ein wiederhergestelltes Interesse an unbekannten Artgenossen — etablierte Verhaltensmaße für reduzierte Angst und verbesserte soziale Motivation bei Nagern.
Elektrophysiologische Daten, etwa patch‑clamp‑Aufzeichnungen an identifizierten Neuronen, belegten, dass die intrinsische Erregbarkeit und die synaptische Eingangs‑/Ausgangsdynamik wieder in einen physiologischen Bereich zurückkehrte. Solche Daten sind zentral, um zu zeigen, dass die Verhaltensänderungen nicht nur korrelativ, sondern kausal mit der Normalisierung neuronaler Aktivität zusammenhängen.
Erstautor Álvaro García betonte die Eleganz des Befunds: „Diese fokussierte Anpassung in einem einzigen Amygdala‑Mikroschaltkreis reichte aus, um angstähnliche und soziale Defizit‑Verhaltensweisen umzukehren — eine bemerkenswert spezifische Rettung.“ Die genetische Zielausrichtung und die lokal begrenzte virale Reparatur erlaubten es der Arbeitsgruppe, Kausalität auf Schaltkreisebene zu testen, anstatt sich auf breit wirkende pharmakologische Interventionen zu verlassen.
Nicht die universelle Lösung, aber ein vielversprechender Blaupause
Bedeutsam ist, dass die Forschenden denselben Ansatz auch bei nichtmodifizierten, wildtypischen Mäusen überprüften, die natürlicherweise höhere Angstlevels zeigten. Auch in diesen Tieren reduzierte die Intervention die Angst, was darauf hindeutet, dass der zugrunde liegende Schaltkreismechanismus über das Grik4-Genmodell hinaus Anwendung finden könnte. „Das stärkt die Zuversicht, dass das von uns entdeckte Schaltkreisprinzip eine breitere Rolle in der Emotionsregulation spielen könnte“, merkte Lerma an.
Gleichzeitig konnten nicht alle Defizite behoben werden: Die behandelten Tiere wiesen weiterhin Beeinträchtigungen im Objektwiedererkennungsgedächtnis auf. Das legt nahe, dass kognitive Symptome zusätzliche Regionen wie den Hippocampus oder verteilte Netzwerkveränderungen involvieren, die über die modulierte Amygdala‑Microcircuit hinausgehen. Die Forschenden betonen daher, dass es sich um eine gezielte Strategie handelt und nicht um eine „Einzelheilung“ für alle Folgen genetischer Alterationen.
Dieses differenzierte Ergebnis entspricht der Vorstellung, dass neuropsychiatrische Erkrankungen multifaktoriell sind: Ein spezifischer Schaltkreis kann affektive Merkmale steuern, während Gedächtnis‑ und Kognitionsfunktionen von weiteren Hirnregionen und deren Vernetzung abhängen. Für die klinische Translation bedeutet das, dass kombinierte Strategien nötig sein könnten, um zusammengesetzte Symptomkomplexe ganzheitlich anzugehen.

IN CSIC-UMH-Forschende Álvaro García, Juan Lerma, Ana Valero Paternain und María Isabel Aller.
Warum das für künftige Therapien wichtig ist
Die Studie hebt mehrere translational relevante Ideen hervor: Erstens können affektive Symptome aus lokalen Ungleichgewichten in Erregbarkeit und synaptischer Konnektivität entstehen; zweitens können präzise molekulare Ziele (wie Grik4/GluK4‑Signale) in einer eingeschränkten Gehirnregion moduliert werden, um Verhaltensvorteile zu erzielen; drittens könnten schaltkreisbasierte Interventionen — sei es genetisch, pharmakologisch oder neuromodulatorisch — fokussiertere Alternativen zu systemischen Medikamenten darstellen.
Aus klinischer Sicht sind mehrere Strategien denkbar. Dazu zählen zielgerichtete pharmakologische Wirkstoffe, die spezifische Rezeptortypen modifizieren, virale Vektoren mit sichereren, klinisch erprobten Kapsidvarianten für die regionalspezifische Genmodulation, sowie neuromodulatorische Verfahren wie präzise tiefe Hirnstimulation (DBS) oder transkranielle fokussierte Ultraschall‑Stimulation, die auf definierte Schaltkreise einwirken. Jede dieser Möglichkeiten muss allerdings die Herausforderung bewältigen, zelltypspezifische Wirkung mit klinischer Sicherheit zu verbinden.
Die Translation von Mausdaten auf den Menschen erfordert mehrere Zwischenschritte: eine detaillierte Kartierung vergleichbarer Zelltypen in der menschlichen Amygdala, Validierung der Rolle homologer Schaltkreise in humanen Proband:innen oder Gewebeproben sowie die Entwicklung sicherer Liefermethoden für gezielte Interventionen. Darüber hinaus sind Langzeit‑Sicherheitsdaten und Ethik‑Debatten über Eingriffe in emotionale Schaltkreise unabdingbar.
Fachliche Einordnung und weiterführende Perspektiven
Technisch gesehen ergänzt diese Arbeit bestehende Befunde zur Rolle der Amygdala in Angst und sozialem Verhalten um eine zellpopulationsspezifische Komponente. Die Implikation, dass eine einzelne Neuronenfraktion in der basolateralen Amygdala das Gleichgewicht zwischen exzitatorischer und inhibitorischer Signalübertragung so stark beeinflussen kann, unterstreicht die Bedeutung zelltypspezifischer Analysen für das Verständnis psychiatrischer Störungen.
Für die Forschungsgemeinschaft liefert die Studie sowohl methodische als auch konzeptionelle Werkzeuge: methodisch durch die Kombination von genetischen Modellen, viralen Vektoren, konfokaler Bildgebung, elektrophysiologischen Messungen und standardisierten Verhaltensassays; konzeptionell durch die Betonung, dass Erkrankungsphänotypen auf Mikro‑ bis Mesoskalen des Netzwerks entstehen können. Solche Einsichten sind wichtig, um neue Biomarker und präzisere Interventionsziele zu entwickeln.
Wissenschaftlich eröffnen sich mehrere Folgefragen: Welche Molekülkaskaden vermitteln die Effekte der GluK4‑Überexprimierung auf die synaptische Plastizität? Wie stabil sind die durch gezielte Korrektur erzielten Verhaltensänderungen über lange Zeiträume? Und in welchem Ausmaß lassen sich ähnliche Schaltkreisprinzipien in höheren Säugetieren und beim Menschen nachweisen? Die Beantwortung dieser Fragen wird die Grundlage für eine verantwortungsvolle klinische Umsetzung bilden.
Expert Insight
Dr. Elena Ruiz, eine klinische Neurowissenschaftlerin, die nicht an der Studie beteiligt war, kommentierte: „Diese Forschung ist spannend, weil sie molekulare Genetik, Schaltkreisphysiologie und Verhalten in einer kausalen Kette verbindet. Sie verspricht keine sofortige Therapie, aber sie zeigt, dass hochspezifische Schaltkreiskorrekturen große Verhaltenswirkungen haben können — das ist die mechanistische Klarheit, die wir benötigen, um Behandlungen der nächsten Generation zu entwerfen.“
Solche externen Einschätzungen sind wichtig, weil sie die Relevanz für klinische Forschung und mögliche zukünftige Anwendungen einordnen. Expertinnen und Experten betonen typischerweise die Notwendigkeit, präklinische Befunde mit robusten Replikationsstudien, vergleichenden Analysen und sorgfältigen Risikoabschätzungen zu untermauern, bevor therapeutische Ansätze beim Menschen getestet werden.
Zusammenfassend zeigt die Arbeit, dass ein klar definierter Amygdala‑Mikroschaltkreis das Potenzial hat, affektive Symptome wie Angst und sozialen Rückzug zu modulieren. Dies eröffnet neue Wege für Forschung und Innovation in Neurowissenschaften, Psychiatrie und Neurotechnologie, wobei die Kombination aus molekularer Zielgerichtetheit und schaltkreisbasierter Intervention im Mittelpunkt zukünftiger Entwicklungen stehen dürfte.
Quelle: scitechdaily

Kommentar hinterlassen