7 Minuten
Eine neue Studie legt nahe, dass die Leber vorübergehend dazu gebracht werden kann, eine jugendlichere Immunfunktion wiederherzustellen, indem sie Signale produziert, die normalerweise im Thymus gebildet werden. Bei Mäusen belebte eine gezielte mRNA-Behandlung die T‑Zellproduktion und verbesserte die Reaktion auf Impfstoffe und Tumoren – ein möglicher Weg zu sicherer Immunverjüngung bei älteren Menschen.
T-Zellen sind ein zentraler Bestandteil des Immunsystems des Körpers.
Warum der Thymus wichtig ist — und was mit dem Alter schiefläuft
Der Thymus ist ein kleines Organ direkt oberhalb des Herzens, in dem unreife Vorläuferzellen zur Ausbildung funktionaler T‑Zellen angeleitet werden. Diese T‑Zellen übernehmen als vorderste Abwehrlinie Aufgaben wie Erkennung und Eliminierung infizierter oder entarteter Zellen. Ab dem frühen Erwachsenenalter verkleinert sich der Thymus schrittweise und seine Funktion lässt nach; dieser Prozess wird als thymische Involution bezeichnet. In der Folge werden weniger neue T‑Zellen gebildet und der Pool an verfügbaren Immunzellen verliert an Vielfalt. Das erhöhte Risiko für Infektionen, Tumorerkrankungen und eine abgeschwächte Reaktion auf Impfungen ist eine typische Folge dieser altersbedingten Veränderungen des Immunsystems, auch bekannt als Immunoseneszenz oder Altersimmunität.
Wissenschaftlerinnen und Wissenschaftler am Broad Institute des MIT und der Harvard University verfolgten in der aktuellen Arbeit einen anderen Ansatz: Anstatt zu versuchen, den Thymus selbst wieder aufzubauen, wollten sie einige seiner sekretorischen Funktionen ersetzen. Die Idee war, ein anderes Organ zu nutzen, das auch im Alter noch zuverlässig Proteine produziert — die Leber — und es dazu zu bringen, die molekularen Signale freizusetzen, die die T‑Zellentwicklung fördern.
Die Leber in eine thymusähnliche Proteinfabrik verwandeln
Im ersten Schritt verglich das Team das Immunsystem junger und alter Mäuse, um die wichtigsten Signale zu identifizieren, die mit dem Alter abnehmen. Dabei fokussierten sie sich auf drei Proteine, die die Zellschicksalsentscheidung steuern und die Gesundheit sich entwickelnder T‑Zellen sichern: DLL1 (Delta‑like 1), FLT3‑L (Fms‑like Tyrosin‑Kinase 3‑Ligand) und IL‑7 (Interleukin‑7). Diese Faktoren wirken wie Anweisungen, die Zellen sagen: „Differenziere dich zu einer T‑Zelle“ und „Bleibe lebensfähig und funktionsfähig“.
Technisch betrachtet sind diese Signale an verschiedenen Stellen der T‑Zellreifung entscheidend: DLL1 beeinflusst Notch‑Signale, welche die T‑Zelllinie gegenüber alternativen Differenzierungswegen begünstigen; FLT3‑L spielt eine Rolle bei der Versorgung von Vorläuferpopulationen und der Aufrechterhaltung eines geeigneten Mikroklimas; IL‑7 ist ein überlebensförderndes Zytokin, das junge T‑Zellen in ihrer Reifung und peripheren Homöostase unterstützt. Das gezielte Zusammenspiel dieser drei Faktoren schafft Bedingungen, die dem thymischen Umfeld ähneln, ohne den Thymus selbst zu regenerieren.
mRNA übermittelt die Anweisungen
Im nächsten Schritt verpackten die Forschenden Boten‑RNA (mRNA), die für diese Signalproteine kodiert, und injizierten sie über mehrere Wochen in die Leber älterer Mäuse. mRNA dient als temporärer Bauplan, mit dem Zellen die vorgegebenen Proteine herstellen können — dieselbe Plattform, die auch bei modernen Impfstoffen Anwendung findet. Durch die Nutzung von mRNA konnte die Leber DLL1, FLT3‑L und IL‑7 produzieren, ohne das Gewebe dauerhaft genetisch zu verändern oder strukturelle Eingriffe am Thymus vorzunehmen.
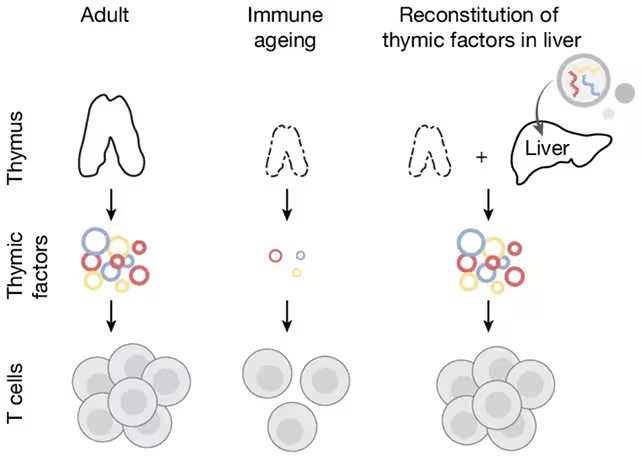
Die Forschenden nutzten die Lebern der Mäuse, um die T‑Zellproduktion zu stimulieren.
Stärkere, vielfältigere T‑Zellen — aber nur vorübergehend
Nach vier Wochen Behandlung zeigten die älteren Mäuse deutliche Verbesserungen: eine höhere Zahl an T‑Zellen, größere Diversität im T‑Zellrepertoire, stärkere Antikörperantworten auf Impfungen sowie eine bessere Kontrolle von Tumoren in herausfordernden Krebsexperimenten. Kurz gesagt: Die immunologischen Profile wirkten jünger und widerstandsfähiger. Solche Ergebnisse deuten darauf hin, dass eine gezielte Steuerung von Signalproteinen die funktionelle Qualität des adaptiven Immunsystems auch später im Leben verbessern kann.
Ein zentraler Befund war jedoch, dass der Effekt nicht dauerhaft anhielt. Die verstärkte Sekretion aus der Leber nahm nach Absetzen der Behandlung wieder ab. Die Autorinnen und Autoren betonen dies als wichtigen Sicherheitsaspekt: Eine vorübergehende Erhöhung der T‑Zellproduktion reduziert das Risiko einer chronischen Überstimulation, die andernfalls zu schädlichen Entzündungsreaktionen oder Autoimmunität führen könnte. Damit wird ein Gleichgewicht zwischen therapeutischem Nutzen und Sicherheitsprofil angestrebt, das für die translationale Entwicklung von Therapien essentiell ist.
Mechanistisch lässt sich das Ergebnis so interpretieren, dass die temporäre Bereitstellung thymusähnlicher Signale genügt, um ruhende oder reduzierte Vorläuferzellen reaktivieren und in eine produktive T‑Zellreifung führen zu können. Gleichzeitig bleiben zentrale Regelmechanismen erhalten, die nach Abschwellen der Stimuli die Homöostase wiederherstellen.
Was das für die menschliche Gesundheit bedeutet und die nächsten Schritte
Die Mausbefunde eröffnen eine vielversprechende Alternative zu systemischen Immunverstärkern, die oft den gesamten Blutkreislauf „überschwemmen“ und dadurch Nebenwirkungen verursachen können. Die Leber filtern das Blut und ist relativ gut zugänglich für gezielte Therapien, weshalb sie sich als praktikabler Ort für kontrollierte, organspezifische Immunmodulation anbietet. Durch die lokale Produktionsstätte lassen sich Konzentrationsspitzen im Blut reduzieren und die Wirkung räumlich fokussieren.
Gleichwohl gilt: Erfolge in Mausmodellen garantieren keinen ähnlichen Nutzen beim Menschen. Die Forschenden planen deshalb umfangreiche Folgeexperimente: Tests in anderen Tiermodellen, Feinabstimmung der Kombination und Dosis der gelieferten Signale, Bestimmung der optimalen Behandlungsdauer sowie Untersuchungen zu Effekten auf unterschiedliche Immunzelltypen (etwa regulatorische T‑Zellen, T‑Gedächtniszellen, dendritische Zellen). Klinische Übersetzung erfordert zudem sorgfältige Arbeit an Dosisfindung, Sicherheitsprofilen und den langfristigen Folgen, einschließlich möglicher Auswirkungen auf inflammatorische Marker, Autoimmunität und onkologische Risiken.
Wesentliche Entwicklungspfade umfassen auch die Auswahl geeigneter Lieferplattformen (z. B. lipidbasierte Nanopartikel, gezielte Delivery‑Systeme), die Skalierbarkeit der mRNA‑Herstellung, Stabilitätsfragen und die Validierung von Biomarkern, die Therapieantworten zuverlässig anzeigen. Außerdem müssen regulatorische Vorgaben erfüllt und ethische Aspekte, etwa in Bezug auf Altersgruppen und Komorbiditäten, adressiert werden.
Darüber hinaus sind mechanistische Studien nötig, um zu klären, welche Populationen von Thymusvorläufern noch reaktivierbar sind und wie heterogen die Reaktion in verschiedenen Individuen ausfällt. Faktoren wie chronische Entzündung (Inflammaging), metabolische Erkrankungen, Vorerkrankungen der Leber oder vorangegangene Immuntherapien könnten die Effektivität beeinflussen und müssen in präklinischen Studien berücksichtigt werden.
„Wir wollten den Immunschutz länger im Leben erhalten, indem wir thymische Sekretionsmuster nachahmen“, sagte Mirco Friedrich (Broad Institute/MIT) und erläuterte damit die Motivation hinter der lebergerichteten Strategie. Feng Zhang (MIT) beschrieb die Methode als einen synthetischen, ingenieurwissenschaftlich geprägten Weg, thymische Signale zu reproduzieren, ohne den Thymus selbst rekonstruieren zu müssen.
Wird das Vorgehen beim Menschen validiert, könnte eine leberbasierte mRNA‑Therapie ein Werkzeug werden, um altersbedingtem Immunabbau entgegenzuwirken, die Wirksamkeit von Impfungen im höheren Alter zu steigern und die allgemeine Krankheitsresistenz älterer Menschen zu verbessern, während zugleich einige der Risiken direkter, systemischer Eingriffe in den Blutkreislauf vermieden werden. Solche Therapien könnten sich ergänzend zu bestehenden Impfstrategien oder immunmodulatorischen Behandlungen einsetzen lassen und neue Optionen für die geriatrische Medizin eröffnen.
Praktisch bedeutet das für die Translation: Klinische Studien würden schrittweise beginnen, begleitet von einem intensiven Monitoring immunologischer Endpunkte (T‑Zellanzahl, Repertoirediversität, funktionelle Assays wie zytotoxische Aktivität, Cytokinprofile) sowie Sicherheitsparametern (Leberfunktionen, Entzündungsmarker, Autoantikörper). Adaptive Studiendesigns könnten dabei helfen, in frühen Phasen verschiedene Dosen und Zeitfenster zu evaluieren und die Balance zwischen Effektstärke und Verträglichkeit zu optimieren.
Abschließend bleibt festzuhalten: Die Studie liefert wichtige konzeptuelle Erkenntnisse zur Organ‑zu‑Organ‑Modulation des Immunsystems mittels mRNA. Als nächstes sind rigorose präklinische Validierungen und eine enge Zusammenarbeit zwischen Grundlagenforschung, klinischer Entwicklung und Regulierungsbehörden notwendig, um das Potenzial dieser Strategie sicher und effektiv für Menschen nutzbar zu machen.
Quelle: sciencealert

Kommentar hinterlassen