7 Minuten
Eine genetische Studie mit mehr als einer Viertelmillion Menschen legt eine überraschende Verbindung zwischen dem Stoffwechsel von Vitamin B1 (Thiamin) und der Geschwindigkeit dar, mit der Nahrung durch den Verdauungstrakt wandert. Die Forschung hebt Genvarianten hervor, die mit der Aktivierung und dem Transport von Thiamin zusammenhängen, und verbindet diese Varianten mit messbaren Unterschieden in der Stuhlfrequenz — einem einfachen, aber wichtigen Marker für die Darmmotilität.
Genetische Hinweise deuten auf Thiamin als Darmregulator
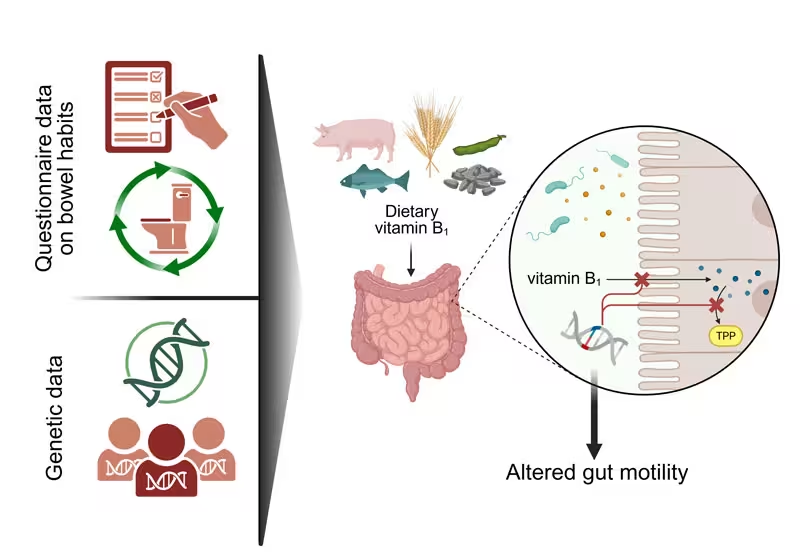
Forscher, die Datensätze aus europäischen und ostasiatischen Populationen nutzten, durchsuchten Genome, um genetische Einflüsse auf die Darmmotilität zu kartieren. Anstatt die Ergebnisse auf bereits bekannte Signalwege wie Gallensäuren oder nervale Signalübertragung zu beschränken, zeigte die Analyse ein klares Signal für den Vitamin‑B1‑Stoffwechsel. „Wir haben Genetik verwendet, um eine Landkarte biologischer Pfade zu erstellen, die das Tempo des Darms bestimmen“, sagte Cristian Díaz‑Muñoz von der Basque Research & Technology Alliance. „Auffällig war, wie deutlich die Daten auf den Vitamin‑B1‑Stoffwechsel hinwiesen.“
Die Forschenden identifizierten zwei spezifische Genvarianten, die offenbar die Expression von Genen verändern, die an der Aktivierung von Thiamin und an seinem zellulären Transport beteiligt sind. In einer gezielten Nachuntersuchung mit nahezu 100.000 Teilnehmern der UK Biobank fanden die Ermittler eine robuste Assoziation zwischen der Nahrungsthiasminzufuhr und der Stuhlfrequenz, wobei der Effekt bei Menschen mit den identifizierten Varianten unterschiedlich ausgeprägt war.
Dieses Muster legt nahe, dass der Thiamin‑Stoffwechsel nicht nur mit dem Stuhlverhalten korreliert, sondern möglicherweise kausal an der Festlegung der Darmdurchlaufzeit beteiligt ist. Die Studie, veröffentlicht in Neurogastroenterology im Jahr 2026 (Díaz‑Muñoz et al., 2026), stellt Thiamin als einen plausiblen und zuvor unterschätzten Regulator der Stuhlfrequenz dar. Die Autoren diskutieren sowohl molekulare Mechanismen als auch epidemiologische Beweise, die zusammen eine konsistente Geschichte zeichnen.
Methodisch basierte die Arbeit auf genomeweiten Assoziationsstudien (GWAS) kombiniert mit funktionaler Genomik, Expression‑Quantitative‑Trait‑Loci‑Analysen (eQTL) sowie Integrationsanalysen, die genomische Signale mit bekannten metabolischen Pfaden verknüpfen. Durch diese integrative Herangehensweise konnten die Forschenden nicht nur statistische Assoziationen aufzeigen, sondern auch biologische Plausibilität auf Ebene von Enzymen und Transportproteinen herstellen.
Was das für Patienten und zukünftige Forschung bedeutet
Darmmotilität liegt vielen häufigen Erkrankungen zugrunde — von chronischer Verstopfung und Durchfall bis hin zum Reizdarmsyndrom (RDS). „Probleme der Darmmotilität stehen im Zentrum des Reizdarmsyndroms, der Verstopfung und anderer häufiger Motilitätsstörungen“, erläuterte der Genetiker Mauro D'Amato. Das Identifizieren nährstoffbezogener Signalwege eröffnet prüfbare Ansätze für Laboruntersuchungen und klinische Studien, die sich an Personen mit genetischer Prädisposition für Motilitätsprobleme richten.
Welche praktischen Konsequenzen ergeben sich daraus für Patientinnen und Patienten? Könnte eine Erhöhung der Vitamin‑B1‑Zufuhr helfen? Die Daten sind vielversprechend, aber vorläufig. Beobachtungsstudien und genetische Assoziationen beweisen nicht, dass Nahrungsergänzungen bei allen Betroffenen Dysmotilität korrigieren. Dennoch deuten frühere klinische Arbeiten auf potenzielle Vorteile hin: Einige klinische Berichte und Studien beobachteten Besserungen von Darmentzündungen oder systemischen Symptomen bei therapeutischer Anwendung von Thiamin, darunter eine randomisierte Studie aus dem Jahr 2020, die bei Patienten mit entzündlichen Darmerkrankungen (IBD) nach Hochdosis‑Thiamin eine Symptomverbesserung zeigte.
Wichtig ist, diese Hinweise systematisch zu prüfen. Klinische Empfehlungen erfordern Replikation, sorgfältige Dosis‑Bestimmung und Sicherheitsbewertungen. Thiamin gilt zwar als relativ sicher und wasserlöslich, aber hohe Dosen können bei bestimmten Patientengruppen, etwa bei Nierenschwäche oder in Kombination mit bestimmten Medikamenten, besondere Vorsicht erfordern.
Auf biologischer Ebene bieten sich mehrere plausible Mechanismen an: Thiamin fungiert als Cofaktor für Schlüssel‑Enzyme des Energiestoffwechsels (z. B. Pyruvat‑Dehydrogenase, α‑Ketoglutarat‑Dehydrogenase), die für die zelluläre Energiegewinnung essentiell sind. Energieverfügbarkeiten beeinflussen die Aktivität glatter Muskulatur und die neuronale Erregbarkeit — beides zentrale Komponenten der Peristaltik. Darüber hinaus moduliert Thiamin Nervenzellfunktionen, sodass Veränderungen im Thiamin‑Metabolismus direkte Effekte auf das enterische Nervensystem und die neuromuskuläre Koordination des Darms haben könnten.
Ein weiterer vielversprechender Pfad ist die Wechselwirkung mit dem Mikrobiom: Forscher beginnen zu untersuchen, wie die Verfügbarkeit von B‑Vitaminen im Darmbereich die Zusammensetzung und Funktion der bakteriellen Gemeinschaft beeinflusst. Darmbakterien nutzen und liefern Cofaktoren, sie produzieren Metaboliten, die die Motilität hemmen oder fördern können, und sie interagieren mit der Schleimhaut und dem enterischen Nervensystem. Eine veränderte Thiamin‑Verfügbarkeit könnte somit indirekte, mikrobiomvermittelte Effekte auf die Stuhlfrequenz haben.
Thiamin: Ernährung und Funktion
- Ernährungsquellen: Vollkornprodukte, Schweinefleisch und andere Fleischsorten, Fisch, Hülsenfrüchte und mit Thiamin angereicherte Getreideprodukte.
- Biologische Rolle: Thiamin hilft bei der Umwandlung von Nahrung in Energie und unterstützt die Funktion des Nervensystems, beides Faktoren, die die Darmmuskulatur und die neuronale Signalübertragung beeinflussen können.
- Mikrobiom‑Zusammenhang: Forschende beginnen zu untersuchen, wie die Verfügbarkeit von Thiamin das Darmmikrobiom beeinflusst, das seinerseits die Motilität modulieren kann.
Die nächsten Schritte umfassen Laborversuche, um nachzuverfolgen, wie die betroffenen Genvarianten die Thiaminverarbeitung auf zellulärer Ebene verändern, sowie sorgfältig konzipierte klinische Studien, die prüfen, ob gezielte Thiamin‑Supplementierung die Stuhlfrequenz und Symptome des Reizdarmsyndroms bei genetisch anfälligen Personen verbessert. Solche Studien sollten randomisiert, placebo‑kontrolliert und ausreichend groß sein, um Subgruppenanalysen (z. B. nach Genotyp) zu ermöglichen.
Auf Populationsebene könnten zukünftige Ansätze personalisierte Ernährungsempfehlungen einschließen, die genetische Tests mit individuellen Ernährungs‑ oder Supplementplänen kombinieren. Allerdings sind ethische, ökonomische und praktische Aspekte zu berücksichtigen: Screening‑Programme müssen nachweislich kosteneffektiv und klinisch nützlich sein, bevor sie breit eingeführt werden.
Zur klinischen Umsetzung werden außerdem Fragen der Sicherheit und Wechselwirkungen relevant: Hohe Dosen von wasserlöslichen Vitaminen wie Thiamin werden zwar meist gut vertragen, aber Langzeitdaten zu Megadosen fehlen weitgehend. Wechselwirkungen mit Medikamenten (beispielsweise Diuretika oder bestimmte Antibiotika) und mögliche Auswirkungen bei Leber‑ oder Niereninsuffizienz sollten in Studien explizit untersucht werden.
Beschränkungen der aktuellen Studie sind ebenfalls zu beachten. Erstens stammen die untersuchten Kohorten überwiegend aus europäischen und ostasiatischen Populationen; die Übertragbarkeit der Ergebnisse auf andere ethnische Gruppen muss noch geprüft werden. Zweitens ist die Stuhlfrequenz ein nützlicher, aber vereinfachter Surrogatmarker für Darmmotilität; subklinische Aspekte der Peristaltik oder qualitative Veränderungen des Stuhls werden dadurch nicht erfasst. Drittens sind die gemessenen Effektgrößen einzelner Genvarianten oft klein — klinisch relevante Verbesserungen dürften eher bei der Kombination mehrerer Faktoren (Genetik, Ernährung, Mikrobiom, Medikamente) auftreten.
Dennoch fügt die Studie dem komplexen Puzzle der Darmphysiologie ein faszinierendes Teil hinzu: Nährstoffe — nicht nur Arzneimittel — können grundlegende Aspekte der Darmfunktion formen. Sollte sich der Zusammenhang zwischen Thiaminstoffwechsel und Darmmotilität in weiteren Studien bestätigen, könnte dies die Entwicklung personalisierter Ernährungsstrategien zur Behandlung oder Prävention von Motilitätsstörungen vorantreiben.
Für Ärztinnen und Ärzte sowie Ernährungsexpertinnen und -experten bedeutet das eine erweiterte Perspektive: Neben Pharmakotherapie und Lebensstilinterventionen könnte die gezielte Modifikation der Nährstoffzufuhr — gestützt durch genetische Informationen — zu einem zusätzlichen, patientenspezifischen Therapiewerkzeug werden.
Abschließend bleibt festzuhalten, dass die Verbindung zwischen Vitamin B1 (Thiamin) und Darmmotilität ein neues, interdisziplinäres Forschungsfeld abzeichnet, das Genetik, Metabolismus, Mikrobiomforschung und klinische Gastroenterologie verbindet. Die bisherigen Ergebnisse sind ein Ausgangspunkt für weiterführende mechanistische Studien und randomisierte klinische Prüfungen, die klären müssen, ob und wie Thiamin‑bezogene Interventionen tatsächlich die Symptome von Patientinnen und Patienten mit Motilitätsstörungen lindern können.
Bis definitive Empfehlungen vorliegen, ist eine ausgewogene Ernährung mit ausreichender Zufuhr an B‑Vitaminen eine sinnvolle Basismaßnahme. Personen mit chronischen Darmproblemen sollten jedoch immer ärztlichen Rat einholen, bevor sie eigenständig hochdosierte Nahrungsergänzungsmittel einnehmen.
Quelle: sciencealert


Kommentar hinterlassen