8 Minuten
Viele Menschen schreiben Vergesslichkeit einfach dem "Älterwerden" zu. Doch was, wenn Altern weniger ein einzelner Übeltäter ist als ein Zusammenspiel langsamer, sich gegenseitig beeinflussender Veränderungen im gesamten Gehirn?
Wissenschaftlerinnen und Wissenschaftler unter Leitung der Universität Oslo haben diese Frage jenseits von Anekdoten untersucht, indem sie eine umfangreiche Sammlung klinischer Daten zusammenführten: Tausende gesunde Freiwillige, mehr als 10.000 MRT-Aufnahmen und weit über 13.000 kognitive Tests. Das Ergebnis ist eines der klarsten und detailliertesten Bilder davon, wie sich strukturelle Gehirnveränderungen über Jahrzehnte hinweg mit dem episodischen Gedächtnis verknüpfen — jener Fähigkeit, Ereignisse, Orte und Momente zu erinnern.
Die Studie und die Daten
Die Analyse fasste Aufzeichnungen von 3.737 kognitiv gesunden Teilnehmenden zusammen, die über mehrere beständige Forschungskohorten hinweg beobachtet wurden. Dieses Ausmaß ist entscheidend: Kleine Studien können erste Hinweise geben; diese Arbeit verknüpft dutzende Kohorten, um zu zeigen, wie sich Gehirnanatomie und Gedächtnisleistung gemeinsam über das Erwachsenenleben entwickeln.
Erwartungsgemäß fiel der Hippocampus — lange als Gedächtniskern bekannt — besonders auf. Doch die Schlagzeile sollte nicht lauten: „Nur Hippocampus.“ Schrumpfungen in mehreren Hirnregionen korrelierten mit schlechterem episodischem Gedächtnis, und diese Zusammenhänge wurden mit zunehmendem Alter stärker. Anders ausgedrückt: Volumenverluste im Gehirn werden ab etwa 60 Jahren bedeutsamer für Gedächtnisfunktionen, und Veränderungen in vielen Regionen — nicht ein einzelner Hotspot — prägen diesen Abwärtstrend.
Genetik spielt ebenfalls eine Rolle. Trägerinnen und Träger des APOE ε4-Allels — einer Variante, die mit einem höheren Alzheimer-Risiko verknüpft ist — zeigten im Mittel einen schnelleren Gewebeverlust und einen steileren Gedächtnisabfall. Dennoch war die allgemeine Trajektorie über die gesamte Stichprobe hinweg konsistent: Die gleichen anatomischen Prozesse waren aktiv, nur beschleunigt bei APOE ε4-Trägern. Wie der Neurologe Alvaro Pascual-Leone bemerkte: "Indem Daten aus dutzenden Forschungskohorten integriert wurden, haben wir nun das bisher detaillierteste Bild davon, wie sich strukturelle Veränderungen im Gehirn mit dem Alter entfalten und wie sie mit dem Gedächtnis zusammenhängen."
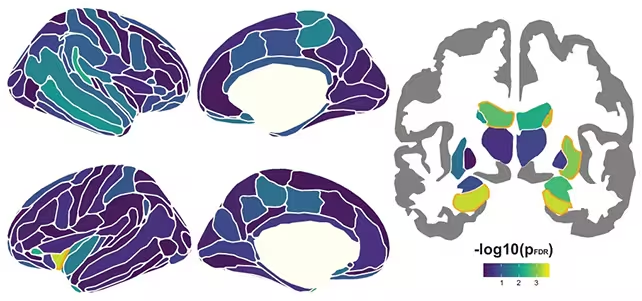
Anatomie des Abbaus und Bedeutung
Was lässt sich daraus ableiten? Erstens: Gedächtnisverlust im höheren Alter ist selten die Folge eines einzelnen versagenden Bereichs. Er spiegelt eine breite biologische Verwundbarkeit wider: ein Muster langsamer Atrophie, das sich über Jahrzehnte ansammelt. Zweitens: Der Zeitpunkt ist wichtig. Derselbe Grad regionaler Schrumpfung scheint nach dem mittleren Lebensalter stärker zu wiegen, was impliziert, dass kleine Verluste früher zu größeren funktionellen Folgen später führen können.
Diese Erkenntnisse haben praktische Konsequenzen für Forschung und Therapie. Behandlungen, die ausschließlich auf eine Struktur abzielen, werden wahrscheinlich nur begrenzten Erfolg haben. Effektive Interventionen müssen wahrscheinlich mehrere Gehirnnetzwerke adressieren — Gewebe schützen, synaptische Gesundheit unterstützen und Entzündungen oder vaskuläre Schäden dort reduzieren, wo sie relevant sind. Die Autorinnen und Autoren der Studie schlagen vor, dass frühe Interventionen vorteilhafter sind als das Abwarten bis zum Auftreten klarer kognitiver Defizite.
Es gibt einen kleinen Hoffnungsschimmer: Weil die Muster zwischen Menschen mit und ohne APOE ε4 weitgehend geteilt sind, könnten viele therapeutische Strategien beiden Gruppen zugutekommen. Anders gesagt: Dieselben zugrunde liegenden Mechanismen scheinen zu wirken, nur in unterschiedlichem Tempo.
Zukünftige Richtungen und Werkzeuge
Groß angelegte MRT-Datensätze wie dieser sind eine Fundgrube für prädiktive Modelle des kognitiven Alterns. Maschinelle Lernverfahren kombiniert mit longitudinalen Bildgebungsdaten und wiederholten Gedächtnistests könnten dazu beitragen, Personen mit erhöhtem Risiko Jahre vor dem Auftreten klinischer Symptome zu identifizieren. Das öffnet die Tür zur Präzisionsprävention — individualisierte Lebensstil- oder pharmakologische Strategien, die auf die anatomische Trajektorie einer Person abgestimmt sind.
Dennoch bleiben Fragen offen. Was treibt die Variabilität zwischen Individuen an? Wie verknüpfen sich vaskuläre Gesundheit, Entzündungsprozesse, Lebensstilfaktoren und Bildung mit genetischen Einflüssen, um diese Gehirntrajektorien zu formen? Und entscheidend: Welche Interventionen verändern tatsächlich die Neigung der Abnahme, anstatt nur ein Symptom zu verlangsamen?
Fachlicher Einblick
Dr. Maya Reynolds, Kognitionsneurowissenschaftlerin und Spezialistin für Altersforschung, kommentiert: "Diese integrative Arbeit verändert unsere Perspektive auf Gedächtnisverlust. Er ist kein isoliertes Versagen, sondern eine systemische Vulnerabilität. Das verschiebt den Fokus von Einzelsubstanz-Medikamenten hin zu multidimensionalen Strategien — von Kontrolle vaskulärer Risikofaktoren und Bewegung über Schlafhygiene bis zu gezielter Neuroprotektion. Frühe Bewertung und anhaltende Interventionen könnten über Jahrzehnte hinweg einen echten Unterschied machen."
Während Forschende tiefer in die biologischen Pfade hinter Gehirnatrophie und episodischem Gedächtnisabbau eintauchen, wird der Weg zu wirksamen Maßnahmen klarer: früh erkennen, breit behandeln und Maßnahmen an individuellen Risikoprofilen ausrichten. Das Ziel ist, das Altern nicht als unausweichlichen Rutsch in Vergesslichkeit erscheinen zu lassen, sondern als Prozess, der gesteuert und in vielen Fällen deutlich verzögert werden kann.
Technische Details zur Bildgebung und Analyse
Die Studie stützte sich auf strukturelle Magnetresonanztomographie (MRT) mit standardisierten Volumenmessungen verschiedener Hirnregionen, einschließlich Hippocampus, präfrontaler Kortices, Temporallappen und parietaler Bereiche. Solche volumetrischen Analysen nutzen automatisierte Segmentierungsalgorithmen, um regionales Gewebevolumen und Veränderungen über Zeitpunkte hinweg zu quantifizieren. Für robuste Schlussfolgerungen wurden Altersverteilung, Bildungsgrad und scannerbedingte Unterschiede statistisch kontrolliert.
Die longitudinalen Modelle erlaubten die Abschätzung individueller Abfallraten (sogenannter Slopes) sowie die Identifikation gemeinsamer Muster in der Kohorte. Darüber hinaus wurden Subgruppenanalysen nach APOE-Status durchgeführt, um genetische Moderationseffekte zu prüfen. Diese Methodenkombination steigert die Aussagekraft gegenüber Querschnittsstudien, weil sie zeitliche Dynamik und intraindividuelle Veränderungen berücksichtigt.
Biologische Mechanismen und Wechselwirkungen
Mehrere biologische Prozesse tragen vermutlich zum beobachteten Muster bei:
- Neuronaler Verlust und synaptische Degeneration: Mikroskopische Verluste an Synapsen und Nervenzellen führen langfristig zu volumetrischem Gewebeverlust in mehreren Regionen.
- Vaskuläre Faktoren: Mikroinfarkte, Gefäßsteifigkeit und reduzierte Durchblutung können lokale Atrophie fördern und die Resilienz gegen neurodegenerative Prozesse mindern.
- Chronische Entzündung (Neuroinflammation): Anhaltende Aktivierung von Immunzellen im Gehirn kann Gewebe schädigen und synaptische Funktionen beeinträchtigen.
- Proteinaggregation und Alzheimer-Pathologie: Bei manchen Personen beschleunigen amyloide Plaques und Tau-Pathologie den regionalen Abbau, wobei APOE ε4 das Risiko und die Progression moduliert.
Diese Mechanismen sind nicht unabhängig: vaskuläre Schädigung kann Entzündungen fördern, und genetische Risikofaktoren können die Empfindlichkeit gegenüber anderen Stressoren erhöhen. Deshalb sind multimodale Ansätze, die mehrere Pathways adressieren, plausibel und werden durch die Daten untermauert.
Praktische Empfehlungen und Prävention
Welche praktischen Schritte lassen die Erkenntnisse zu? Auf Bevölkerungsebene und individuell lassen sich mehrere evidenzbasierte Maßnahmen ableiten:
- Vaskuläre Risikokontrolle: Blutdruck-, Blutzucker- und Cholesterinkontrolle reduzieren vaskuläre Schäden und unterstützen kognitive Gesundheit.
- Bewegung und körperliche Aktivität: Regelmäßige Aerobic- und Krafttrainingseinheiten korrelieren mit größerer Hirnreserve und langsamerer Atrophie.
- Ernährung: Mediterrane Kostmuster, reich an Omega-3-Fettsäuren, Antioxidantien und Ballaststoffen, stehen im Zusammenhang mit besserer kognitiver Gesundheit.
- Schlafqualität: Guter Schlaf ist entscheidend für synaptische Homöostase und Clearance neurotoxischer Proteine.
- Kognitive Aktivität und soziale Teilhabe: Stimulierung durch Lernen, Hobbys und soziale Interaktion fördert neuronale Netzwerke.
- Frühe Screenings: MRT-basierte Frühwarnmarker kombiniert mit kognitiven Tests könnten Hochrisikopersonen identifizieren, die von präventiven Maßnahmen profitieren.
Diese Empfehlungen zielen auf multiple Pfade ab und harmonieren mit dem Studienbefund, dass multifaktorieller Schutz mehrversprechender ist als Einzelsubstanz-Ansätze.
Implikationen für Forschung und Arzneimittelentwicklung
Für die Medikamentenentwicklung bedeutet das, dass Kombinationstherapien oder multimodale Behandlungsstrategien an Bedeutung gewinnen. Ansätze, die neuroinflammation dämpfen, vaskuläre Gesundheit verbessern und synaptische Funktion stützen, könnten synergistische Effekte zeigen. Zudem sollten klinische Studien zunehmend endpunktorientierte Biomarker nutzen — strukturelle MRT-Maße, Flüssigbiomarker (z. B. Blut- oder Liquor-Proteine) und standardisierte kognitive Testbatterien — um Wirkungen auf die Krankheitsprogression frühzeitig zu erkennen.
Machine-Learning-Modelle, die multimodale Daten integrieren, können helfen, Patientengruppen zu stratifizieren und maßgeschneiderte Interventionspläne zu entwickeln. Solche Modelle müssen jedoch transparent, reproduzierbar und klinisch validiert sein, bevor sie routinemäßig eingesetzt werden können.
Offene Fragen und Forschungsprioritäten
Wichtige offene Fragen, die zukünftige Forschung priorisieren sollte, umfassen:
- Die kausalen Beziehungen zwischen vaskulären, entzündlichen und neurodegenerativen Mechanismen.
- Wann im Lebensverlauf präventive Maßnahmen maximal wirksam sind und wie lange Interventionen aufrechterhalten werden müssen.
- Welche Biomarker am besten prognostizieren, wer auf welche Interventionen anspricht (Biomarker-gesteuerte Behandlung).
- Wie sozioökonomische Faktoren und Zugang zu Gesundheitsversorgung die Umsetzung von Präventionsstrategien beeinflussen.
Die Beantwortung dieser Fragen erfordert langfristige, multizentrische Studien mit diverser Stichprobenbasis sowie die Integration von Genetik, Bildgebung, klinischen und Lebensstildaten.
Schlussbetrachtung
Die Arbeit der Forscherinnen und Forscher aus Oslo und den beteiligten Kohorten verschiebt den Fokus weg von einer rein regionalen Sicht des Gedächtnisverlusts hin zu einem integrierten, netzwerkbasierten Verständnis. Für Kliniker, Forschende und die Öffentlichkeit bedeutet das: Früherkennung, breit angelegte Prävention und individualisierte Strategien sind die erfolgversprechenden Wege, um das Risiko eines dramatischen Gedächtnisabfalls im Alter zu reduzieren.
Die Forschung zeigt, dass Altern nicht zwangsläufig mit einem unabwendbaren Verlust an Erinnerungsfähigkeit einhergehen muss. Mit gezielten Maßnahmen — von Lebensstiländerungen bis zu potenziellen kombinierten Therapien — besteht realistische Aussicht darauf, die Geschwindigkeit des Abbaus zu verzögern und die Lebensqualität im höheren Alter zu erhalten.
Quelle: sciencealert


Kommentar hinterlassen