6 Minuten
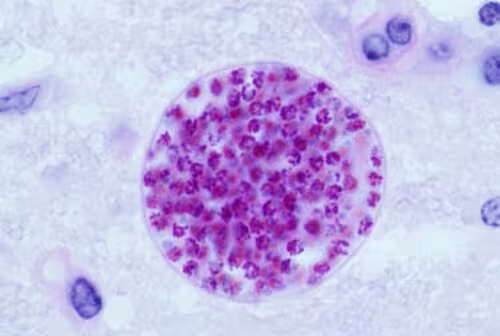
Der Parasit versteckt sich offen sichtbar. Im Gehirn von Mäusen, die Wochen lang infiziert sind, ruht Toxoplasma gondii nicht einfach still; die Population differenziert sich. Neue Forschungen zeigen, dass Zysten, die 28 Tage nach der Infektion gewonnen wurden, eine deutlich reichhaltigere Mischung von Parasiten-Subtypen enthalten als jene, die in der frühen, akuten Phase der Infektion beobachtet werden.
Diese frühe Phase ist ausgesprochen dynamisch. Während der ersten Woche wechseln Parasiten in einen schneller wachsenden Modus, eine Art Sprint, der ihre Verbreitung begünstigt. Doch die Geschichte endet nicht mit einem einzigen, sauberen Übergang. Nach diesem Wachstumsschub treten viele Parasiten in langsam wachsende Formen über, die offenbar auf das langfristige Erhalten von Zysten spezialisiert sind. Die Population innerhalb einer Zyste gleicht eher einem Ökosystem als einer homogenen Art, die stufenweise durch festgelegte Schritte wandert.
Aus immunologischer und parasitologischer Sicht ist diese Diversität bedeutsam: verschiedene Subtypen zeigen unterschiedliche Stoffwechselprofile, Proliferationsraten und Empfindlichkeiten gegenüber Wirtsabwehrmechanismen. Das bedeutet, dass das Verhalten einzelner Parasiten innerhalb derselben Zyste variieren kann, abhängig von ihrer inneren Genregulation, lokalen Mikroumgebung und Interaktionen mit Immunzellen.
Die Erkenntnis, dass intrazystische Heterogenität existiert, verändert die Art, wie Forscher über Persistenz und Pathogenese bei Toxoplasmose denken. Sie zwingt dazu, Modelle der Lebenszyklusdynamik zu überarbeiten und neue experimentelle Ansätze zu entwickeln, die nicht nur mittlere Populationseigenschaften messen, sondern Einzeller- und Subpopulationsebene berücksichtigen.
Studie und Folgen
Wilson und Kolleginnen und Kollegen argumentieren, dass das klassische Lehrbuchbild — eine lineare, stufenweise Reifung von einem einheitlichen Stadium ins nächste — nicht mehr zu den beobachteten Daten passt. Ihre Analyse, veröffentlicht in Nature Communications, zeichnet einen komplexeren Reifungsprozess nach, in dem mehrere Wachstumsstrategien koexistieren und sich im Zeitverlauf verändern. Einfach ausgedrückt: Reifung ist keine gerade Linie.
Methodisch stützt sich moderne Forschung in diesem Bereich zunehmend auf Einzelzellanalyse, Transkriptomik, Proteomanalysen und metabolische Profilierung, kombiniert mit klassischen histologischen Techniken im Mausmodell. Solche Methoden erlauben es, molekulare Signaturen einzelner Parasiten zu identifizieren, Entwicklungswege nachzuzeichnen und Subpopulationen innerhalb einer Zyste zu definieren. Obwohl die Studie von Wilson et al. nicht alle denkbaren Techniken im Detail beschreibt, ist die Interpretation konsistent mit Beobachtungen, die aus hochauflösenden molekularen Analysen hervorgehen.
Warum ist das relevant? Weil die Biologie von Zysten die Grundlage für chronische Infektion, immunologische Umgehung (Immunevasion) und das Risiko einer Reaktivierung bildet. Wenn Zysten unterschiedliche Parasitentypen beherbergen, die verschiedene metabolische Strategien und Wachstumsverhalten zeigen, können Therapien, die auf ein einziges Lebensstadium abzielen, wichtige Subpopulationen verfehlen. Impfstoffe und Medikamente, die einen starren Zyklusmodell annehmen, könnten deshalb weniger effektiv sein als erwartet.
Darüber hinaus hat intrazystische Diversität Auswirkungen auf die Anfälligkeit gegenüber Immunmechanismen wie Mikroglia-Aktivierung, CD8+-T-Zell-Antworten oder IFN-gesteuerter zellulärer Abwehr. Unterschiedliche Parasiten innerhalb derselben Zyste könnten unterschiedlich auf entzündliche Signale reagieren oder sich in mikroumgebungsbedingte Ruhemodi zurückziehen, was das vollständige Eliminieren der Persistenz erschwert.
Die Frage der Reaktivierung ist klinisch bedeutsam: Menschen mit geschwächtem Immunsystem (beispielsweise Organtransplantierte oder Personen mit HIV) tragen das Risiko, dass bradyzoitenreiche Zysten wieder Tachyzoiten produzieren, die akute Erkrankungen verursachen. Wenn Zysten eine heterogene Zusammensetzung haben, könnte das Reaktivationsrisiko variieren — je nachdem welche Subpopulationen dominieren und wie diese auf immunsuppressive Zustände reagieren.
Therapeutisch gesehen geht es folglich nicht nur darum, die hochproliferative Phase (Tachyzoiten) zu treffen, sondern auch jene metabolisch veränderten, langsam wachsenden Formen (Bradyzoiten) innerhalb von Zysten. Forschung und Entwicklung von Wirkstoffen müssen daher Subpopulationsresistenz, Stoffwechselanpassungen und mögliche Schutzmechanismen der Zystenhülle berücksichtigen. Neue Wirkstoffstrategien könnten Kombinationstherapien, Targeting von Stoffwechselwegen oder Ansätze zur Störung der Zystenintegrität umfassen.
Die Studie regt außerdem an, experimentelle Modelle so zu erweitern, dass intra-zystische Heterogenität systematisch kartiert wird: zeitliche Serien auf Einzelzell-Ebene, räumliche Kartierungen innerhalb des Gehirnparenchyms und funktionelle Tests, die die Empfindlichkeit verschiedener Subtypen gegenüber Immunfaktoren und Arzneimitteln messen.
Wissenschaftlich verschiebt diese Arbeit den Fokus weg von starren, phasischen Lebenszyklusmodellen hin zu konzeptionellen Rahmen, die evolutionäre und ökologische Prinzipien einbeziehen: Selektion innerhalb einer Zyste, Nischenbildung und Koexistenz verschiedener Lebensstrategien. Solche Perspektiven lassen sich mit Theorien aus der Mikrobiologie und Ökologie verbinden, um besser zu verstehen, wie Parasiten langfristig in einem Wirtsorganismus persistieren.
Für die Grundlagenforschung ergeben sich mehrere konkrete Fragestellungen: Welche genetischen und epigenetischen Mechanismen steuern den Übergang zwischen schnell und langsam wachsenden Formen? Welche metabolischen Pfade sind in bradyzoitischen Subpopulationen aktiv, und lassen sie sich pharmakologisch angreifen? Wie stabil sind Subpopulationen innerhalb einer Zyste über Monate oder Jahre, und wie reagieren sie auf Stresssignale des Wirts?
Auf methodischer Ebene sind longitudinal angelegte Studien, die Mäuse über verlängerte Zeiträume verfolgen und Zysten in verschiedenen Stadien analysieren, besonders aufschlussreich. Ergänzend können in vitro-Modelle helfen, Mechanismen zu entwirren, während in vivo-Analysen die Bedeutung im physiologischen Kontext bestätigen. Idealerweise kombiniert man molekulare Signaturen mit funktionellen Assays, um eine Verbindung zwischen Genexpression, Stoffwechselzustand und Überlebensfähigkeit herzustellen.
Die klinische Relevanz dieser Forschung liegt in der potenziellen Verbesserung von Diagnose, Prävention und Behandlung der Toxoplasmose. Beispielsweise könnten Biomarker für intra-zystische Heterogenität als prognostische Indikatoren dienen oder als Surrogat für das Ansprechen auf Therapien genutzt werden. Im Bereich Impfstoffentwicklung kann das bewusste Einbeziehen mehrerer Lebensstadien beziehungsweise antigenetischer Profile die Schutzwirkung erhöhen.
Insgesamt zwingt die Entdeckung einer differenzierten Zystenbiologie die Forschung, bestehende Paradigmen zu hinterfragen und multidisziplinäre Ansätze zu verfolgen. Dabei spielen Parasitologen, Immunologen, Pharmakologen und Bioinformatiker eine gemeinsame Rolle: Nur durch kombinierte Expertise lassen sich die molekularen Grundlagen intrazellulärer Vielfalt aufdecken und in therapeutische Strategien übersetzen.
Während Wissenschaftler die Karte von Toxoplasmas verborgenen Phasen neu zeichnen, beginnt die Suche nach Interventionen, die diese Diversität berücksichtigen und möglicherweise sogar gezielt ausnutzen können. Das Ziel ist eine gezieltere, robustere Bekämpfung chronischer Toxoplasmose, die sowohl die akuten als auch die persistierenden Formen adressiert und so das Risiko einer Reaktivierung reduziert.
Für die Weiterentwicklung des Feldes sind mehrere nächste Schritte naheliegend: größere Stichproben, standardisierte Methoden zum Vergleich zwischen Studien, und die Entwicklung von Plattformen zur Integration von Transkriptom-, Proteom- und Metabolomdaten. Solche integrierten Datensätze werden helfen, konsistente, reproduzierbare Signaturen für Subpopulationen innerhalb von Zysten zu identifizieren.
Schließlich eröffnen diese Erkenntnisse auch philosophische Überlegungen zur Definition von Entwicklungsstadien bei intrazellulären Parasiten: Ist es sinnvoll, starre Kategorisierungen zu verwenden, oder sollte man flexiblere, kontinuum-basierte Modelle bevorzugen, die physiologische Heterogenität und Mikroumgebungsabhängigkeit besser abbilden? Die Antwort wird die experimentelle Ausrichtung und die Entwicklung von Gegenmaßnahmen maßgeblich beeinflussen.
Quelle: sciencealert

Kommentar hinterlassen