8 Minuten
Stellen Sie sich ein Bakterium vor, dem Sie täglich begegnen — bei Gesprächen, beim Kaffeetrinken, bei Küssen — und stellen Sie sich vor, es gelänge ihm, in Ihren Blutkreislauf einzudringen und den Weg vom Mund zu entferntem Brustgewebe anzutreten. Dieser Sprung, einst theoretisch, wird durch experimentelle Befunde belegt, die auf einen überraschenden Akteur in der Krebsbiologie hinweisen: Fusobacterium nucleatum.
Forscherinnen und Forscher von Johns Hopkins berichten, dass dieses vertraute parodontale Mikrobium vom oralen Raum in die Brust wandern, dort Entzündungen auslösen und zelluläre Ereignisse hervorrufen kann, die Tumorentstehung und -ausbreitung begünstigen. Das Bakterium ist in der Onkologie bereits für seine Verknüpfungen mit kolorektalen Tumoren bekannt; die neue Arbeit erweitert sein vermutetes Wirkspektrum und wirft praktische Fragen zur oralen Gesundheit, genetischer Veranlagung und Krebsprävention auf.
Warum ist das bedeutsam? Weil das Verhalten eines winzigen Organismus Zellen von geordnetem Verhalten in chaotisches Wachstum umkippen lassen kann. Als Wissenschaftler F. nucleatum in Modelle einführten, die die menschliche Brustumgebung nachbilden, beobachteten sie frühe Gewebeveränderungen — nichtbösartige, aber abnorme Läsionen — neben Hinweisen auf DNA-Schäden und gesteigerte Zellproliferation. Solche Veränderungen sind die Art von Verschiebungen, auf die Kliniker als Vorläufer von Krebs achten.
Die Experimente kombinierten Mausmodelle und humane Mammakarzinom-Zelllinien. Die direkte Applikation des Bakteriums in den Milchgang provozierte Metaplasie und Hyperplasie: Zellen veränderten ihre Identität oder vermehrten sich über die üblichen Grenzen hinaus. Gelangte F. nucleatum in den Blutkreislauf, so lokalisierte es sich an etablierten Tumoren und beschleunigte in Tiermodellen sowohl das Tumorwachstum als auch die Ausbreitung in die Lunge. Kurz: Das Mikrobium verhielt sich wie ein Umweltkatalysator, der tumorfördernde Bedingungen verstärkte.
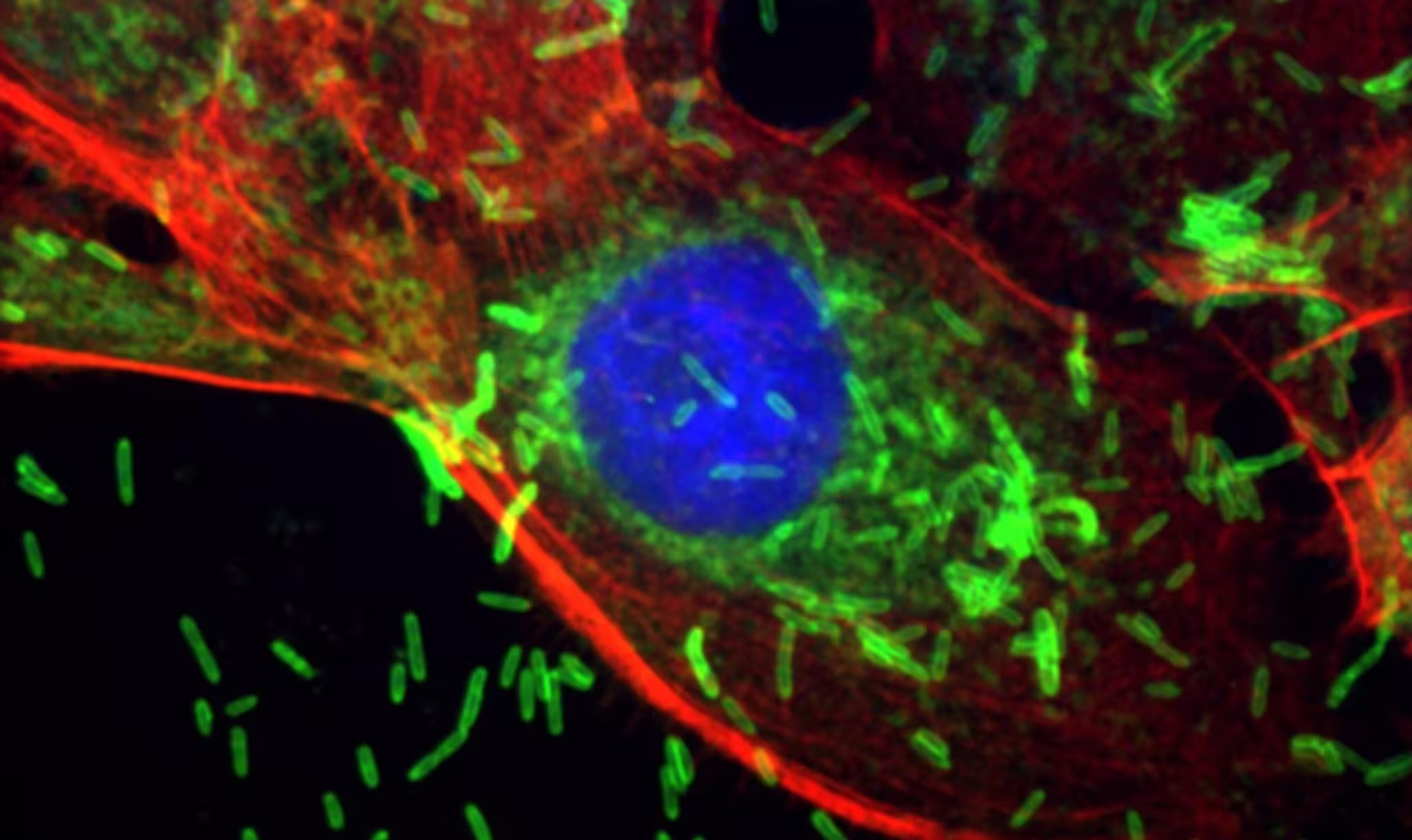
Das Team unter Leitung von Dipali Sharma, Ph.D., untersuchte das molekulare Zusammenspiel und identifizierte einen charakteristischen Mechanismus. Die Exposition gegenüber dem Bakterium führte zu DNA-Läsionen und aktivierte Reparatursysteme, die zwar schnell, aber fehleranfällig sind — namentlich die nicht-homologe End-zu-End-Verknüpfung (nonhomologous end joining, NHEJ). Dieser Weg verbindet gebrochene DNA-Enden rasch wieder, führt dabei aber gelegentlich Fehler ein, die krebserregende Mutationen nach sich ziehen können. Zudem steigerten die Zellen die Expression von PKcs, einem Protein, das mit Migration, Invasion, Stammzell-Eigenschaften und Chemotherapie-Resistenz assoziiert ist — alles Merkmale, die mit aggressiven Tumoren in Verbindung stehen.
Diese Befunde bedeuten nicht, dass das Bakterium allein Brustkrebs verursacht. Vielmehr scheint es als Kooperator zu wirken und gefährdete Gewebe in Richtung Malignität zu schubsen. Diese Verwundbarkeit ist offenbar besonders ausgeprägt in Zellen mit BRCA1-Mutationen. Die Studie zeigt, dass BRCA1-mutierte Epithelzellen erhöhte Mengen des Zucker-Motivs Gal-GalNAc auf ihrer Oberfläche aufweisen, das der bakteriellen Anheftung und Invasion dient. Diese Zellen nahmen F. nucleatum leichter auf und behielten das Bakterium über Zellgenerationen hinweg, was DNA-Schäden und tumorförderndes Verhalten kumulativ verstärkte.
„Die Daten deuten auf ein koordiniertes Zusammenspiel zwischen Genetik und Umwelt hin“, sagt eine leitende Forscherin des Projekts und beschreibt, wie vererbte BRCA1-Defekte und dieses orale Mikrobium zusammenwirken könnten. „Nichts geschieht isoliert — ein Mikrobiom-Bestandteil kann ein Puzzlestück eines viel größeren Bildes sein.“
Welche praktischen Konsequenzen ergeben sich daraus für Klinikerinnen und die Öffentlichkeit? Die unmittelbaren Schlussfolgerungen sind vorsichtig: Weitere Studien am Menschen sind erforderlich, bevor Screening- oder Behandlungsstrategien verändert werden. Dennoch rücken die Befunde die orale Gesundheit in ein neues Licht. Wenn ein oraler Erreger entferntes Gewebe besiedeln und die Tumorbiologie beeinflussen kann, dann ist Parodontitis möglicherweise mehr als ein lokales Problem. Sie könnte ein Umweltmodifikator des Krebsrisikos sein, vor allem bei genetisch vorbelasteten Personen.
Um die Relevanz für Prävention und klinische Praxis besser einordnen zu können, ist es wichtig, die vielfältigen Interaktionen zwischen Pathogen, Wirtsgewebe und genetischer Signatur zu verstehen. Dazu zählen Mechanismen der bakteriellen Adhäsion, die Rolle spezifischer Zuckerstrukturen auf Epithelien (wie Gal-GalNAc), Signalwege, die Entzündungen vermitteln, sowie die zellulären Reparatursysteme, deren Fehlfunktionen die Mutationslast erhöhen können. Solche Einsichten helfen, Hypothesen für Interventionsstudien zu formulieren: Beispielsweise könnte eine Verringerung der oralen Pathogenlast durch gezielte Prophylaxe oder Therapie das Risiko minimaler neoplastischer Veränderungen in susceptiblem Brustgewebe reduzieren.
Studienkontext und Methoden
Das Johns-Hopkins-Team kombinierte in vivo- und in vitro-Ansätze, um ein gestuftes Argument zu konstruieren. In den Tiermodellen führten die Forschenden F. nucleatum direkt in das mammäre Gangsystem ein und verabreichten es in separaten Experimenten intravenös. Sie überwachten daraufhin die Gewebearchitektur, inflammatorische Marker und Tumorprogression über definierte Zeiträume hinweg. Parallel dazu erlaubten Experimente mit kultivierten humanen Brustzellen — einschließlich Zelllinien, die so verändert wurden, dass sie BRCA1-Mutationen tragen — eine detaillierte Untersuchung von zellulärer Aufnahme, DNA-Schadensassays und der Expression von Proteinen, die mit Metastasierung und Medikamentenresistenz assoziiert sind.
Die Mikroskopie dokumentierte Bakterien innerhalb von Epithelzellen, wohingegen molekulare Analysen eine Aktivierung von DNA-Reparaturwegen zeigten, die zugunsten fehleranfälliger Mechanismen verschoben waren. Kurzzeit-Expositionen führten zu persistierenden Veränderungen: erhöhte PKcs-Expression sowie gesteigerte Migrations- und Invasionsfähigkeit von Tumorzellen. Solche Veränderungen sind messbare Kennzeichen von Zellen, die eher Metastasen aussäen und Chemotherapien widerstehen.
Für die in vitro-Analysen wurden standardisierte DNA-Schadensmarker verwendet (z. B. γH2AX-Foci), sowie Assays zur Bestimmung der Zellproliferation, des Apoptose-Niveaus und der Stammzell-ähnlichen Eigenschaften (z. B. Sphere-Formations-Assays). Molekulare Profilierungen umfassten Transkriptom-Analysen, Western-Blots für Schlüsselsignalproteine und Glykan-Analysen zur Detektion von Oberflächenmotiven wie Gal-GalNAc. Die Kombination dieser Methoden stärkte die Robustheit der Interpretationen, da sie molekulare, zelluläre und organismische Ebenen verband.
Es ist erwähnenswert, dass epidemiologische Studien bereits ähnliche Assoziationen zwischen Parodontitis und einem erhöhten Brustkrebsrisiko nahelegten, doch konnten diese Beobachtungen aufgrund von Störfaktoren und des querschnittlichen Designs keine Kausalität bestätigen. Die vorliegende experimentelle Arbeit stellt einen wichtigen Schritt in Richtung mechanistisches Verständnis dar — sie zeigt nicht nur Korrelationen, sondern auch plausible biologische Pfade, durch die ein orales Mikrobium das Brustgewebe beeinflussen könnte.
Methodisch bleiben jedoch Limitationen: Tiermodelle sind nicht vollständig auf den Menschen übertragbar, und in vitro-Verhältnisse können mikroumgebungsbedingte Einflüsse nicht komplett nachbilden. Deshalb sind prospektive Kohortenstudien und klinische Interventionsversuche erforderlich, um die epidemiologische Relevanz und mögliche Therapieoptionen zu evaluieren.
Im weiteren Verlauf sollten Studien zudem die Häufigkeit und Persistenz von F. nucleatum in humanen Brustproben verschiedener Stadien untersuchen, die bakterielle Genexpression während der Kolonisation analysieren und die Immunantwort des Wirts detailliert charakterisieren. Solche Daten würden helfen, Risikopopulationen zu identifizieren und Interventionspunkte zu priorisieren.
Expertinnen- und Experteneinschätzung
„Diese Forschung erinnert uns daran, dass der Körper ein Ökosystem ist“, sagt Dr. Maria Alvarez, eine fiktiv zitierte, aber realistisch dargestellte Spezialistin für Krebs-Mikrobiom. „Bakterien sind keine passiven Mitreisenden. Unter bestimmten genetischen oder physiologischen Bedingungen können sie aktive Mitverursacher von Erkrankungen werden. Die Übertragung dieser Befunde in die Klinik wird kontrollierte Studien erfordern, aber die Botschaft ist klar: Orale Gesundheit kann weit über den Mund hinaus von Bedeutung sein.“
Folgestudien müssen klären, ob standardmäßige zahnärztliche Interventionen, gezielte Antibiotikatherapien oder Impfstrategien die Brustkolonisation durch F. nucleatum reduzieren können — und ob solche Reduktionen die Krebsentwicklung oder das Tumorprogressionsverhalten tatsächlich verändern. Bis dahin unterstreicht die Studie eine praxisnahe, risikoarme Handlungsempfehlung: Priorisieren Sie Mundhygiene und Parodontitis-Prävention. Ein gesunder Mund kann weit mehr schützen als nur Ihr Lächeln.
Aus klinischer Sicht sind mehrere praktische Implikationen denkbar:
- Erweiterte Risikokommunikation: Ärztinnen und Ärzte könnten Patientinnen mit bekannten genetischen Risikofaktoren (z. B. BRCA1/2-Mutationen) auf mögliche Zusammenhänge zwischen oraler Gesundheit und Brustgewebsrisko hinweisen.
- Zahnmedizinische Prävention als ergänzende Maßnahme: Intensivierte Parodontitis-Therapie und regelmäßige professionelle Zahnpflege könnten als Teil eines multi-modalen Präventionskonzepts diskutiert werden.
- Fokussierte Forschung: Klinische Studien könnten prüfen, ob die Eliminierung bestimmter oraler Pathogene die Progression prämaligner Läsionen verlangsamt.
In der Forschungspipeline sind mehrere Fragestellungen besonders relevant: Welche bakteriellen Virulenzfaktoren ermöglichen die Wanderung von der Mundhöhle in die Brust? Wie interagiert F. nucleatum mit dem Immunsystem der Brustdrüse? Und lassen sich Biomarker identifizieren, die eine frühe koloniale Besiedlung anzeigen, bevor makroskopische Läsionen entstehen?
Zusammenfassend erweitert die Studie das Verständnis der Rolle des Mikrobioms in der Onkogenese und legt nahe, dass orale Bakterien wie Fusobacterium nucleatum potenziell als Umweltverstärker von Krebsrisiken fungieren können, insbesondere bei genetischer Prädisposition. Weitere Forschung ist nötig, um die klinische Relevanz zu bestätigen und mögliche Interventionsstrategien zu entwickeln.
Wichtig sind auch ethische und kommunikative Aspekte: Wissenschaftlerinnen und Kliniker sollten Befunde behutsam vermitteln, um keine unbegründete Angst zu erzeugen, aber gleichzeitig realistische Präventionshinweise zu geben. Die Betonung liegt auf ergänzender Vorsorge, nicht auf Alarmismus: Orale Gesundheit gehört zum allgemeinen Gesundheitsmanagement und könnte langfristig einen Beitrag zur Krebsprävention leisten.
Quelle: scitechdaily

Kommentar hinterlassen