8 Minuten
Stellen Sie sich einen Wartesaal vor, in dem die Blutgruppe nicht mehr darüber entscheidet, wer schnell eine Niere erhält. Genau diese Aussicht eröffnet ein aktueller Laborfortschritt: Forschende haben eine Niere des Typs A in ein sogenanntes enzymkonvertiertes Typ-O-Organ verwandelt — im Kern handelt es sich um eine Niere, der die Zuckerstrukturen entfernt wurden, die sie als A erkennbar machen. Das Ziel ist einfach und zugleich enorm: die Verträglichkeit zu erweitern, damit mehr Patientinnen und Patienten früher transplantiert werden können.
Wie die Umwandlung funktioniert und was Wissenschaftler getestet haben
Blutgruppen beruhen auf winzigen Zuckerbausteinen, so genannten Antigenen, die die Oberfläche von Zellen und Geweben zieren. Das Immunsystem "liest" diese molekularen Namensschilder mit Antikörpern. Trifft es auf ein Schild, das es als fremd erkennt, kann es zur Abstoßung kommen. Das Team nutzte Enzyme — molekulare Scheren, die gezielt bestimmte Zuckerreste abschneiden — um die antigenen Teile der A-Ketten abzutragen. Sobald diese Zucker entfernt sind, wirkt die Organoberfläche faktisch frei von ABO-Antigenen und ähnelt profilmäßig einer Blutgruppe O.
Das ist kein rein theoretisches Experiment. Eine Kooperation aus Kanada und China bereitete eine enzymkonvertierte Typ-O-Niere (ECO) vor und verpflanzte diese in den Körper einer hirntoten Spenderperson, deren Organe für Forschungszwecke freigegeben worden waren. Das Organ funktionierte über mehrere Tage und zeigte filtrierende Nierenfunktion, Harnproduktion und erste Hinweise auf Stoffwechselregulationen.
Perfekt war das Ergebnis nicht. Ab dem dritten Tag traten Spuren der ursprünglichen A-Markierungen wieder auf, und es zeichnete sich eine Immunantwort ab. Dennoch fiel die Reaktion milder aus als ursprünglich befürchtet, was darauf hindeutet, dass der enzymatische Eingriff das Immunsystem eher in Richtung Toleranz verschiebt, statt eine vollständige Abstoßungsreaktion auszulösen. Diese Beobachtung ist aus immunologischer Sicht bedeutend, weil sie nahelegt, dass eine partielle oder temporäre Entfernung von Antigenen klinisch relevant sein könnte.
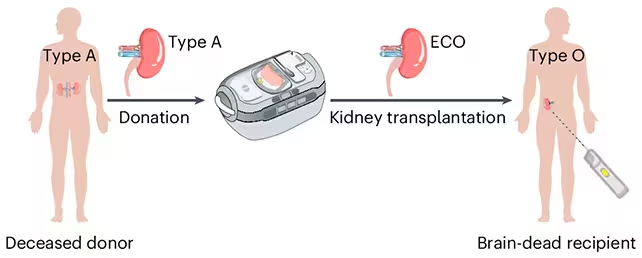
Die Forschenden erzeugten eine enzymkonvertierte Typ-O-Niere (ECO) und bereiteten sie für die Transplantation vor.
Technisch gesehen beruht die Methode auf Glyko-Enzymen, die Alpha-Gal- und N-Acetylgalactosamin-ähnliche Strukturen erkennen und abspalten können. Solche Enzyme wurden bereits in der Glykobiologie charakterisiert, doch die Herausforderung bestand darin, sie in ausreichender Menge, Reinheit und mit geeigneter Aktivität auf einem gesamten Organgewebe anzuwenden, ohne die Gewebearchitektur oder die Funktion der Nierenzellen zu schädigen. Der Umgang mit Perfusionslösungen, Temperaturkontrolle und Enzympenetration in Nierenrinden- und -markregionen spielte eine zentrale Rolle bei der erfolgreichen enzymatischen Behandlung.
Im Experiment arbeiteten die Teams mit perfusionsbasierten Protokollen: Die Niere wurde außerhalb des Körpers über maschinelle Perfusionen mit Enzymlösungen behandelt, um eine gleichmäßige Verteilung zu gewährleisten. Solche ex-vivo-Perfusionstechniken ermöglichen kontrollierte Reaktionszeiten und die genaue Beobachtung von Parametern wie pH-Wert, Osmolarität und glomerulärer Filtrationsleistung, während die enzymatische Modifikation stattfindet.
Warum das wichtig ist und der weitere Weg
Patientinnen und Patienten mit Blutgruppe O stehen am längsten auf Wartelisten, weil O-Organe praktisch für alle Empfängergruppen in Frage kommen: O gilt als universeller Spender für Erythrozyten, und in der Praxis sind O-Nieren mit anderen Blutgruppen kompatibel. Dieses Ungleichgewicht hat tödliche Konsequenzen. Allein in den Vereinigten Staaten sterben schätzungsweise etwa 11 Menschen pro Tag, während sie auf eine Nierentransplantation warten. Viele davon warten explizit auf ein Organ vom Typ O.
Aktuelle Umgehungslösungen existieren bereits. Ärztinnen und Ärzte können die Empfänger desensibilisieren oder Antikörper vor der Transplantation gezielt entfernen — etwa durch Plasmapherese oder immunadsorptive Verfahren —, doch diese Protokolle sind komplex, teuer und mit Risiken verbunden. Zudem erfordern sie häufig lebende Spender und eine Vorbereitungszeit, die bei Verstorbenenspenderorganen nicht gegeben ist. Eine enzymatische Umwandlung von Spenderorganen könnte die Situation verändern, indem sie den Pool nutzbarer Organe von Verstorbenenspendern deutlich erweitert, ohne lange Vorbereitungszeiten am Empfänger zu benötigen.
Mehrere wissenschaftliche und klinische Herausforderungen bleiben jedoch offen. Die erneute Expression der Antigene nach wenigen Tagen könnte mehrere Ursachen haben: unvollständige Entfernung beim ersten Eingriff, schneller Oberflächenumsatz von Glykoproteinen durch zelluläre Erneuerungsprozesse oder eine immunvermittelte Regeneration der Zuckerreste. Die langfristige Haltbarkeit der Konversion, mögliche Nebenwirkungen der eingesetzten Enzyme und das Risiko unbeabsichtigter Gewebeveränderungen müssen in systematischen Studien untersucht werden. Darüber hinaus sind regulatorische Hürden, Herstellungs- und Qualitätskontrollprozesse sowie groß angelegte klinische Studien erforderlich, bevor Krankenhäuser diese Technik routinemäßig einsetzen können.
.avif)
Diese Forschung reiht sich neben weiteren Lösungsansätzen ein, um den Organmangel zu lindern: Xenotransplantation mit Schweinenieren, gentechnische Modifikationen von Spenderschweinen, entwickelte Antikörper zur Abschwächung der Abstoßung sowie optimierte Immunsuppressionsregime. Gemeinsam bilden sie einen mehrgleisigen Ansatz gegen ein einziges Problem — zu viele Patienten, zu wenige Organe.
Aus Sicht der translationalen Forschung ist dieser Fortschritt bemerkenswert, weil jahrzehntelange Grundlagenarbeit in der molekularen Glykobiologie nun in ein Modell am Menschen überführt wird. Die enzymatische Chemie, die lange auf Zell- oder Tiermodellen untersucht wurde, wird endlich in einem menschlichen Organ geprüft. Die bisherigen Ergebnisse sind vorläufig, liefern aber eine Richtung: Kompatibilität könnte in Zukunft gezielt erzeugt werden, statt passiv auf passende Spender zu warten.
Welche Konsequenzen hätte eine erfolgreiche Skalierung? Wenn die Enzymkonversion dauerhaft, reproduzierbar und sicher in großem Maßstab möglich wäre, könnte dies erhebliche Auswirkungen auf Wartelisten haben: mehr verfügbare Nieren, kürzere Wartezeiten und weniger vermeidbare Todesfälle. In Ländern mit starkem Ungleichgewicht zwischen Spender- und Empfängergruppen würde sich die Verteilung von Ressourcen verbessern. Darüber hinaus könnte die Technologie wirtschaftliche Effekte haben, weil aufwendige Desensibilisierungsprotokolle seltener nötig wären.
Gleichzeitig sind ethische, rechtliche und soziale Fragen zu klären. Die Manipulation von Spenderorganen berührt Fragen der Einwilligung, des Umgangs mit Verstorbenden und der Transparenz gegenüber Empfängern. Klinische Studien müssen daher nicht nur Sicherheit und Wirksamkeit prüfen, sondern auch ethische Standards beachten, Aufklärungsmaterial bereitstellen und Mechanismen zur Nachverfolgung und Meldung von Langzeitfolgen etablieren.
Wissenschaftlich bleibt viel zu tun: Optimierung der Enzymdosen, Verbesserung der Ex-vivo-Perfusionsbedingungen, Identifikation von Biomarkern zur Vorhersage der Antigennachbildung und Entwicklung kombinierter Strategien, die Enzymbehandlung mit immunmodulatorischen Maßnahmen verbinden. Beispielhafte Forschungsfragen sind:
- Welche Enzymklassen erzielen die gründlichste Entfernung von ABO-Antigenen bei minimaler Gewebeschädigung?
- Wie lange bleibt die antigenfreie Oberfläche funktionell stabil, und welche zellulären Mechanismen treiben die Wiedererlangung der Zuckerreste an?
- Kann eine kombinierte Behandlung mit kurzen Immunsuppressiva die Toleranz weiter fördern, ohne die Risiken langfristiger Unterdrückung zu erhöhen?
Für Patienten und Ärztinnen und Ärzte werden die nächsten Jahre entscheidend sein: umfangreichere klinische Studien, umfassende Sicherheitsbewertungen und strenges Monitoring werden zeigen, ob dieser molekulare Trick in einen echten klinischen Nutzen übersetzt werden kann. Die Translation vom experimentellen Nachweis zum Standardverfahren erfordert standardisierte Herstellungsprozesse, Zulassungen durch Behörden und die Etablierung von Leitlinien durch Transplantationsgesellschaften.
Dieses Forschungsfeld bietet zudem Potenzial für interdisziplinäre Innovationen: Materialwissenschaftler können verbesserte Perfu-sionssysteme entwickeln, Ingenieure automatisierte Bioreaktoren bauen und Datenwissenschaftler prädiktive Modelle für die Antigen-Rückkehr erstellen. Solche Synergien könnten den Weg von der Proof-of-Concept-Studie zur klinischen Anwendung beschleunigen.
Abschließend ist die aktuelle Studie ein Hoffnungsschimmer, kein fertiges Heilmittel. Sie demonstriert, dass eine enzymatische Strategie grundsätzlich funktionieren kann und eröffnet eine realistische Option, die Organverfügbarkeit zu erhöhen. Wenn Enzymkonversion robust, sicher und skalierbar gemacht werden kann, könnte dies die Transplantationsmedizin nachhaltig verändern: weniger Ablehnungen aufgrund von ABO-Inkompatibilität, mehr lebensrettende Transplantationen und letztlich eine verbesserte Gerechtigkeit bei der Verteilung knapper Organe.
Bis es soweit ist, bleibt die Methode ein vielversprechender Nachweis des Prinzips — ein enzymatischer Schnitt nach dem anderen.
Quelle: sciencealert

Kommentar hinterlassen