9 Minuten
Nach mehr als einem Jahrzehnt Laborarbeit berichten Forschende über einen bedeutenden Fortschritt in Richtung Niere, die von Empfängern jeder Blutgruppe angenommen werden könnte. Ein multinationales Team hat Spendernieren in eine antigenfreie Form umgewandelt, die — zumindest vorübergehend — wie ein Organ vom Typ O reagierte, als sie in einem humanen Modell transplantiert wurden. Dieser Schritt könnte helfen, lange Wartelisten für Nierentransplantationen zu verkürzen und Leben zu retten.

Die Niere wird im Labor vorbereitet
Blutgruppengrenzen als technisches Problem lösen
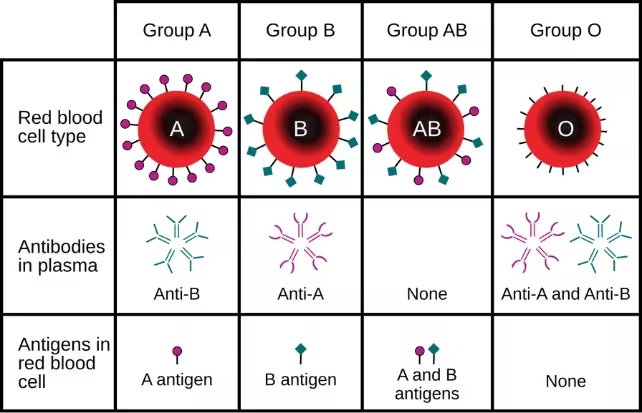
Die Kompatibilität der Blutgruppe ist eines der praktisch schwerwiegendsten Hindernisse bei Nierentransplantationen. Das ABO-Blutgruppensystem setzt eine strikte Grenze dafür, wer welches Spenderorgan erhalten kann: Empfänger mit Blutgruppe O müssen üblicherweise auf einen Spender vom Typ O warten, und Nieren vom Typ O sind besonders gefragt, da sie prinzipiell auch bei Empfängern anderer Blutgruppen funktionieren.
Um dieses Problem zu umgehen, haben Wissenschaftler Enzyme adaptiert, die gezielt die Zuckermoleküle — sogenannte Antigene — an der Oberfläche von Blutzellen und Spendergeweben entfernen. Diese Antigene signalisieren dem Immunsystem, dass etwas fremd ist. Das Forschungsteam setzte diese Enzyme ein, um die Marker der Blutgruppe A an einer gespendeten Niere abzutragen und machte das Organ damit faktisch zu einer enzymkonvertierten Typ-O-Niere (enzyme-converted type-O, ECO).
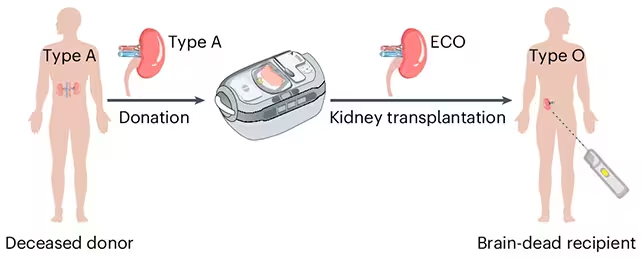
Die Forschenden stellten eine enzymkonvertierte Typ-O-(ECO-)Niere her, die transplantationsbereit war. (Zeng et al., Nat. Biomed. Eng., 2025)
Der Biochemiker Stephen Withers von der University of British Columbia, der im ursprünglichen Bericht zitiert wird, beschreibt die Enzyme wie eine Art molekularer Schere: Sie schneiden die antigenen Zucker ab, die Typ A definieren, und legen so die chemisch neutrale Oberfläche frei, die einem Typ-O-Status entspricht. "Sobald das erledigt ist, erkennt das Immunsystem das Organ nicht mehr als fremd", sagt er und weist darauf hin, dass dies die erste Testung dieser Methode in einem humanen Modell ist.
Technisch handelt es sich dabei meist um spezialisierte Glycosidasen oder verwandte Enzymklassen, die gezielt bestimmte Glykane entfernen. In der Praxis müssen diese Enzyme ausreichend effizient, selektiv und schonend sein, damit die vaskuläre Integrität und die Funktion des Organs nicht beeinträchtigt werden. Solche Details sind entscheidend für die Übersetzung in die klinische Anwendung, da hier sowohl Biokompatibilität als auch regulatorische Anforderungen eine Rolle spielen.
Was die experimentelle Transplantation zeigte — und was nicht
Die konvertierte Niere wurde in einen hirntoten Spender implantiert, der über seine Angehörigen seine Zustimmung zur Forschung gegeben hatte; das Organ funktionierte mehrere Tage in diesem Empfänger. Dieser Funktionszeitraum lieferte Wissenschaftlern wichtige reale Daten darüber, wie das Immunsystem reagiert, wenn die ABO-Marker eines Organs chemisch entfernt wurden.
Die Beobachtungen sind vielschichtig: Kurzfristig zeigte die Niere normale Filtrations- und Hämodynamikparameter, was demonstriert, dass die Enzymbehandlung die primäre Organfunktion nicht sofort zerstörte. Solche Daten sind wertvoll, weil sie Hinweise darauf geben, unter welchen Bedingungen enzymatische Behandlung ex vivo praktikabel wäre — etwa Dauer der Ex-vivo-Behandlung, Temperatur und perfusionsbasierte Anwendungsprotokolle.
Allerdings war die Konversion nicht dauerhaft. Am dritten Tag nach der Transplantation begannen die Typ-A-Marker wieder auf dem Gewebe der Niere aufzutreten und riefen eine Immunantwort hervor. Wichtig ist, dass die Reaktion weniger heftig ausfiel, als man bei einem komplett nicht übereinstimmenden Transplantat erwarten würde; es gab Anzeichen, dass die Biologie des Wirts sich eher in Richtung Toleranz als in Richtung vollständige Abstossung bewegte. Die erneute Expression macht jedoch deutlich, dass ein zentrales Problem ungelöst bleibt: Wie lässt sich die Antigenentfernung so dauerhaft gestalten, dass sie bei lebenden Empfängern routinemäßig anwendbar ist?
Aus immunologischer Sicht ist die Wiederausprägung von Antigenen nicht überraschend: Endothelzellen und andere residente Zellen im Transplantat können neue Glykosylierungsmuster synthetisieren, sobald die enzymatische Wirkung nachlässt. Daher wird in der Forschung geprüft, ob man die Enzyme länger im Gewebe binden, ihre Wirkung wieder auffrischen oder parallel mechanistische Maßnahmen ergreifen kann, die die Neubildung hemmen.
Die Erfahrung aus dem Experiment liefert darüber hinaus Einblicke in Antikörperantworten, Komplementaktivierung und zellvermittelte Immunreaktionen gegen rekurrent auftretende Antigene. Solche Daten können helfen, genauere Modelle zur Vorhersage von Rejektionsrisiken und zur Planung begleitender Immunmodulationen zu entwickeln.
Kontext: Warum dies die Logistik der Nierentransplantation verändern könnte
Der Mangel an Nieren ist drastisch. Allein in den Vereinigten Staaten sterben schätzungsweise etwa 11 Menschen täglich, während sie auf eine Nierentransplantation warten — viele davon benötigen Organe vom Typ O. Aktuelle klinische Strategien zur Überwindung von Blutgruppeninkompatibilität — sogenannte Desensibilisierungsprotokolle — können funktionieren, sind aber zeitaufwendig, risikobehaftet und kostenintensiv. Diese Protokolle erfordern zudem meist, dass der Empfänger bereits bekannt ist, was die Anwendbarkeit bei verstorbenen Spendern einschränkt.
Eine zuverlässige Methode, Spendernieren in eine universelle Form zu überführen, könnte den Pool nutzbarer Organe deutlich erweitern, Wartezeiten verkürzen und die Mortalität auf Wartelisten reduzieren. Außerdem würde dies die Logistik vereinfachen: Statt ABO-Typen zu matchen oder lange Desensibilisierungsmaßnahmen durchzuführen, könnten Kliniker ein Organ ex vivo behandeln und die Transplantation schneller vorantreiben.
Praktisch denkbar wären zentrale Verarbeitungszentren, in denen vermehrt entnommene Nieren enzymatisch bearbeitet, getestet und klassifiziert werden, bevor sie an Transplantationszentren verteilt werden. Solche Zentrallaboratorien würden Qualitätskontrollen, Validierung der Antigenentfernung und engmaschiges Monitoring anbieten — ähnlich den Prozessen in Blutbanken oder Organerhaltungsnetzen, jedoch mit zusätzlicher biochemischer Behandlung.
Darüber hinaus könnte eine universell nutzbare Niere die Priorisierungssysteme in Wartelisten verändern. Derzeit werden Organe häufig nach Kompatibilität und Dringlichkeit zugewiesen. Wenn die Blutgruppenbarriere reduziert wird, könnten andere Kriterien wie HLA-Matching, Dringlichkeit, Wartezeit oder geographische Nähe stärker in den Vordergrund rücken, wodurch sich die gesamte Verteilungslogik ändern würde.
Wissenschaftliche Hürden und nächste Schritte
Mehrere technische und klinische Fragen müssen noch geklärt werden, bevor dieser Ansatz lebenden Patienten angeboten werden kann. Zentrale Fragestellungen sind, wie man die Wiederkehr von Antigenen verhindert, wie Enzymbehandlungen für viele Organe skaliert werden können und wie sichergestellt wird, dass die Konversion keine anderen Verwundbarkeiten einführt — etwa erhöhte Infektionsanfälligkeit oder schädliche Immunaktivierungen.
Forschende erwägen komplementäre Strategien: die Kombination der Antigenentfernung mit gezielter Immunmodulation, die Verbesserung der Enzymwirksamkeit und deren Verweildauer im Gewebe, oder die Kombination der Konversion mit anderen Innovationen wie konstruierten Antikörpern, Chemikalien zum Schutz der Endotheloberfläche oder der Verbindung mit Xenotransplantationsansätzen (zum Beispiel Schweinenieren, die genetisch verändert wurden).
Weitere notwendige Schritte sind longitudinale Studien in Tiermodellen, erweiterte Experimente in humanen Modellen und schließlich streng überwachte frühe klinische Studien. Parallel dazu müssen Protokolle zur Qualitätskontrolle entwickelt werden: Wie misst man zuverlässig die vollständige Entfernung von ABO-Antigenen? Welche funktionellen Tests sind erforderlich, um die Transplantatgesundheit zu bestätigen, bevor eine Transplantation am Menschen erfolgt?
Regulatorische Aspekte sind ebenfalls zu beachten. Behördliche Zulassungen setzen oft umfangreiche Sicherheitsdaten voraus, die Nebenwirkungen, Reproduzierbarkeit und Langzeitfolgen belegen. Zudem spielen ethische Fragen eine Rolle, etwa bei der Verwendung von Organen für experimentelle Behandlungen und der Einwilligung von Spendern oder ihren Angehörigen.
Logistisch stellt sich die Frage, wie eine solche Methode in bestehende Transplantationsnetzwerke integriert werden kann — von der Entnahme über den Transport bis zur Behandlung und Weiterverteilung. Praktische Lösungen könnten mobile Perfusionsgeräte, standardisierte Enzymformulierungen und automatisierte Monitoring‑Systeme umfassen.
Expertinnen- und Experteneinschätzung
"Das ist ein wohlüberlegter, aber aufregender Fortschritt", sagt Dr. Maya Patel, eine Transplantationsimmunologin, die nicht an der Studie beteiligt war. "Die Demonstration kurzfristiger Funktion in einem humanen Modell ist ein wichtiger Meilenstein. Die nächste Aufgabe besteht darin, Persistenz zu konstruieren — sicherzustellen, dass das Antigenprofil nicht Tage oder Wochen später wiederkehrt. Wenn es gelingt, die Konversion dauerhaft zu fixieren oder sie mit selektiver Immunsteuerung zu koppeln, könnte das enorme Auswirkungen auf Wartelisten haben."
Weitere Expertinnen und Experten weisen darauf hin, dass parallel laufende Ansätze — verbesserte Matching‑Algorithmen, erweiterte Nutzung lebender Spender und genetisch modifizierte tierische Organquellen — zusammen eine vielschichtige Strategie gegen den globalen Organmangel darstellen. Die Kombination mehrerer Technologien könnte die Resilienz des Versorgungssystems stärken und die Chancen für Patientinnen und Patienten deutlich verbessern.
Aus wissenschaftlicher Sicht bietet die Studie zudem wertvolle Einblicke in die Grundlagen der Glykobiologie, der Immunantwort gegen transplantierte Gewebe und in mögliche Interventionspunkte, an denen Biotechnologie gezielt eingreifen kann. Solche Einsichten sind wichtig, um übergreifende Lösungen zu entwickeln, die nicht nur die ABO-Barriere adressieren, sondern auch HLA-Inkompatibilitäten und andere immunologische Hürden.
Was das für Patientinnen, Patienten und das Gesundheitssystem bedeutet
Für Patientinnen und Patienten würde eine sichere, verlässliche universelle Niere weniger Monate oder Jahre an Dialyse bedeuten und eine niedrigere Sterblichkeit während der Wartezeit. Dialyse ist zeitaufwendig, beeinträchtigt Lebensqualität und verursacht erhebliche Kosten; eine verlässliche Transplantationsoption könnte daher sowohl individuellen Nutzen als auch systemische Einsparungen bringen.
Für Gesundheitssysteme könnten sich die hohen Kosten von Langzeitdialyse und komplexen Desensibilisierungsverfahren reduzieren. Gleichzeitig könnte die Behandlungsqualität steigen, wenn mehr Patientinnen und Patienten zeitnah mit einem gut funktionierenden Organ versorgt werden. Ökonomische Modelle müssten jedoch die anfänglichen Investitionskosten für Enzymproduktion, spezialisierte Laborinfrastruktur und mögliche zusätzliche Monitoringmaßnahmen berücksichtigen.
Für die Forschung stellt sich eine klare ingenieurwissenschaftliche und immunologische Aufgabe: Wie gelingt es, eine molekulare "Reparatur" so lange zu stabilisieren, dass sie klinisch relevant wird? Das umfasst technische Lösungen zur Langzeitbindung von Enzymen, pharmakologische Ansätze zur Unterdrückung der Neubildung von Antigenen sowie immunologische Feintuning‑Strategien, damit das Immunsystem das Organ akzeptiert, ohne die allgemeine Abwehr zu kompromittieren.
Die Studie, veröffentlicht in Nature Biomedical Engineering, ist ein greifbares Beispiel dafür, wie grundlegende biochemische Forschung auf die Patientenversorgung zugerichtet werden kann. Wie Withers über den Fortschritt des Teams bemerkte: Zu sehen, wie Laborerkenntnisse der klinischen Realität näherkommen, motiviert diese langfristige Forschungsarbeit.
Insgesamt repräsentiert die Forschung einen bedeutenden, wenn auch noch vorläufigen Schritt in Richtung universeller Spenderorgane. Die nächsten Jahre werden zeigen, ob die Kombination aus Enzymtechnologie, gezielter Immunmodulation und verbesserten Versorgungsnetzen tatsächlich zu einer nachhaltigen Lösung des globalen Organmangels beitragen kann.
Quelle: sciencealert

Kommentar hinterlassen