7 Minuten
Sie war eine Marathonläuferin Mitte 30. Dann trat ein hartnäckiges Ziehen im Knie auf, das nicht mehr verschwand. Witze über quietschende Gelenke wichen Röntgenaufnahmen und einer Diagnose: Arthrose im Stadium 2. Diese Geschichte ist heute kein Einzelfall mehr. Kliniker und Forscher beobachten die Erkrankung zunehmend bei jüngeren, aktiven Menschen – und dieser Wandel wirft schwierige Fragen zur Prävention, Diagnostik und langfristigen Betreuung auf.
Warum Arthrose früher auftritt
Die meisten von uns sehen Arthrose als den Preis des Älterwerdens. Doch Alter ist nur ein Faktor. Die Erkrankung entsteht, wenn der Knorpel, der ein Gelenk polstert, verschleißt und Knochen auf Knochen reiben kann. Einfach in der Beschreibung, komplex in der Realität. Adipositas, frühere Gelenkverletzungen (z. B. Kreuzbandriss, Meniskusschäden), repetitive mechanische Belastungen durch Sport oder körperliche Arbeit, chronische Entzündung und metabolische Erkrankungen beschleunigen diesen Prozess. Das Ergebnis ist eine breitere und jüngere Patientengruppe, die mit Schmerzen, Steifheit und den Einschränkungen, die diese Symptome für Arbeit, Familie und Sport bedeuten, konfrontiert ist.
Betrachten Sie die Auswirkungen über die Lebensspanne: Eine Person, bei der mit 35 Jahren Arthrose diagnostiziert wird, könnte Jahrzehnte damit verbringen, Schmerzen zu managen, zwischen Physiotherapie, Injektionen und – mit der Zeit – einem Gelenkersatz zu wechseln. Das ist nicht nur ein orthopädisches Problem. Die Folgen reichen in die psychische Gesundheit, berufliche Entscheidungen, körperliche Fitness und erhöhen das Risiko für Begleiterkrankungen wie kardiovaskuläre Erkrankungen. Deshalb muss der Fokus von Reaktionen im Endstadium hin zu frühzeitiger Erkennung und Prävention verschoben werden, um den weiteren Verlauf positiv zu beeinflussen.
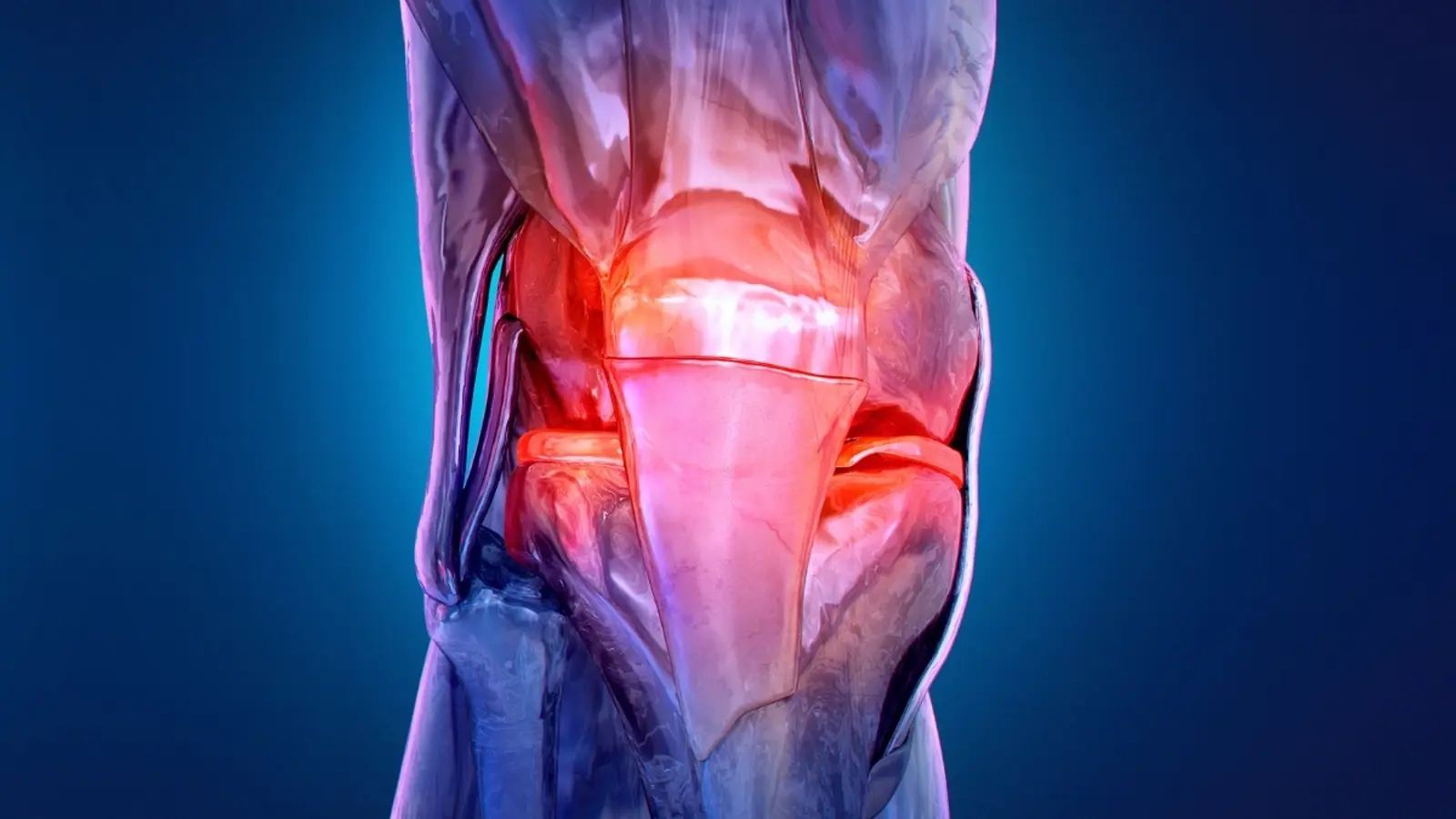
Was im Gelenk passiert
Knorpel wirkt wie ein präzise konstruiertes Stoßdämpfersystem. Er ermöglicht, dass Knochenoberflächen mit geringer Reibung gegeneinander gleiten. Wenn Knorpel dünner wird und Risse bildet, folgen biochemische Veränderungen: lokale Entzündungsmediatoren (z. B. IL‑1β, TNF‑α) nehmen zu, der Gewebeumsatz verändert sich, und die Zusammensetzung von Proteinen und Metaboliten in der Gelenkflüssigkeit verschiebt sich. Die extrazelluläre Matrix (ECM) verliert Bestandteile wie Aggrecan und Typ‑II‑Kollagen, während Enzyme wie Matrixmetalloproteinasen (MMPs) verstärkt aktiv sind und Knorpelabbau fördern.
Patienten bemerken oft zuerst subtile Zeichen – leichte Schmerzen nach Belastung, vorübergehende Steifigkeit, die sich durch Bewegung bessert, oder ein gelegentliches Knirschen. Solche frühen Warnsymptome sind leicht zu übersehen. Bis hartnäckige Schmerzen bildgebende Verfahren veranlassen, kann struktureller Schaden bereits weit fortgeschritten sein. Moderne Bildgebung mit hochauflösenden MRT‑Sequenzen kann feinere Veränderungen im Knorpel und Subchondralknochen zeigen als konventionelle Röntgenaufnahmen, bleibt aber kosten- und ressourcenabhängig.
Die heutige Behandlung ist pragmatisch und auf Symptome ausgerichtet. Bewegungstherapie zielt darauf ab, die umgebenden Muskeln zu stärken, die Funktion wiederherzustellen und die Gelenkbelastung zu optimieren. Schmerztherapie reicht von oralen Analgetika und nichtsteroidalen Antirheumatika bis zu gezielten Injektionen. Eigenbluttherapien wie PRP (platelet‑rich plasma) liefern ein Gemisch aus Wachstumsfaktoren, das Reparaturprozesse anregen soll. Hyaluronsäureinjektionen versuchen die Gleitfähigkeit im Gelenk zu verbessern. Forscher untersuchen außerdem platelet‑derived vesicles — winzige Träger von Signalmolekülen — doch die meisten Daten hierzu sind noch präklinisch, häufig aus Tiermodellen. Diese Ansätze können Symptome lindern; nur wenige Maßnahmen kehren etablierten Knorpelverlust zuverlässig um.
Neue Wege zur frühzeitigen Diagnose
Was wäre, wenn wir die Erkrankung erkennen könnten, bevor der Schmerz unerbittlich wird? Diese Frage steht im Zentrum mehrerer Labore, die molekulare Signaturen im Blut und in der Gelenkflüssigkeit untersuchen. Jedes Molekül hinterlässt eine Spur. Wenn diese Spuren in großer Zahl gelesen werden, entsteht eine Art Spektralfingerabdruck von Gesundheit und Krankheit.
Wie Spektroskopie chemische Fingerabdrücke liest
Eine Technik, die Aufmerksamkeit gewinnt, ist die attenuierte Totalreflexions‑Fourier‑Transformations‑Infrarotspektroskopie (ATR‑FTIR). Zungenbrecher beiseite: In einfachen Worten wird eine kleine Blutprobe mit Infrarotlicht bestrahlt, und das Muster der Lichtabsorption offenbart die Mischung aus Proteinen, Lipiden und Metaboliten. Feine Verschiebungen in diesen Mustern können frühe Entzündungsprozesse oder Veränderungen des Gewebeumsatzes widerspiegeln, die mit Arthrose verbunden sind. Kombiniert man diese biochemische Messung mit maschinellem Lernen, werden komplexe Muster erkennbar – Muster, die das menschliche Auge übersehen würde.
Neben der Infrarotspektroskopie ergänzen andere molekulare Werkzeuge und Biomarker‑Assays das Bild. Forscher vergleichen große Kohorten von Proben von Menschen mit und ohne Gelenkerkrankung und suchen nach reproduzierbaren Unterschieden. Zu den untersuchten Biomarkern gehören sichtbarkeitsbezogene Proteine wie COMP (Cartilage Oligomeric Matrix Protein), Fragmente von Aggrecan, Enzyme wie MMP‑3 und inflammatorische Zytokine. Metabolomische Profile und Lipide, ebenso wie RNA‑Signaturen und extrazelluläre Vesikel, liefern zusätzliche Informationsschichten. Die Hoffnung ist pragmatisch: einen Fingerabdruck zu identifizieren, der das Risiko vorhersagt, sodass Kliniker mit gezielten Trainingsprogrammen, Gewichtsmanagement, Verletzungsprävention oder frühzeitigen therapeutischen Maßnahmen intervenieren können, wenn sie am meisten bewirken.
Früherkennung würde nicht nur Schmerzen reduzieren; sie könnte die lebenslange Krankheitsentwicklung abmildern und die langfristigen Gesundheitskosten senken.
Technologien, Studien und der Weg nach vorn
Viele dieser Ansätze befinden sich noch in der Forschungsphase. Die Übersetzung einer vielversprechenden Spektralsignatur in einen validierten klinischen Test erfordert Zeit: Reproduzierbarkeit, Standardisierung zwischen Laboren, große prospektive Studien und regulatorische Begutachtung. Dennoch liefert die Konvergenz verbesserter molekularer Assays, zugänglicher Spektroskopie‑Plattformen und enormer Rechenkapazitäten Grund zur Zuversicht. Ergänzt man dies durch tragbare Sensoren (Wearables), die Belastungsmuster und Bewegungsdaten erfassen, sowie intelligentere Rehabilitationsprogramme, lässt sich eine Zukunft denken, in der Risiko weit vor irreparablen Gelenkschäden gemanagt wird.
Es gibt aber auch praktische und ethische Fragen. Wer sollte gescreent werden? Athleten mit wiederkehrenden Gelenkverletzungen? Menschen mit metabolischem Syndrom oder Adipositas? Arbeiter in körperlich belastenden Berufen? Die Kosten‑Nutzen‑Analyse wird bestimmen, wie breit frühe Diagnostik eingesetzt wird. Zusätzlich werden ethische Rahmenbedingungen nötig sein, um Risikobewertungen in Behandlungspläne zu übersetzen, ohne unnötige Angst zu schüren oder Zugang zu Versorgung zu ungleich zu verteilen.
Auf dem Weg zur klinischen Anwendung sind mehrere Schritte entscheidend: validierte Biomarker‑Panels mit hoher Sensitivität und Spezifität, standardisierte Protokolle für Probenentnahme und -verarbeitung, offene Datensätze für maschinelles Lernen, sowie prospektive Interventionsstudien, die zeigen, dass frühe Maßnahmen den Verlauf tatsächlich verändern können. Regulatorische Behörden verlangen robuste Evidenz zur Sicherheit und Wirksamkeit, und Kostenträger möchten Belege zur Kosteneffektivität sehen, bevor Screening‑Programme breit finanziert werden.
Experteneinschätzung
Dr. Maria Chen, klinische Rheumatologin und Forscherin in der muskuloskelettalen Diagnostik, sagt: 'Wir lernen endlich, biochemischen Flüstern zuzuhören, bevor das Gelenk laut schreit. Frühe Marker werden die klinische Einschätzung nicht ersetzen, aber sie verändern, wann und wie wir handeln. Kleine Interventionen zur richtigen Zeit können Funktionen über Jahre erhalten. Das zählt mehr als jedes einzelne Medikament.' Ihre Perspektive fasst den pragmatischen Optimismus der aktuellen Forschung zusammen: kumulative, inkrementelle Fortschritte, die sich über die Lebensspanne aufsummieren.
Derzeit balancieren Ärztinnen und Ärzte Symptomlinderung mit Lebensstilmaßnahmen, die Gelenke schützen: individuell angepasste Bewegungstherapie, Gewichtsregulation, vernünftige Entscheidungen zur Wiederaufnahme sportlicher Aktivitäten nach Verletzungen und Beachtung metabolischer Gesundheit. Die Forschungsgemeinschaft arbeitet weiter an der Verfeinerung von Biomarkern, der Validierung von Spektroskopie‑Methoden und der Erforschung von Biologika, die eines Tages über reine Symptomkontrolle hinausgehen und echte Gewebeerhaltung ermöglichen könnten.
Arthrose bei jüngeren Erwachsenen ist ein Weckruf. Sie fordert die Medizin heraus, sich vom späten Kreislauf aus Schmerz und Ersatzoperationen wegzubewegen und hin zu Prävention, Früherkennung und langfristigem Schutz der Gelenkgesundheit. Dieser Übergang verlangt bessere Werkzeuge, intelligentere Screening‑Strategien und eine Veränderung des gesellschaftlichen Denkens über muskuloskelettale Gesundheit – besonders für Menschen, die sich noch mitten im aktivsten Abschnitt ihres Lebens befinden.
Wenn Sie anhaltende Gelenkschmerzen haben, lassen Sie sich frühzeitig untersuchen. Frühe Schritte können einen lebenslangen Unterschied machen.
Quelle: sciencealert

Kommentar hinterlassen