8 Minuten
Wissenschaftler berichten über einen vielversprechenden neuen Wirkstoffkandidaten, NU-9, der offenbar frühe Alzheimer-assoziierte Veränderungen im Gehirn verlangsamt, indem er toxische Proteinfragmente, die als Amyloid-beta-Oligomere bekannt sind, ins Visier nimmt. Die Entdeckung — getestet in Mausmodellen — weist auf eine mögliche präventive Strategie hin, die Menschen mit hohem Risiko bereits lange vor sichtbarem Gedächtnisverlust gegeben werden könnte.
Die frühesten Zündfunken von Alzheimer aufspüren
Seit Jahren vermuten Forscher, dass die Alzheimer-Krankheit Jahrzehnte vor dem Auftreten klinischer Symptome beginnt. Kleine, lösliche Zusammenlagerungen von Amyloid-beta, sogenannte Oligomere, gelten als einige der frühesten toxischen Akteure: Sie stören Neurone und lösen Entzündungsreaktionen in benachbarten Gliazellen aus. Die NU-9-Studie, geleitet von einem Team der Northwestern University, konzentrierte sich gezielt auf jene ersten molekularen und zellulären Veränderungen, die den Krankheitsprozess in Gang setzen könnten.
In den Experimenten wurden Mäuse, die genetisch prädisponiert sind, eine Alzheimer-ähnliche Pathologie zu entwickeln, mit NU-9 behandelt. Der Wirkstoff senkte die Konzentration von Amyloid-beta-Oligomeren im Gehirn und hielt, was besonders entscheidend ist, Astrozyten in einem ruhigeren, unterstützenden Zustand. Astrozyten erhalten normalerweise die neuronale Gesundheit und regulieren Synapsen; werden sie jedoch reaktiv — ein Prozess, der als Astrogliosis bezeichnet wird — können sie Neuroinflammation verstärken und Schäden beschleunigen.
Die Analyse umfasste quantitative Messungen der Oligomer-Belastung, Immunmarkierung reaktiver Gliazellen und funktionelle Tests, die synaptische Integrität und neuronale Aktivität bewerten. Durch die Kombination histologischer, molekularbiologischer und Verhaltensdaten konnten die Forschenden nicht nur biochemische Veränderungen dokumentieren, sondern auch deren Auswirkungen auf zelluläre Funktionen und frühe kognitive Anzeichen besser einordnen.
Entdeckung eines neuen Oligomer-Subtyps und seine Bedeutung
Ein überraschendes Ergebnis der Studie war die Identifikation eines zuvor nicht erkannten Oligomer-Subtyps, bezeichnet als ACU193+. Das Team fand ACU193+ bereits frühzeitig innerhalb gestresster Neurone und beobachtete eine Bindung an Astrozyten — möglicherweise als Auslöser, der Astrozyten von Helferzellen in schädliche, reaktive Zustände überführt.
Die Charakterisierung dieses Subtyps umfasst biochemische Eigenschaften, Unterschiede in der Löslichkeit und das Bindungsverhalten an zelluläre Rezeptoren. Solche Subtypen können erklären, warum manche Aggregationsformen besonders neurotoxisch sind, während andere Formen weniger direkten Schaden anrichten. Die Identifizierung von ACU193+ erweitert das Verständnis der molekularen Vielfalt von Amyloid-beta-Aggregaten und legt nahe, dass gezielte Therapien Subtypen-spezifisch wirken müssen.
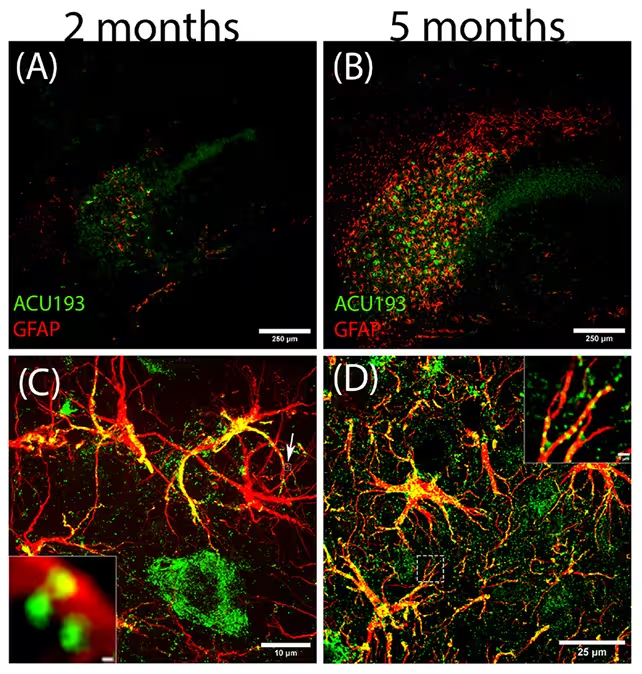
Die Forschenden verfolgten die zunehmende Präsenz von Amyloid-beta-Oligomeren (grün) und deren Einfluss auf reaktive Astrozyten (rot).
„Diese Ergebnisse sind beeindruckend“, sagte Neurobiologe William Klein und wies dabei auf den deutlichen Effekt von NU-9 hin, die reaktive Astrogliosis zu reduzieren — ein Kennzeichen der Neuroinflammation, das mit früher Alzheimer-Pathologie in Verbindung steht. Der Neurowissenschaftler Daniel Kranz von der Northwestern University ergänzte, dass frühe molekulare Ereignisse — wie intrazelluläre Amyloid-Anreicherungen und Glia-Aktivierung — lange vor klinischen Symptomen auftreten, eine Diskrepanz, die erklären könnte, warum viele klinische Studien scheitern, wenn sie zu spät ansetzen.
Wie NU-9 wirkt und warum das Timing wichtig ist
NU-9 scheint die Anreicherung von Amyloid-beta-Oligomeren zu stören, indem es deren Aggregation hemmt und dadurch verhindert, dass sie in destruktiver Weise mit Neuronen und Astrozyten interagieren. In früheren In-vitro-Untersuchungen zeigte der Wirkstoff bereits Aktivität gegen die Bildung von Oligomeren in kultivierten menschlichen Gehirnzellen; die Wirksamkeit in lebenden Tieren untermauert nun die Argumentation für eine weitere Entwicklung.
Mechanistisch könnte NU-9 Proteinfaltungswege beeinflussen, die Bildung von Nukleationskernen blockieren oder die Bindung toxischer Oligomere an Zelloberflächenrezeptoren verhindern. Solche Wirkmechanismen reduzieren direkt die zelluläre Belastung durch toxische Spezies und dämpfen sekundäre Reaktionen wie die Aktivierung von Mikroglia und die Freisetzung proinflammatorischer Zytokine.
Die Frage nach dem richtigen Zeitpunkt der Intervention ist zentral: Werden solche angrenzenden Pathomechanismen bereits vor Symptombeginn angegangen, ist die Chance größer, dass neuronale Netzwerke geschützt und irreversible Schäden verhindert werden können. Späte Behandlungen, die erst bei ausgeprägtem neuronalen Verlust ansetzen, adressieren oft Folgeerscheinungen statt ursächlicher Frühprozesse.
Vom Tiermodell zur möglichen humanen Prävention
- Frühe Phase der Tests: NU-9 verringerte die Oligomer-Last und reduzierte Marker reaktiver Astrozyten in Mausmodellen.
- Nächste Schritte bei Tieren: Forschende testen NU-9 nun in Modellen, die spätere Krankheitsstadien nachahmen, um zu klären, ob die Verbindung auch bei fortschreitender Pathologie noch Vorteile bringt.
- Möglicher Weg für Menschen: Wenn die tierexperimentellen Daten weiter ermutigend bleiben, könnte NU-9 klinische Studien bei Personen mit frühen Biomarkern für Alzheimer einleiten — analog zur Verwendung von Statinen zur Herz-Kreislauf-Prävention bei Risikopatienten.
Es ist wichtig zu betonen, dass Amyloid-beta — sei es in Form von Oligomeren oder Plaques — möglicherweise nicht die alleinige Ursache von Alzheimer ist. Die Erkrankung entsteht vermutlich durch ein Zusammenspiel mehrerer Faktoren, darunter Tau-Pathologie, vaskuläre Veränderungen und genetische Prädispositionen. Dennoch könnte das gezielte Angehen eines frühen toxischen Akteurs wie der Oligomere Teil einer mehrgleisigen Präventionsstrategie sein.
Aus klinischer Sicht würde eine präventive Therapie wie NU-9 besondere Anforderungen an Sicherheit, Langzeitverträglichkeit und praktikable Verabreichungswege stellen. Für die breite Anwendung in einer Risikopopulation müssten Nutzen und Nebenwirkungsprofil über Jahre hinweg sehr günstig sein, da die Zielgruppe im präklinischen Stadium potenziell symptomfrei ist.
Implikationen für Diagnostik und präventive Medizin
Die Aussicht auf ein Medikament, das vor dem Auftreten von Symptomen eingenommen werden kann, hängt stark von einer verbesserten Früherkennung ab. Neue blutbasierte Biomarker und andere diagnostische Verfahren werden derzeit entwickelt und könnten Kandidaten für eine präventive Therapie identifizieren. Beispiele hierfür sind Tests auf phosphoryliertes Tau (p-tau181, p-tau217), Neurofilament light chain (NfL) und spezifische Amyloid-beta-Verhältnisse im Blut oder Liquor.
Bildgebende Verfahren wie PET-Scans für Amyloid und Tau sowie Liquor-Analysen bleiben wichtige Werkzeuge in der Validierung von Biomarkern. Praktische, kosteneffiziente Bluttests könnten in naher Zukunft jedoch eine größere Bevölkerungsgruppe auf frühe pathologische Veränderungen screenen, was die Auswahl geeigneter Personen für präventive Studien erleichtern würde.
„Wenn eine Person einen Biomarker zeigt, der auf Alzheimer hinweist, könnte sie mit NU-9 beginnen, bevor Symptome auftreten“, bemerkte Klein und zog dabei eine direkte Parallele zu cholesterinsenkenden Medikamenten zur Reduktion des kardiovaskulären Risikos. Entscheidend ist, dass solche Entscheidungen durch robuste Risikoprofile und klare Leitlinien gestützt werden müssten.
Worauf Forschende als Nächstes achten
Wesentliche Fragen bleiben offen: Kann NU-9 in späteren Krankheitsstadien das Fortschreiten verlangsamen oder stoppen? Ist eine Langzeitbehandlung sicher und wirksam? Und wie gut lassen sich Ergebnisse aus Tiermodellen auf die höhere Komplexität des menschlichen Gehirns übertragen? Laufende präklinische Arbeiten zielen darauf ab, diese Fragen zu beantworten, während parallele Studien Sicherheits- und Dosierungsparameter ermitteln, die Voraussetzung für eine klinische Prüfung am Menschen sind.
Weitere Untersuchungen müssen auch die Pharmakokinetik und -dynamik von NU-9 im Detail beschreiben: Wie gut erreicht der Wirkstoff die Blut-Hirn-Schranke, wie lange bleibt er im Gewebe aktiv, und welche Metaboliten entstehen? Solche Daten sind entscheidend, um sinnvolle Dosisregime zu entwickeln und mögliche systemische Nebenwirkungen frühzeitig zu erkennen.
Zudem ist die Entwicklung engerer diagnostischer Kriterien für die Auswahl derjenigen Personen wichtig, bei denen eine präventive Therapie sinnvoll ist. Dies umfasst das Zusammenspiel von genetischen Risikofaktoren (z. B. APOE4), Biomarkerprofilen und klinischen Parametern, um ein personalisiertes Präventionskonzept zu ermöglichen.
Experteneinschätzung
„NU-9 steht für einen vielversprechenden Ansatz, da es auf einem molekularen Stadium interveniert, das üblicherweise Symptomen vorausgeht“, sagte Dr. Elena Morris, eine fiktive leitende Forscherin im Bereich neurodegenerativer Erkrankungen. „Präventive Neurologie wird eine Kombination aus früher Erkennung, gut verträglichen Therapien und einer öffentlichen Gesundheitsbereitschaft erfordern, Menschen zu behandeln, die gefährdet, aber noch nicht erkrankt sind. NU-9 könnte ein Baustein dieses Puzzles sein — vorausgesetzt, größere Studien bestätigen seinen Nutzen.“
Insgesamt hebt die NU-9-Forschung die Bedeutung gezielter Interventionen gegen frühe, toxische Aggregatformen hervor und liefert zusätzliche Argumente dafür, dass präventive Ansätze gegen Alzheimer von der Grundlagenforschung bis zur klinischen Anwendung weiterverfolgt werden sollten. Gleichzeitig unterstreicht sie die Notwendigkeit integrierter Strategien, die Pharmakotherapie, Biomarker-gestützte Diagnostik und öffentliche Gesundheitsmaßnahmen kombinieren, um langfristig Wirkung zu erzielen.
Während NU-9 weiter in präklinischen Studien geprüft wird, bleibt die wissenschaftliche Gemeinschaft vorsichtig optimistisch: Positive Ergebnisse in Tiermodellen sind ein notwendiger erster Schritt, aber keine Garantie für klinischen Erfolg. Der Weg von der Entdeckung zur zugelassenen Präventionstherapie erfordert rigorose, gestufte Studien, transparente Bewertung von Risiken und Nutzen sowie eine interdisziplinäre Zusammenarbeit zwischen Forschenden, Klinikern und Regulierungsbehörden.
Quelle: sciencealert

Kommentar hinterlassen