7 Minuten
Stellen Sie sich ein winziges Herz vor, das nicht nur eigenständig schlägt, sondern Ihnen auch in feinen Details verrät, was jede einzelne Zelle tut. Das ist das Versprechen der neuesten Heart-on-a-Chip-(HOC)-Plattform, die ein kanadisches Forscherteam entwickelt hat: ein dreidimensional konstruiertes kardiales Gewebe, das großflächige Kraftmessung mit winzigen, im Gewebe eingebetteten Mikrosensoren kombiniert, um die Arbeit der Muskelzellen zu beobachten.
Jahrzehntelang war die Kardiologie durch ein zentrales Problem eingeschränkt: Sie können nicht risikofrei testen, wie ein menschliches Herz auf ein neues Medikament oder eine Krankheit reagiert. Tiermodelle und vereinfachte Zellkulturen helfen weiter, erfassen aber nicht die feingliedrigen mechanischen Details des kontrahierenden Herzmuskels. Dieses neue Gerät schließt diese Lücke, indem es zwei komplementäre Messsysteme kombiniert: makroskopische Säulen, die sich mit jedem Schlag biegen, und hydrogel-basierte Mikrotröpfchen, die lokale Spannungen dort melden, wo Zellen Kraft erzeugen.
Wie das doppelsensorische Herz aufgebaut ist
Als Ausgangspunkt dienen Stammzellen oder kardiomyozytische Zellen aus tierischen Quellen, die in ein proteinreiches Gel suspendiert werden und sich zu dichten Muskelstrukturen organisieren. Die Forscher setzten Rattenkardiomyozyten und Bindegewebszellen in ein stützendes, der extrazellulären Matrix ähnliches Gel ein und kultivierten diese Mischung auf einem Siliziumchip. Das Gewebe ordnet sich selbst zu einem schlagenden Streifen an, der zwischen zwei flexiblen elastischen Säulen aufgehängt ist. Jede Kontraktion führt zu einer Ablenkung dieser Säulen; die Höhe und das Timing dieser Ablenkung geben Auskunft über die kontraktile Stärke und den Rhythmus des gesamten Gewebes.
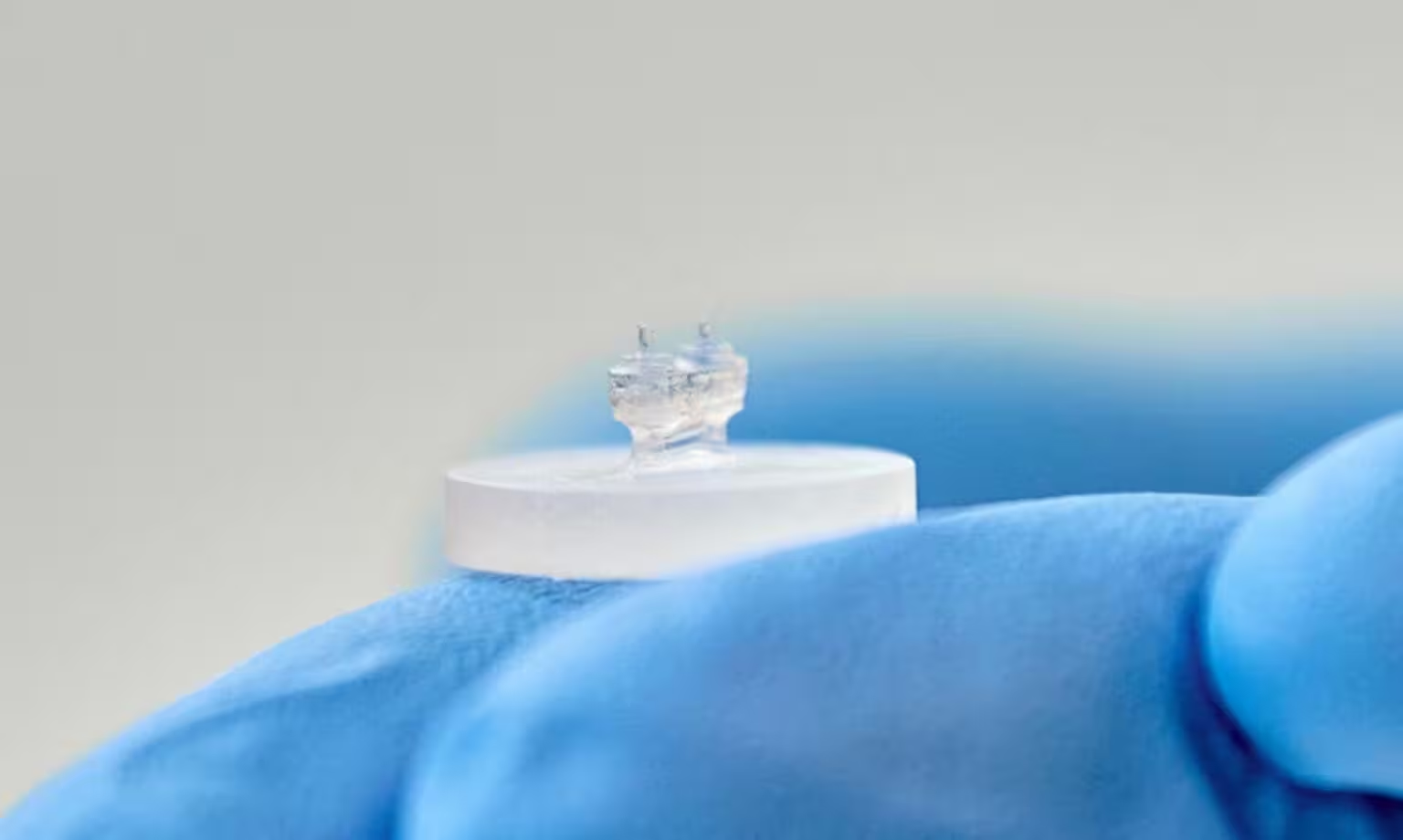
Die eigentliche Neuheit liegt jedoch in der Mikroschicht zur Sensierung. Winzige Hydrogel-Mikrotröpfchen mit einem Durchmesser von etwa 50 Mikrometern werden innerhalb des Gewebes verteilt. Diese Tröpfchen verformen sich unter den sehr kleinen lokalen Kräften, die einzelne Kardiomyozyten und ihre Nachbarn erzeugen. Durch die Verfolgung von Tropfenform und -bewegung kann das Team mechanische Spannungen auf zellulärer Ebene ableiten, die für konventionelle HOC-Plattformen unsichtbar bleiben. Die Kombination aus makroskopischer Säulenmessung und mikroskopischem Tröpfchen-Report erlaubt so eine mehrskalige Analyse von Kontraktilität, Synchronität und lokalen Fehlfunktionen.
Sensoren, die Maßstäbe überbrücken
Das Säulensystem beantwortet die Frage: Wie kräftig schlägt das ingenieurmäßige Herzmuskelgewebe insgesamt? Die Mikrotröpfchen beantworten eine subtilere Frage: Welche Zellen versagen, und wo genau geschieht das? Diese Unterscheidung ist wichtig. Viele kardiovaskuläre Erkrankungen beginnen auf der Ebene einzelner Kardiomyozyten — fehlerhafte Kontraktilität, fehlgeleitete Kraftübertragung oder beeinträchtigte Reparaturmechanismen — lange bevor die Leistung des gesamten Gewebes zusammenbricht. Die doppelte Messung liefert Forschern daher sowohl den Blick auf den Wald als auch auf die einzelnen Bäume.
Technisch gesehen wird die makroskopische Kraftmessung häufig über die Kalibrierung der Säulensteifigkeit in Kombination mit optischer Tracking-Software realisiert: Die Ablenkung wird in Kraft umgerechnet, wodurch absolute oder relative Kontraktionsprofile über Zeit entstehen. Die Mikrotröpfchen arbeiten nach einem anderen Prinzip: ihre Materialeigenschaften werden so gewählt, dass schon subnanonewton- bis nanonewton-skalierten Spannungen messbare Formänderungen erzeugen. Hochauflösende Fluoreszenz- oder Phasenkontrastmikroskopie erfasst diese Deformationen in Echtzeit.
Pharmakologie, Pathologien und präzise Strategien
Der Proof-of-Concept gelang, als das Team seine HOC-Plattformen zwei bekannten Verbindungen aussetzte. Noradrenalin (Norepinephrin), ein adrenerger Stimulator, steigerte erwartungsgemäß die kontraktile Kraft und beschleunigte den Rhythmus. Blebbistatin, ein Myosin-Inhibitor, dämpfte die Kontraktionen wie vorhergesagt. Die Reaktionskurven stimmten mit physiologischen Erwartungen überein, was darauf hindeutet, dass die Chips als zuverlässige präklinische Plattformen dienen können, um die Effekte von Medikamenten auf Kontraktilität und Arrhythmierisiko zu screenen.

Warum ist das nützlich? Weil in vitro-Plattformen, die sowohl gewebsweite Mechanik als auch zelluläre Heterogenität getreu nachbilden, die Wirkstoffforschung beschleunigen und Tests sicherer machen können. Anstatt einem Patienten direkt eine unverträgliche oder ungeprüfte Substanz zu verabreichen, könnten Kliniker eines Tages Medikamente zuerst auf patienteneigenen Zellen testen, die zu einem kleinen, schlagenden Gewebestreifen herangezüchtet wurden. Personalisierte Pharmakologie — ohne Rätselraten.
Das Forscherteam plant den nächsten Schritt: HOCs aus Zellen zu bauen, die aus Patienten mit spezifischen Herzerkrankungen stammen, etwa dilatativer Kardiomyopathie oder genetisch bedingten Arrhythmien. Solche patientenspezifischen Modelle würden es ermöglichen, Krankheitsverläufe nachzubilden (disease modelling), die Mechanismen des Fortschreitens zu untersuchen und direkt zu prüfen, welche Therapien in welchem patientenspezifischen Kontext die normalen mechanischen Eigenschaften wiederherstellen.
Zusätzlich zu pharmakologischen Tests bieten diese Plattformen Möglichkeiten, Zell- und Gewebeantworten auf mechanische Belastung, Hypoxie, metabolischen Stress oder entzündliche Signale zu untersuchen. Die Daten auf mehreren Skalen — von Nanonewton-Spannungen einzelner Zellen bis zu Millinewton-Werten ganzer Gewebestreifen — ermöglichen strukturierte Korrelationsanalysen zwischen molekularen Markern (z. B. Expressionslevel kontraktiler Proteine), elektrischer Aktivität (durch Elektrophysiologie) und mechanischer Leistung.
Fachliche Einordnung und Perspektiven
„Zelluläre Mechanik in einem kontrahierenden Gewebe in Echtzeit zu beobachten, verändert die Spielregeln“, sagt Ali Mousavi, Biomedizintechniker und Erstautor der Studie. „Es geht nicht nur darum, ob das Gewebe schlägt; es geht darum, wie und wo Kraft erzeugt und verloren geht.“
Houman Savoji, Seniorautor und ebenfalls Biomedizintechniker, beschreibt die größere Vision: „Dieses doppelsensorische Design bringt uns der Präzisionsmedizin näher. In Zukunft könnten Ärzte ein Medikament wählen, nachdem sie gesehen haben, wie das patienteneigene Herzgewebe auf dem Chip reagiert — bevor der Patient die Therapie erhält.“
Solche Geräte ersetzen nicht über Nacht klinische Studien oder Tierversuche. Sie sind jedoch ein mächtiges ergänzendes Werkzeug: schneller, kostengünstiger und ethisch weniger problematisch als viele Alternativen und aussagekräftiger als Einzelzell-Assays. Die Möglichkeit, mechanische Dysfunktionen mit zellulärer Auflösung zu kartieren, eröffnet neue Wege zum Verständnis von Wundheilung im Myokard, von Gewebeumlagerungen unter Stress und davon, warum bestimmte Therapien bei manchen Patienten wirken, bei anderen jedoch versagen.
Ein weiterer Vorteil dieses Ansatzes liegt in der Skalierbarkeit und in der Kombination mit automatisierten Bildverarbeitungs-Pipelines: Machine-Learning-Algorithmen können Muster in Tröpfchen-Deformationen erkennen, lokale Defizienztypen klassifizieren und Vorhersagen über den langfristigen Funktionsverlust treffen. Das erhöht den Wert der Plattform für Hochdurchsatz-Screenings (High-Throughput Screening) in der Wirkstoffentwicklung.
Gleichzeitig bestehen technische Herausforderungen: Die Materialwahl für Tröpfchen und Matrix muss neben mechanischen auch biologische Anforderungen erfüllen (Biokompatibilität, Nährstoffpermeabilität, optische Klarheit). Die Bildgebung muss empfindlich genug sein, um subzelluläre Deformationen zu detektieren, und zugleich schnell genug, um rhythmische Prozesse zu verfolgen. Auch die Reproduzierbarkeit von Gewebearchitektur und Zellzusammensetzung zwischen einzelnen Chips ist für zuverlässige Vergleiche essenziell.
Fragen bleiben offen: Werden menschliche Gewebe dieselben Tropfenantworten wie Rattenzellen liefern? Kann die Mikrosensorik für Hochdurchsatz-Tests skaliert werden, ohne an Sensitivität zu verlieren? Können standardisierte Protokolle entstehen, die regulatorische Anforderungen für präklinische Tests erfüllen? Ingenieure und Biologen arbeiten bereits an der Iteration von Materialien, Sensorchemien und Bildgebungs-Pipelines, um diese Fragen zu beantworten und die Plattformen praxistauglich zu machen.
Langfristig könnten Herz-on-a-Chip-Systeme mit eingebetteten Mikrotröpfchen auch dazu beitragen, patientenspezifische Risiken für Arzneimittel-nebenwirkungen vorherzusagen oder die Wirkmechanismen experimenteller Therapien zu entschlüsseln. In Kombination mit genomischen, proteomischen und elektrophysiologischen Daten entsteht so ein integratives Bild kardiovaskulärer Gesundheit — ein Schritt in Richtung mechanistisch fundierter, individualisierter Therapieentscheidung.
Kurz gesagt: Das Herz auf einem Chip mit eingebetteten Mikrotröpfchen bietet ein Fenster in die Mechanik des Lebens. Es ist klein, spricht aber laut — und wir lernen, zuzuhören.
Quelle: sciencealert

Kommentar hinterlassen