8 Minuten
Die Verleihung des Nobelpreises 2025 in Physiologie oder Medizin an Shimon Sakaguchi, Mary E. Brunkow und Fred Ramsdell setzt einen Meilenstein in der Immunologie: Ihre Arbeiten enthüllten, wie der Körper aktiv verhindert, dass das Immunsystem körpereigenes Gewebe angreift. Im Zentrum steht eine spezielle Untergruppe von Immunzellen – die regulatorischen T-Zellen (T‑Regs) –, die als Wächter der Immuntoleranz fungieren und entzündliche Überreaktionen bremsen.
Die Entdeckung: Wer erhielt den Preis und warum sie wichtig ist
Die drei Forscher lösten eines der zentralen Rätsel der Immunbiologie: Wie unterscheidet das Immunsystem zwischen »selbst« und »fremd« und warum greift es nicht permanent unseren eigenen Körper an? Ihre Forschung zeigte, dass neben der Eliminierung potenziell selbstreaktiver Zellen im Thymus (zentrale Toleranz) ein aktiver Mechanismus in der Peripherie existiert. Diese aktive Regulation wird maßgeblich von regulatorischen T‑Zellen getragen, deren Funktionen sich als grundlegend für die Verhinderung von Autoimmunerkrankungen erwiesen.
Wissenschaftlicher Hintergrund: T‑Zellen, Thymus und Immuntoleranz
T‑Lymphozyten (T‑Zellen) reifen im Thymus. Dort werden viele selbstreaktive T‑Zellen bereits in der frühen Entwicklung eliminiert – ein Prozess, den Immunologen als zentrale Toleranz bezeichnen. Lange ging man deshalb davon aus, dass dieser Mechanismus ausreiche, um Autoimmunität zu verhindern. Beobachtungen aus den 1980er- und 1990er-Jahren deuteten jedoch auf eine zusätzliche Kontrollstufe hin: Zellen, die aktiv Immunantworten in der Peripherie unterdrücken.
Sakaguchis Experimente waren wegweisend. Als er neugeborenen Mäusen den Thymus entfernte und T‑Zellen in genetisch ähnliche Empfängermäuse übertrug, zeigte sich kein allgemeiner Immundefekt, sondern in einigen Fällen eine Autoimmunreaktion. Diese überraschenden Ergebnisse legten nahe, dass eine eigene T‑Zellpopulation existiert, die überschießende Immunreaktionen verhindert. 1995 beschrieben Sakaguchi und sein Team diese Zellen erstmals als »regulatorische T‑Zellen«.
Warum dieses Prinzip ein Paradigmenwechsel war
Bis dahin dominierte das Bild, dass Toleranz primär passiv durch Eliminierung schädlicher Zellen entsteht. Die Erkenntnis, dass aktive Suppression in der Peripherie zentral ist, veränderte die Fragestellungen in Forschung und Klinik: Statt nur ›schädliche‹ Zellen zu entfernen, begann die Wissenschaft, Wege zu suchen, wie man regulatorische Mechanismen stärken oder gezielt manipulieren kann.
Mechanismen: Wie regulatorische T‑Zellen die Entzündung dämpfen
Die Arbeiten von Mary Brunkow und Fred Ramsdell ergänzten und vertieften das Verständnis. Sie identifizierten FoxP3, einen Transkriptionsfaktor, der als molekulares Erkennungszeichen und als Master-Regulator für die Entwicklung und Funktion von T‑Regs dient. FoxP3 erlaubte es Forschern erstmals, diese Zellen zuverlässig zu markieren, zu isolieren und funktionell zu untersuchen.
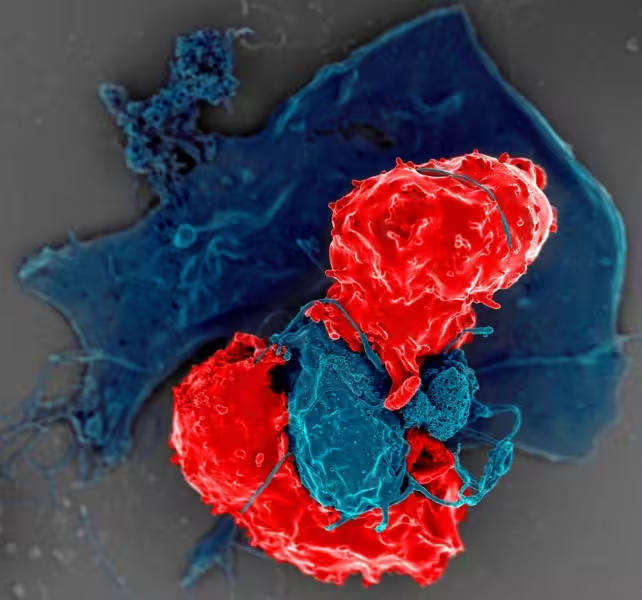
Regulatorische T‑Zellen bremsen immunologische Reaktionen über mehrere, sich ergänzende Wege:
- Sezernierung immunsuppressiver Zytokine: IL‑10 und TGF‑β reduzieren die Aktivität von Effektorzellen.
- Wachstumsfaktor-Konsum: T‑Regs können lebenswichtige Wachstumsfaktoren wie IL‑2 entziehen und so Effektor‑T‑Zellen in ihrer Proliferation einschränken.
- Direkter Zellkontakt und Oberflächenmoleküle: Durch Interaktion mit antigenpräsentierenden Zellen (APCs) oder Effektorzellen vermitteln T‑Regs inhibitorische Signale.
Mechanismen und Marker im Überblick
- FoxP3: Schlüsselfaktor für Entwicklung und Funktion von T‑Regs; Mutationen führen zu schweren Autoimmunphänotypen.
- IL‑10 und TGF‑β: Wichtige immunsuppressive Zytokine, die entzündliche Signale dämpfen.
- CTLA‑4 und andere Oberflächenmoleküle: Vermitteln Zellkontakt-vermittelte Hemmung und beeinflussen antigenpräsentierende Zellen.
Klinische Implikationen: Von Autoimmunerkrankungen bis zur Krebsimmuntherapie
Die Erkenntnisse über T‑Regs sind nicht nur mechanischer Natur – sie haben direkte, greifbare Konsequenzen für Patienten und Therapien. Das Verständnis von regulatorischen Zellen veränderte die Entwicklung neuer Behandlungsstrategien in mehreren Bereichen:
- Autoimmunerkrankungen: Defizite in der Zahl oder Funktion von T‑Regs erklären Phänotypen bei Typ‑1‑Diabetes, rheumatoider Arthritis oder Multipler Sklerose. Therapien, die T‑Regs wiederherstellen oder ihre Wirkung nachahmen, können entzündliche Prozesse kontrollieren.
- Transplantation: Das gezielte Steigern oder Transferieren von T‑Regs kann Abstoßungsreaktionen abschwächen und die Abhängigkeit von lebenslanger Immunsuppression reduzieren.
- Krebsimmuntherapie: In Tumorumgebungen können T‑Regs die Antitumorantwort dämpfen. Strategien, die T‑Reg‑Funktionen lokalisieren oder temporär blockieren, könnten die Wirksamkeit von Immuncheckpoint‑Inhibitoren und anderen Immuntherapien verbessern – gleichzeitig bleibt die Herausforderung, Autoimmunität als Nebenwirkung zu vermeiden.
- Impfungen und Infektionen: T‑Regs beeinflussen Stärke und Dauer von Impfantworten sowie die Auflösung entzündlicher Reaktionen nach einer Infektion. Ein ausgewogenes Verhältnis zwischen Schutz und kontrollierter Entzündung ist hier entscheidend.
Die Übersetzung dieser Erkenntnisse in therapeutische Anwendungen ist bereits im Gange: Biotech‑Firmen und akademische Teams arbeiten an Zelltherapien (z. B. expandierte T‑Regs), molekularen Modulatoren von FoxP3 und kombinierten Ansätzen, die T‑Reg‑Interventionen mit anderen Immuntherapien verknüpfen.
Zukunftsperspektiven: Präzision, Engineering und Mikrobiom‑Verknüpfungen
Die kommenden Jahre werden zeigen, wie breit einsetzbar T‑Reg‑basierte Ansätze sein können. Wichtige Forschungsrichtungen umfassen:
- Antigenspezifische Expansion: Allgemeine Immununterdrückung birgt Nebenwirkungen. Ziel ist daher die Expansion oder Erzeugung von T‑Regs, die nur gegen bestimmte Autoantigene gerichtet sind – etwa in der Typ‑1‑Diabetes‑Therapie.
- Pharmakologische Modulatoren von FoxP3: Kleine Moleküle oder biologisches, die FoxP3‑Stabilität und Funktion beeinflussen, könnten T‑Reg‑Aktivität feinjustieren.
- Cellular Engineering: CAR‑T‑Reg‑Konzepte (chimeric antigen receptor engineered regulatory T cells) kombinieren die Präzision von CAR‑Technologien mit tolerogenen Eigenschaften der T‑Regs, um sehr spezifische, sichere Toleranz zu induzieren.
- Mikrobiom und Umwelt: Wachsende Evidenz zeigt, dass Darmflora und Umweltfaktoren T‑Reg‑Entwicklung und Stabilität beeinflussen. Therapien könnten künftig auch auf mikrobielle Modulation setzen, um langfristig stabile Toleranz zu fördern.
Solche Interventionen erfordern sorgfältige Balance: Während eine Stärkung der T‑Reg‑Funktion Autoimmunität und Transplantatabstoßung verhindern kann, muss zugleich das Infektions‑ und Tumorüberwachungsvermögen des Immunsystems erhalten bleiben.
Technische Herausforderungen und Forschungsfragen
Trotz Fortschritten bleiben Fragen offen: Wie stabil sind induzierte T‑Regs im entzündlichen Milieu? Lassen sich T‑Regs zielgenau in betroffene Gewebe leiten? Welche Biomarker prognostizieren Therapieerfolg? Antworten auf diese Fragen sind entscheidend für sichere und effektive klinische Anwendungen.
Expertenstimme: Was Forscher über die Bedeutung der Entdeckung sagen
»Die Identifizierung regulatorischer T‑Zellen hat unser Verständnis des immunologischen Gleichgewichts grundlegend verändert,« erklärt Dr. Elena Martinez, Immunologin und Wissenschaftskommunikatorin. »Anstatt nur schädliche Zellen zu entfernen, bietet sich die Möglichkeit, tolerogene Lösungen zu gestalten – sei es durch Wiederherstellung der Toleranz bei Autoimmunerkrankungen oder durch temporäre Aufhebung von Bremsfunktionen gegen Tumoren. Die Nobelpreis‑Auszeichnung würdigt sowohl die konzeptionelle als auch die translative Bedeutung dieser Forschung.«
Solche Einschätzungen spiegeln die aktuelle Dynamik im Feld wider: Grundlagenforschung treibt klinische Innovationen voran, und umgekehrt führen klinische Fragestellungen zu neuen Hypothesen in der Grundlagenforschung.
Was Patienten und Kliniker wissen sollten
- Therapien, die T‑Regs modulieren, sind bereits in frühen klinischen Studien, vor allem bei Autoimmunerkrankungen und in der Transplantationsmedizin.
- Die meisten Ansätze zielen auf selektive oder temporäre Modulation ab, um Nebenwirkungen wie erhöhte Infektionsanfälligkeit oder Tumorwachstum zu vermeiden.
- Biomarker‑Entwicklung (z. B. FoxP3‑Ausdruck, T‑Reg‑Frequenz) ist entscheidend, um Patientenstratifizierung und Therapieanpassung zu ermöglichen.
Für Kliniker bedeutet das: Beobachten Sie laufende Studien, prüfen Sie Biomarker‑Definitionen kritisch und wägen Sie Risiko‑Nutzen‑Profile sorgfältig ab, bevor neue T‑Reg‑basierte Therapien breit eingesetzt werden.
Die Forschung zur Immunregulation bleibt ein schnell wachsendes Feld, das Grundlagenwissen mit direkten Therapieoptionen verknüpft. Die Entdeckung und Charakterisierung der regulatorischen T‑Zellen sowie des Schlüsselfaktors FoxP3 haben nicht nur grundlegende Immunmechanismen sichtbar gemacht, sondern auch einen klaren Pfad für therapeutische Innovationen eröffnet.
Die Auszeichnung mit dem Nobelpreis 2025 ist deshalb mehr als eine Würdigung historischer Experimente: Sie dokumentiert den Übergang von einem beschreibenden Verständnis der Toleranz hin zu einem aktiven, anwendungsorientierten Forschungsprogramm, das das Potenzial besitzt, viele Krankheiten neu zu behandeln oder zu verhindern.
Quelle: sciencealert

Kommentar hinterlassen