8 Minuten
Forscher von Johns Hopkins Medicine haben mikroskopisch dünne Nanoröhrenkanäle zwischen Neuronen identifiziert, die toxische Moleküle transportieren können — eine Entdeckung, die eine bisher unerkannte Ebene der Hirnvernetzung offenlegt und helfen könnte zu erklären, wie die Alzheimer-Pathologie sich ausbreitet. Mithilfe hochauflösender Bildgebung in Mäusen sowie der Auswertung verfügbarer humaner Elektronenmikroskopie-Datensätze beobachtete das Team lange, schlanke dendritische Nanoröhren, die Amyloid-beta und andere kleine Toxine zwischen Zellen shutteln und damit einen neuen Ansatzpunkt für zukünftige Therapien vermuten lassen.
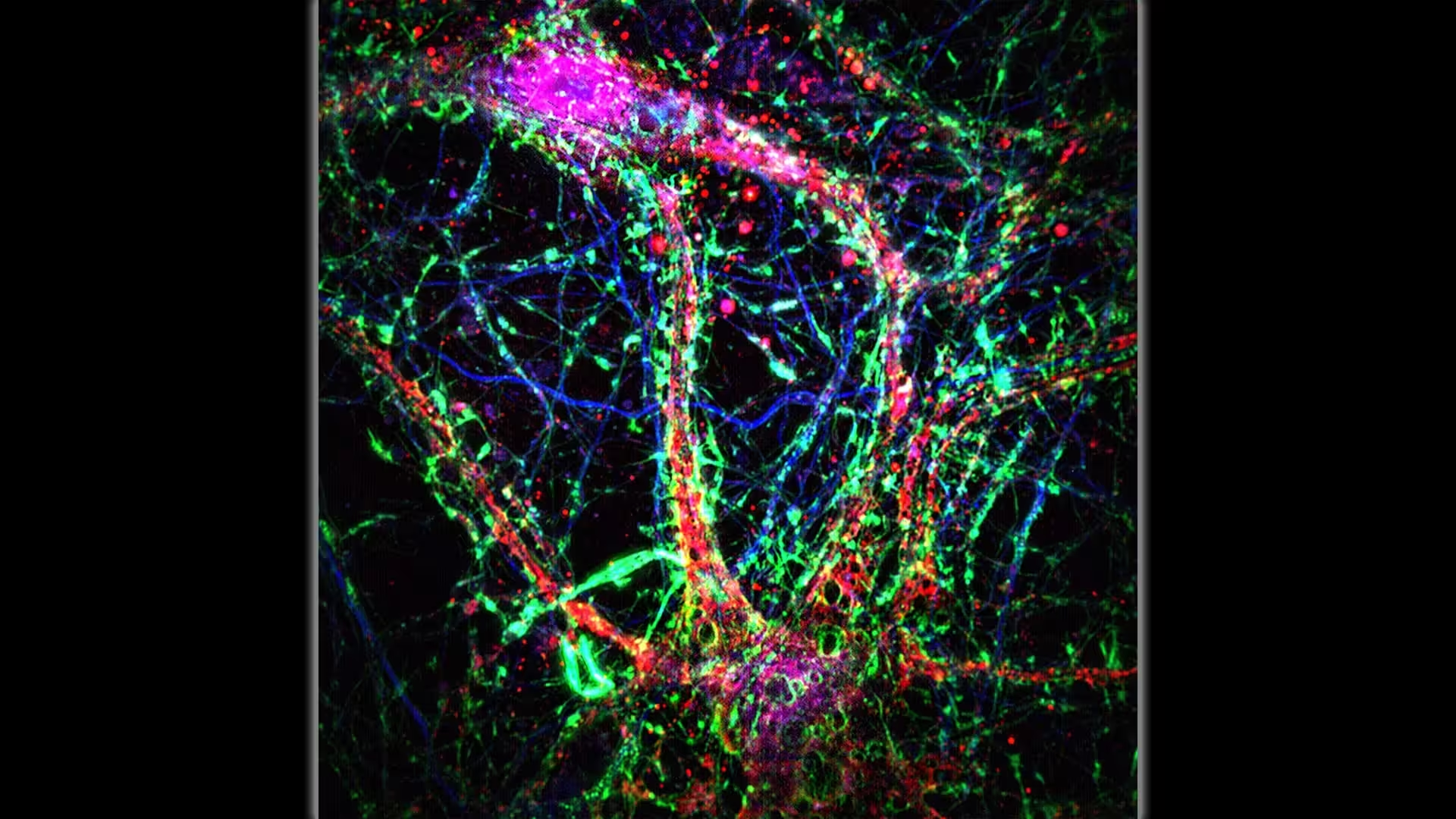
Wissenschaftler bei Johns Hopkins Medicine berichten, dass interzelluläre Nanoröhren (dünne, grün dominierte, brückenartige Verbindungen) eine zusätzliche Kommunikationsebene innerhalb des neuronalen Netzwerks darstellen. Credit: Minhyeok Chang, Ph.D.
Was das Team herausfand und warum es wichtig ist
Stellen Sie sich vor, Neuronen kommunizieren nicht nur über Synapsen, sondern senden auch winzige Pakete durch röhrenförmige Brücken. Dieses Bild ergibt sich aus einer Studie, die am 2. Oktober in Science veröffentlicht wurde: Die Autorinnen und Autoren beschreiben eine "nanotubuläre Konnektivitätsebene" im Säugetiergehirn. Diese Nanoröhren — extrem dünne membranöse Kanäle, die Dendriten benachbarter Neurone verbinden — scheinen Ionen, Calcium und kleine toxische Moleküle wie Amyloid-beta von Zelle zu Zelle zu bewegen. Solche Prozesse betreffen Schlüsselbegriffe der Neurowissenschaften wie zellulärer Transport, Proteinaggregation und neuronale Homöostase.
„Zellen müssen toxische Moleküle loswerden, und indem sie eine Nanoröhre ausbilden, können sie dieses toxische Molekül an eine Nachbarzelle übermitteln“, erläuterte Hyungbae Kwon, Associate Professor für Neurowissenschaften an der Johns Hopkins University School of Medicine und korrespondierender Autor der Veröffentlichung. „Unglücklicherweise führt dies auch dazu, dass schädliche Proteine in andere Regionen des Gehirns gelangen.“
Die ambivalente Funktion dieser Nanoröhren — einerseits als möglicher Mechanismus zur Beseitigung zellulärer Abfälle, andererseits als Vehikel für die Ausbreitung toxischer Fracht — liefert Neurowissenschaftlern einen neuen Rahmen zur Erklärung früher Stadien neurodegenerativer Prozesse. Computermodelle und Simulationen, die das Team einsetzte, zeigten Muster früher Amyloid-Akkumulation, die mit Beobachtungen in Alzheimer-Modellmäusen übereinstimmen. Diese Simulationen stützen die Hypothese, dass nanotubusvermittelter Transfer die lokale Initialisierung pathologischer Proteine beschleunigen und damit das seeding von Aggregaten fördern könnte.
Wie die Entdeckung zustande kam: Methoden und Belege
Die Forschenden kombinierten genetische Mausmodelle, die zu Amyloid-Akkumulation prädisponiert sind, mit hochauflösender Live-Cell-Mikroskopie, um die Bildung von Nanoröhren in Hirnschnitten sichtbar zu machen. Sie dokumentierten lange, säulenartige Ausstülpungen, die Dendriten überspannten, und verfolgten direkt die Bewegung fluoreszenzmarkierter Moleküle durch diese Leitungen. Solche Beobachtungen erforderten die Anwendung fortgeschrittener optischer Techniken, darunter Zeitraffer-Aufnahmen, 3D-Rekonstruktionen und quantitative Analyse der Fluoreszenzintensität, um Frachtbewegungen, Flussrichtung und Geschwindigkeit zu bestimmen.
Zur Überprüfung der Relevanz für den Menschen untersuchten die Wissenschaftler öffentliche humaner Elektronenmikroskopie-Datensätze und fanden Nanoröhren mit vergleichbarer Morphologie, die menschliche Neurone verbinden. Die Kombination aus in vivo-ähnlichen Mausbeobachtungen und in-silico-Analyse menschlicher EM-Daten stärkt die Aussagekraft der Ergebnisse: Die identifizierten Strukturen sind höchstwahrscheinlich kein artefaktbedingtes Phänomen, sondern ein belastbarer Aspekt der neuronalen Architektur.
In Mäusen, die so programmiert sind, Alzheimer-ähnliche Amyloid-Plaques zu entwickeln, war die Zahl der Nanoröhren bereits im Alter von drei Monaten erhöht — eine Phase, in der die Tiere noch keine sichtbaren Verhaltensauffälligkeiten zeigen. Mit sechs Monaten, wenn sich Plaquepathologie deutlicher manifestiert, gleichen sich die Nanoröhrenanzahlen zwischen transgenen und Kontrolltieren an. Diese zeitlichen Dynamiken deuten darauf hin, dass die Proliferation von Nanoröhren besonders während früher, präsymptomatischer Phasen der Erkrankung aktiv sein könnte. Solche Befunde sind relevant für Konzepte zur Früherkennung und für die Identifikation zeitlich fokussierter therapeutischer Fenster.
Unterstützendes Team und Finanzierung
Das Projekt wurde von Kwon geleitet, mit Beiträgen von Minhyeok Chang, Sarah Krüssel, Juhyun Kim, Daniel Lee, Alec Merodio und Jaeyoung Kwon an der Johns Hopkins Institution sowie mit Kooperationspartnern Laxmi Kumar Parajuli und Shigeo Okabe von der University of Tokyo. Die Finanzierung erfolgte durch die National Institutes of Health (DP1MH119428 und R01NS138176). Solche Fördermittel sind wichtig, um interdisziplinäre Forschung zu ermöglichen, die moderne Mikroskopie, Tiermodelle, Computermodellierung und Datenanalyse vereint.
Implikationen für Alzheimer-Forschung und mögliche Therapien
Die Ergebnisse eröffnen mehrere translationale Perspektiven. Wenn dendritische Nanoröhren einen wesentlichen Pfad für die Ausbreitung von Amyloid-beta darstellen, könnte die Modulation ihrer Bildung — entweder ihre Unterdrückung, um die Propagation einzudämmen, oder eine zeitlich begrenzte Förderung zur verbesserten Clearance toxischer Moleküle — zu einem therapeutischen Ansatz werden. Eine gezielte Beeinflussung könnte etwa durch kleine Moleküle, Antikörper, genetische Interventionen oder biologisch-engineernde Strategien erfolgen, die die Zellmembranmechanik, Zytoskelettdynamik oder Signalkaskaden beeinflussen, welche die Nanoröhrenbildung steuern.
Kwon und Kolleginnen und Kollegen schlagen zukünftige Experimente vor, in denen Nanoröhren bewusst erzeugt oder blockiert werden, um zu testen, wie solche Manipulationen neuronale Gesundheit, Proteinaggregation und kognitive Leistungen in Tiermodellen beeinflussen. Wichtige Endpunkte wären dabei nicht nur die Quantität pathologischer Aggregate, sondern auch synaptische Integrität, elektrophysiologische Funktionen und Verhaltensmaße wie Gedächtnisleistung. Solche Studien könnten Aufschluss darüber geben, ob Nanoröhren primär als pathogen oder adaptiv zu bewerten sind — oder ob ihre Rolle kontextabhängig ist.
Über Alzheimer hinaus könnten Nanoröhrennetzwerke bei anderen neurodegenerativen Erkrankungen eine Rolle spielen, in denen fehlgefaltete Proteine von Zelle zu Zelle übertragen werden, zum Beispiel bei Parkinson oder amyotropher Lateralsklerose (ALS). Die strukturellen und funktionellen Eigenschaften dieser Nanoröhren — ihre Länge, ihr Durchmesser, ihre Selektivität für bestimmte molekulare Fracht sowie die Mechanismen der Bildung und Rückbildung — werden entscheidende Informationen für Wirkstoffentwickler und Neurowissenschaftler sein, die eingreifen wollen. Ebenso relevant sind mögliche Nebenwirkungen: Eine vollständige Blockade von Nanoröhren könnte zwar die Ausbreitung pathologischer Aggregate verringern, aber gleichzeitig physiologische Prozesse stören, die auf zellulärem Austausch basieren, etwa den Austausch von Metaboliten oder die Reparatur geschädigter Zellen.
Wissenschaftliche Einordnung und technische Details
Ähnliche, wenn auch strukturell nicht identische, tunneling nanostructures (auch tunneling nanotubes, TNTs, genannt) sind bereits in anderen Zelltypen beschrieben worden, etwa in Immunzellen oder Tumorzellen, wo sie den Transfer von Organellen, Ca2+-Signalen oder viralen Partikeln vermitteln können. Die aktuelle Studie erweitert dieses Konzept auf dendritische Verzweigungen im Zentralnervensystem und hebt hervor, dass solche Kanäle nicht nur in vitro, sondern auch im Gewebe vorhanden sind. Die Kombination aus konfokaler und Elektronenmikroskopie, ergänzt durch quantitative Bildanalyse und Modellierung, liefert robuste Belege für die Existenz und Funktion dieser Verbindungen.
Technisch anspruchsvoll sind die Anforderungen an die Probenpräparation und Bildgebung: Um Nanoröhren zuverlässig zu detektieren, sind erstklassige Fixationsprotokolle, kontrastverstärkende Methoden in der Elektronenmikroskopie und die Verwendung stabiler Fluorophore nötig, die lebende Zellen über längere Zeiträume zulassen. Zusätzlich erfordert die Verfolgung von Transportprozessen oft die Entwicklung spezifischer Markerkonstrukte — etwa fluoreszenzgetaggte Amyloid-beta-Peptide oder Reporter, die auf intrazelluläre Calciumflüsse reagieren — sowie Bildanalysepipelines, die Mikrotrends in großen Datensätzen erkennen.
Expertinnen- und Experteneinschätzungen
„Diese Entdeckung fügt unserer Karte der neuronalen Kommunikation eine neue Ebene hinzu“, sagte Dr. Elena Vargas, eine fiktive Neurobiologin und Wissenschaftskommunikatorin mit Hintergrund in Studien zur Proteinaggregation. „Sie verändert die Sichtweise auf zelluläre Abfallentsorgung und die unbeabsichtigten Folgen dieser Mechanismen. Die gezielte Beeinflussung von Nanoröhrendynamiken könnte ein kluger Weg sein, früh in den Krankheitsverlauf einzugreifen, doch es sind sorgfältige Studien nötig, um nützliche Clearance-Pfade nicht zu blockieren.“
Die nächsten Schritte für das Johns-Hopkins-Team umfassen die Kartierung von Nanoröhrennetzwerken über verschiedene Zelltypen des Gehirns hinweg, das Engineering kontrollierter Nanoröhrenbildung in vitro und das Testen, ob eine Veränderung der Nanoröhrenaftzahl den Verlauf der Amyloidose in vivo modifiziert. Wenn diese Ansätze erfolgreich sind, könnten sie auf mögliche Arzneimittelziele oder gentechnische Biologika hinweisen, die die Aktivität interzellulärer Nanoröhren selektiv modulieren.
Für die klinische Translation sind mehrere Herausforderungen zu überwinden: die Entwicklung sicherer Wirkstoffe, die in das zentrale Nervensystem eindringen können, die genaue Bestimmung von therapeutischen Fenstern in frühen Krankheitsstadien sowie die Identifizierung zuverlässiger Biomarker, die Änderungen in Nanoröhrendichte oder -funktion beim Menschen signalisieren. Bildgebende Verfahren, Cerebrospinalflüssigkeitanalysen und molekulare Biomarker könnten zusammenspielen, um Behandlungsansprechbarkeit und Risiken zu überwachen.
Forschungsperspektive und Schlussgedanke
Vorläufig betrachtet stellt die Entdeckung die frühe Alzheimer-Pathologie nicht länger nur als lokalisierte Plaquebildung dar, sondern als einen dynamischen Prozess, der von mikroskopischen Leitungen beeinflusst wird, die neuronale Gemeinschaften verbinden. Diese neue Perspektive kann verändern, wie Forschende nach Biomarkern suchen und wie frühe Interventionen konzipiert werden, um die Ausbreitung zu verlangsamen oder zu stoppen. Ob Nanoröhren schließlich als therapeutisches Ziel taugen oder eher als Indikator für eine zugrundeliegende zelluläre Dysregulation dienen, wird Gegenstand intensiver weiterer Forschung sein.
Insgesamt verstärkt die Studie bekannte Hypothesen zur transzellulären Ausbreitung von Proteopathien und bietet konkrete experimentelle Ansätze, um die Rolle interzellulärer Nanoröhren in der Neurodegeneration weiter aufzuklären. Die Integration von Multimodal-Bildgebung, Tiermodellen, humanen Gewebedaten und computergestützten Simulationen schafft eine belastbare Grundlage für die nächsten Schritte in Richtung Diagnostik und Therapie.
Quelle: sciencedaily

Kommentar hinterlassen