8 Minuten
Wissenschaftler haben eine neuartige Nanopartikel‑Behandlung eingesetzt, um einen kritischen Transportweg an der Blut‑Hirn‑Schranke bei Mäusen wiederherzustellen. Dadurch konnten toxische Amyloid‑beta‑Ablagerungen, die mit der Alzheimer‑Krankheit in Verbindung stehen, innerhalb weniger Stunden entfernt werden. Nach drei Injektionen zeigten Tiere, die zuvor kognitive Beeinträchtigungen aufwiesen, eine Leistung wie gesunde Kontrollen, und der Nutzen hielt über Monate an.
Das Tor reparieren statt daran vorbeizuschleichen
Über Jahrzehnte hinweg betrachteten Forschende die Blut‑Hirn‑Schranke (BHS) vor allem als ein Hindernis, das es zu umgehen gilt — eine dichte Zellbarriere, die viele Medikamente am Eindringen ins Gehirn hindert. Zahlreiche Teams versuchten deshalb, Wirkstoffe in Nanopartikeln zu tarnen oder die Schranke kurzzeitig mit fokussiertem Ultraschall zu öffnen, um Therapien hindurchzulassen. Eine internationale Zusammenarbeit unter Leitung des Institute for Bioengineering of Catalonia (IBEC) und des West China Hospital Sichuan University (WCHSU) schlägt einen anderen Ansatz vor: Die BHS selbst könnte bei Alzheimer fehlreguliert sein, und die Reparatur ihrer Transportmechanismen könnte das Gehirn wieder in die Lage versetzen, toxische Abfälle zu entsorgen.
Wie das Experiment funktionierte
Die Forschenden entwickelten Nanopartikel, die nicht nur als Transportmittel für Wirkstoffe dienen, sondern aktiv das Verhalten von Zellen an der Blut‑Hirn‑Schranke modulieren. Zielmolekül war das endotheliale LRP1 (Low‑Density Lipoprotein Receptor‑Related Protein 1), ein Rezeptor, der auf der blutzugewandten Seite der Gehirngefäße exprimiert wird und eine wichtige Rolle beim Transport von Amyloid‑beta aus dem Gehirn spielt. In Mausmodellen mit Alzheimer‑ähnlicher Genetik führten drei Injektionen der Nanopartikel zu einer Kaskade molekularer Ereignisse, die diesen Clearance‑Weg wiederherstellten.
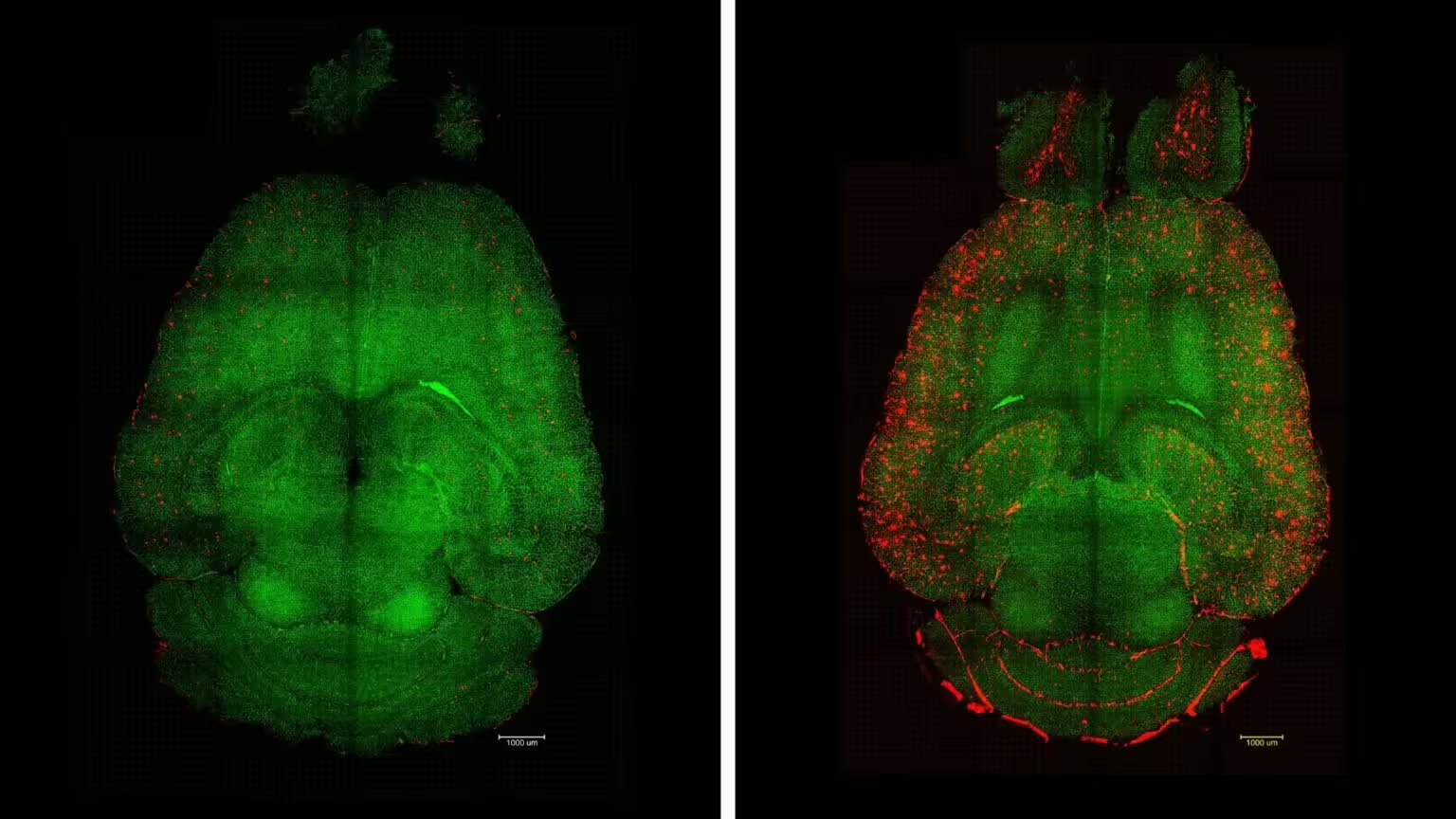
Amyloid‑beta‑Plaques (rot) wurden aus den Gehirnen behandelter Mäuse (links) entfernt, aber nicht bei unbehandelten Kontrollen (rechts). Gefäße der Blut‑Hirn‑Schranke sind grün dargestellt. (IBEC)
Bereits wenige Stunden nach der ersten Verabreichung sank die Plaquelast um nahezu 45 Prozent. Nach Abschluss der Behandlungsserie zeigte sich, dass die behandelten Tiere räumliches Lernen und Gedächtnisleistungen aufwiesen, die mit denen gesunder Artgenossen vergleichbar waren. Von besonderer Bedeutung ist, dass diese kognitiven Verbesserungen mindestens sechs Monate anhielten, was auf eine dauerhafte Zurücksetzung der Clearance‑Funktion hindeutet und nicht nur auf eine vorübergehende Symptomveränderung.
Warum das wichtig ist: Fokus auf Gefäßreparatur
Die meisten derzeit verfügbaren Alzheimer‑Medikamente zielen darauf ab, Plaques und Tau‑Verfilzungen im Gehirn zu entfernen oder zu neutralisieren. Substanzen wie Lecanemab und Donanemab können das Fortschreiten der Symptome teilweise verlangsamen, kehren die Erkrankung bislang jedoch nicht um. Das IBEC‑WCHSU‑Team argumentiert, dass eine ausschließliche Konzentration auf intraneurale Aggregate die Grenzen des Gehirns übersieht — genau dort, wo gestörter Transport und vaskuläre Dysfunktion möglicherweise die Neurodegeneration auslösen oder beschleunigen.
Die therapeutischen Implikationen sind tiefgreifend: Die Wiederherstellung des Verkehrs über die Blut‑Hirn‑Schranke könnte das Gehirn befähigen, nicht nur Amyloid‑beta, sondern eine Vielzahl toxischer Moleküle wieder effektiv zu entfernen. Giuseppe Battaglia, Bioingenieur am IBEC, beschreibt das Prinzip als kaskadenförmig: Wenn toxische Spezies wie Amyloid‑beta akkumulieren, schreitet die Krankheit voran. Gelingt es hingegen, die Gefäßfunktion wiederherzustellen, beginnt das System erneut, Amyloid‑beta und andere schädliche Moleküle abzutransportieren, sodass das Gleichgewicht wiederhergestellt werden kann.
Experimentelle Details und Grenzen
Die berichteten Effekte stammen aus präklinischen Versuchen an Mäusen mit einem spezifischen, demenzierelevanten Genotyp. In diesem Ansatz agieren Nanopartikel als aktive Agenzien — gewissermaßen als «winzige Ingenieure» — auf molekularer Ebene: Sie modulieren Rezeptoraktivität und Zell‑Signalwege, um die Removal‑Mechanismen über die BHS wieder zu aktivieren. Die Forschenden quantifizierten Plaquereduktion und Gedächtnisverbesserung mittels Histologie, Immunfärbungen und etablierten Verhaltensassays (z. B. Morris‑Wasserlabyrinth und andere Tests zur räumlichen Orientierung und Gedächtnisleistung).
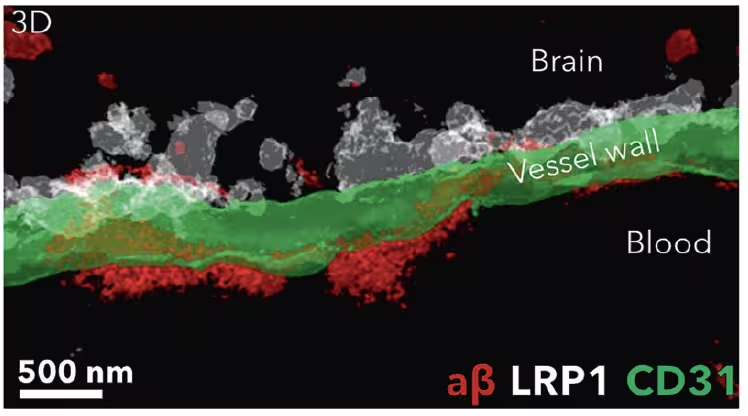
Nach Behandlung mit Nanopartikeln (weiß) wurden Amyloid‑beta‑Ablagerungen (rot) von der Gehirnseite der Blut‑Hirn‑Schranke (grün) entfernt und im Blut abtransportiert. (Chen et al., STTT, 2025)
Dennoch ist Vorsicht geboten. Mäuse und Menschen unterscheiden sich deutlich in der Gefäßarchitektur des Gehirns, in Immunantworten und in der Lebensspanne, die altersabhängige Veränderungen begünstigt. Unabhängige Expertinnen und Experten betonen, dass Erfolge in Nagetiermodellen zwar ermutigend sind, aber keine Garantie für klinische Wirksamkeit beim Menschen darstellen. Die Studie umfasste eine begrenzte Anzahl von Tieren und untersuchte einen engen Krankheitsuntertyp; umfassendere Tests sind nötig, um Sicherheit, optimale Dosierung und die Frage zu klären, ob ähnliche Transportwege in älteren menschlichen Gehirnen rekultiviert werden können.
Wichtige technische Aspekte, die in Folgeuntersuchungen adressiert werden müssen, umfassen: mögliche Immunogenität der Partikel, Langzeittoxizität in peripheren Organen (Leber, Milz, Niere), Pharmakokinetik und -dynamik sowie die Interaktion mit der menschlichen Neurovascularen Einheit (Endothel, Perizyten, Astrozyt‑Endfüße). Zudem ist zu prüfen, ob die Aktivierung von LRP1 selektiv genug erfolgt, um Nebenwirkungen zu minimieren, oder ob andere Transportmechanismen (z. B. Receptor‑Mediated Transcytosis) unbeabsichtigt beeinflusst werden.
Potenzielle Folgeeffekte für Alzheimer‑Therapien
Die Reparatur des BHS‑Transports könnte bestehende Therapien ergänzen statt ersetzen. Wenn die vaskuläre Funktion wiederhergestellt ist, könnten andere Behandlungsformen — monoklonale Antikörper, kleine Moleküle oder auch nichtpharmakologische Interventionen wie Bewegung und Ernährung — effektiver werden, weil das Gehirn wieder in der Lage ist, Abbauprodukte aktiv auszuscheiden. Der Ansatz erweitert außerdem den Zielraum für die Wirkstoffentwicklung: Statt nur Moleküle zu entwerfen, die das Gehirn erreichen, könnten Entwicklerinnen und Entwickler Substanzen schaffen, die die eigenen Clearance‑Systeme des Gehirns reaktivieren.
Aus Sicht der Wirkstoffentwicklung ergeben sich mehrere strategische Implikationen: Fokus auf vaskuläre Zielstrukturen (z. B. LRP1), Kombinationstherapien, die sowohl Clearance‑Mechanismen aktivieren als auch Aggregate neutralisieren, und die Integration von Biomarkern zur Messung der Gefäßfunktion (z. B. bildgebende Verfahren, zirkulierende Endothelzellen, LRP1‑Expression im Blutgefäßendothel). Solche Biomarker wären entscheidend, um klinische Studien effizient zu gestalten und frühzeitig auf Sicherheits- oder Wirksamkeitsmarker zu reagieren.
Expertinnen‑ und Experteneinschätzung
Dr. Laura Mendes, Neurowissenschaftlerin und spezialisiert auf neurovaskuläre Biologie am Global Brain Institute, kommentiert: „Diese Arbeit verschiebt die Perspektive. Statt Wirkstoffe gewaltsam an einem beschädigten Tor vorbeizuschmuggeln, schlägt sie vor, die Leitungsbahnen zu reparieren — also die Mechanismen wiederherzustellen, die das Gehirn normalerweise sauber halten. Die Übertragung auf den Menschen wird anspruchsvoll sein, aber die Idee, endogene Clearance‑Wege zu reaktivieren, ist spannend und steht im Einklang mit wachsenden Daten, die vaskuläre Gesundheit als zentralen Faktor für Demenzrisiko identifizieren.“
Julia Dudley von Alzheimer’s Research UK, die nicht an der Studie beteiligt war, äußerte vorsichtigen Optimismus: Die Ergebnisse „fügen der zunehmenden Evidenz hinzu, dass die Reparatur der Blut‑Hirn‑Schranke selbst einen neuen Weg eröffnen könnte, Alzheimer zu behandeln“, und wies zugleich auf die weiterhin bestehende Lücke zwischen Mausmodellen und menschlicher Krankheit hin.
Was als Nächstes ansteht?
Das Team plant weitere präklinische Studien, um Langzeitsicherheit, therapeutische Dosisbereiche und Wirksamkeit in unterschiedlichen Modellsystemen zu prüfen, einschließlich älterer Tiere und solcher mit komorbiden vaskulären Veränderungen. Parallel dazu sind Untersuchungen zur Übertragbarkeit auf den Menschen erforderlich, um herauszufinden, ob LRP1‑zentrierte Pfade beim Menschen ähnlich modulierbar sind und ob Nanopartikel‑Plattformen sich unter klinischen Herstellungsstandards (GMP) skalieren lassen.
Technologischer Transfer und Translation bedeuten auch regulatorische Hürden: präklinische Toxikologie, GMP‑Konformität, Skalierung der Partikelproduktion, Aufreinigung, Charakterisierung der Partikelgröße und -ladung sowie das Design von Frühphasen‑Studien, die Sicherheitsendpunkte mit Biomarkern der vaskulären Funktion kombinieren. Klinische Studien müssten stratifizierte Patientengruppen berücksichtigen — etwa solche mit biomarkerbestätigter Amyloid‑Pathologie und Anzeichen vaskulärer Dysfunktion — um Effekte gezielt zu detektieren.
Wenn sich die Befunde reproduzieren und erweitern lassen, könnte diese Strategie der Gefäßreparatur eine neue Angriffslinie gegen Alzheimer eröffnen: eine, die auf die Wiederherstellung der körpereigenen Clearance‑Systeme setzt, statt allein externe Agenzien die Hauptlast tragen zu lassen. In Kombination mit Antikörpertherapien, small‑molecule‑Ansätzen oder Lebensstilinterventionen könnte dies ein umfassenderes, multi‑modal ausgerichtetes Behandlungsparadigma ermöglichen.
Abschließend lässt sich festhalten, dass die Studie einen bedeutsamen konzeptionellen Wechsel anregt: weg von der ausschließlichen Bekämpfung intraneuraler Ablagerungen, hin zu einer integrativen Sicht, die vaskuläre Gesundheit, Transportmechanismen und Immunantworten als entscheidende Komponenten für Prävention und Therapie neurodegenerativer Erkrankungen betrachtet. Fortschritte in diesen Bereichen erfordern interdisziplinäre Zusammenarbeit zwischen Bioingenieurwesen, Gefäßbiologie, Neurologie, Pharmakologie und regulatorischer Wissenschaft.
Quelle: sciencealert

Kommentar hinterlassen