8 Minuten
Eine winzige, stressanfällige Population von Neuronen tief in der Großhirnrinde könnte den Blutfluss und die elektrische Aktivität im gesamten Gehirn orchestrieren. Neue Experimente an Mäusen legen nahe, dass diese seltenen Zellen — bekannt als Typ-I-nNOS-Neuronen — eine überproportionale Rolle bei schlafbezogenen Gehirnrhythmen, der Reinigung von Gewebe und möglicherweise den frühen Stadien neurodegenerativer Erkrankungen spielen.
Wie wenige Zellen das ganze Gehirn beeinflussen
Typ-I-nNOS-Neuronen sind spärlich verteilt und hauptsächlich in tiefen kortikalen Schichten verborgen, doch sie scheinen deutlich mehr Einfluss zu haben, als ihre Zahl vermuten lässt. Forschende der Pennsylvania State University nutzten gezielte Methoden, um diesen Zelltyp bei Mäusen selektiv zu entfernen, und überwachten anschließend Veränderungen im zerebralen Blutfluss, in den langsamen Gefäßschwankungen (Vasomotion) sowie in der allgemeinen neuronalen Aktivität.
Die Befunde waren auffällig. Tiere ohne Typ-I-nNOS-Neuronen zeigten einen insgesamt reduzierten Hirndurchblutung, abgeschwächte Vasomotion und geringere neuronale Feuerraten. Insbesondere die langsamen Delta-Wellen — jene Gehirnrythmen, die mit Tiefschlaf und Gedächtniskonsolidierung verbunden sind — verringerten sich in ihrer Amplitude, und die übliche Synchronisation zwischen linker und rechter Hemisphäre geriet aus dem Takt.
Diese Ergebnisse deuten darauf hin, dass eine sehr kleine Zellgruppe als eine Art Netzwerk-Hub fungieren könnte: Sie verbindet vaskuläre Mechanismen mit großräumigen neuronalen Oszillationen und sorgt damit für eine kohärente Anpassung von Blutversorgung und elektrischer Aktivität über weite Hirnareale hinweg. Solch ein Hub würde erklären, warum das Entfernen weniger Zellen so breite physiologische Folgen nach sich zieht.
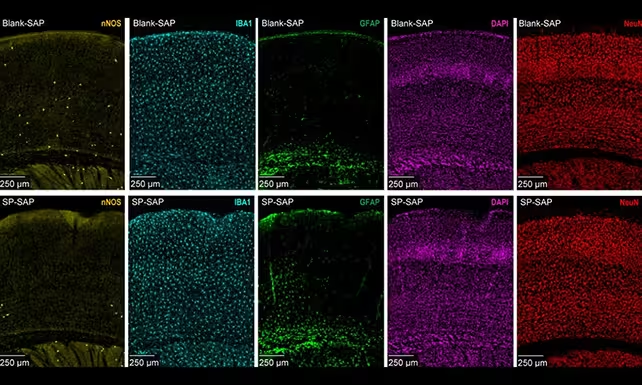
Typ-I-nNOS-Neuronen (gelb markiert) sind deutlich seltener als andere Zelltypen und wurden von den Forschenden selektiv entfernt.
Warum Vasomotion und langsame Wellen wichtig sind
Vasomotion bezeichnet die spontane, rhythmische Erweiterung und Verengung von Hirnarterien, -venen und Kapillaren im Sekundenbereich. Diese fortlaufenden Schwingungen helfen, interstitielles Fluid und Liquor (Zerebrospinalflüssigkeit) durch das Hirngewebe zu bewegen — ein Prozess, der die Entfernung metabolischer Abfallprodukte unterstützt. Wird die Vasomotion geschwächt, kann der Abtransport toxischer Proteine, wie etwa Amyloid‑Beta oder Tau-Protein, die bei Alzheimer eine Rolle spielen, beeinträchtigt werden.
Der Zusammenhang zwischen vaskulären Oszillationen und langsamen neuronalen Wellen ist funktional wichtig: Im Tiefschlaf dominieren langsame Delta-Oszillationen, die nicht nur bei der Gedächtniskonsolidierung eine Rolle spielen, sondern offenbar auch die nächtlichen Reinigungsprozesse des Gehirns begünstigen. Während dieser Phase sind Durchblutung, extrazellulärer Fluss und zelluläre Stoffwechselvorgänge anders getaktet als im Wachzustand — was die Effizienz der glymphatischen Reinigung (auch als glymphatisches System bezeichnet) beeinflussen kann.
Die Arbeiten des Penn-State-Teams zeigten, dass Abnahmen von Blutfluss und neuronaler Aktivität besonders während des Schlafs ausgeprägt waren, wenn Delta-Wellen normalerweise überwiegen. Diese Beobachtung legt nahe: Sind Typ-I-nNOS-Neuronen kompromittiert, könnte sowohl die Schlafarchitektur als auch die nächtliche Reinigung des Gehirns leiden. Langfristig könnten solche Defizite das Risiko für kognitive Störungen und neurodegenerative Prozesse erhöhen.
Aus SEO-Sicht sind Schlüsselbegriffe wie nNOS-Neuronen, Vasomotion, zerebraler Blutfluss, Delta-Wellen und glymphatisches System zentral, weil sie die Verbindung zwischen vaskulärer Regulation, Schlafphysiologie und Abfallbeseitigung klar benennen. Eine eingehende Betrachtung dieser Mechanismen hilft, mögliche Pfade zu identifizieren, über die Stress, Alterung oder Krankheit die Hirngesundheit beeinträchtigen.
Experimentelle Details und wissenschaftliche Implikationen
Die Forschenden verwendeten eine zelltypspezifische Ablation in Mäusen, um die Rolle der Typ-I-nNOS-Neuronen zu isolieren, ohne das umliegende Gewebe großflächig zu schädigen. Solche gezielten Eingriffe basieren häufig auf genetischer Markierung von Zellpopulationen kombiniert mit Methoden zur selektiven Zellelimination (z. B. induzierbare Toxine oder Chemogenetik). Dadurch konnten die Wissenschaftler deutlich zeigen, dass das Entfernen dieses einzelnen Zelltyps die Amplitude spontaner vaskulärer Oszillationen reduzierte und gleichzeitig die langsame Wellenaktivität im Elektroenzephalogramm abschwächte.
Die gleichzeitigen Veränderungen in vaskulären und neuronalen Parametern unterstreichen die Hypothese, dass betroffene Neuronen als Koordinatoren fungieren: Sie stimmen die lokale und globale Blutversorgung auf die Netzwerkaktivität ab. Eine Störung dieser Abstimmung kann folglich zu einer Kaskade führen, die Schlafqualität, Abtransport toxischer Proteine und langfristige neuronale Gesundheit beeinträchtigt.
Der Biomedizintechniker Patrick Drew, dessen Labor zuvor nNOS-assoziierte Blutflussregulation kartiert hat, beschreibt spontane Gefäßoszillationen als einen mechanistischen Weg des Gehirns, Flüssigkeit durch rhythmische Gefäßweitenänderungen zu bewegen. Wenn Neurone, die diese Rhythmen timen und modulieren, verloren gehen, könnte das laut Drew und seinen Kollegen eine Reihe von Dysfunktionen auslösen — von gestörter Schlafarchitektur über reduzierte glymphatische Clearance bis hin zu erhöhtem Risiko für neurodegenerative Veränderungen.
Technisch betrachtet liefern diese Daten auch methodische Hinweise: Für die Messungen kombinierten die Teams vermutlich invasive und nicht-invasive Messverfahren wie Laser-Doppler-Flowmetrie, intravitale Mikroskopie oder elektrophysiologische Langzeitaufzeichnungen, um vaskuläre und neuronale Aktivität simultan zu erfassen. Solche multimodalen Ansätze erhöhen die Aussagekraft, indem sie Korrelationen und zeitliche Abfolgen zwischen Blutflussänderungen und neuronaler Oszillation sichtbar machen.
Von Mäusen zu Menschen: was ist plausibel?
Diese Befunde stammen aus Mausmodellen; die Übertragbarkeit auf den Menschen muss noch geprüft werden. Dennoch sind viele fundamentale vaskuläre und neuronale Prozesse bei Säugetieren konserviert, weshalb die Idee plausibel erscheint, dass eine kleine, stressanfällige Neuronengruppe großflächige Gehirndynamiken beeinflussen kann. Wenn es vergleichbare Zellen beim Menschen gibt, und wenn sie ähnlich funktionieren, könnte ihr Verlust durch chronischen Stress, Alterungsprozesse oder Krankheiten ein bislang unterschätzter Faktor für Neurodegeneration sein.
Eine bereits etablierte Erkenntnis ist, dass verringerter zerebraler Blutfluss die kognitive Leistungsfähigkeit beeinträchtigen kann und als Beitrag zur Entstehung von Demenz angesehen wird. Die neue Studie ergänzt dieses Bild, indem sie einen spezifischen zellulären Mechanismus identifiziert, der vaskulären Tonus, langsamen Schlaf und interhemisphärische Synchronie verbindet — allesamt Prozesse, die für gesunde Kognition wichtig sind.
Für die Übertragung auf den Menschen kämen verschiedene Untersuchungsansätze in Frage: postmortale histologische Analysen, single-cell-Transkriptomik zur Identifikation ähnlicher molekularer Marker, hochauflösende funktionelle Bildgebung (z. B. fMRI bei ultra-hoher Feldstärke) oder PET-Studien zum Nachweis von Plaques und Tau-Pathologie in Kombination mit Schlafaufzeichnungen. Solche multimodalen Studien könnten klären, ob eine vergleichbare Zellpopulation existiert und wie sie im Alter oder bei Erkrankungen verändert wird.
Was Forschende als Nächstes untersuchen werden
Zukünftige Experimente werden zunächst bestätigen müssen, ob das menschliche Gehirn auf eine äquivalente Population von Typ-I-nNOS-Neuronen angewiesen ist. Forschergruppen planen vermutlich Untersuchungen mit humanen Gewebeproben, postmortalen Analysen und empfindlichen molekularen Techniken wie single-cell RNA-Sequencing, um vergleichbare Zelltypen auf molekularer Ebene zu identifizieren.
Ein wichtiger Forschungsstrang wird untersuchen, wie Stress, Inflammation oder Alter diese Zellen selektiv schädigen. Dabei interessieren Fragen wie: Geht Zelltod diesen Prozessen voraus, oder sind die Zellen in frühen Krankheitsstadien funktionell beeinträchtigt? Lassen sich erste funktionelle Veränderungen mit minimalinvasiven Biomarkern oder Bildgebungsverfahren detektieren, bevor kognitive Symptome auftreten?
Therapeutische Perspektiven ergeben sich aus zwei Richtungen: zum einen präventive Maßnahmen wie Stressreduktion, Schlafoptimierung und vaskulär schützende Lebensstilinterventionen; zum anderen pharmakologische Strategien zur Stabilisierung oder Wiederherstellung der betroffenen Neurone. Denkbar sind auch neuromodulatorische Verfahren, die Vasomotion oder langsame Wellen gezielt stärken, sowie Ansätze zur Förderung der glymphatischen Clearance während des Schlafs.
Wichtig ist die Balance zwischen realistischer Erwartung und wissenschaftlichem Optimismus: Während die Idee, eine bestimmte Zellpopulation zu schützen oder zu ersetzen, attraktiv ist, erfordert die Entwicklung klinischer Interventionen robuste Nachweise in translationalen Modellen und kontrollierten Studien.
Fachliche Einschätzung
Dr. Claire Mendoza, eine nicht an der Studie beteiligte Neurovaskular-Forscherin, sagt: „Die Vorstellung, dass ein seltener Zelltyp vaskuläre Rhythmen im gesamten Gehirn koordinieren kann, ist spannend. Sie verändert unsere Perspektive auf die Blutflussregulation — weg von einer rein lokalen Antwort auf Aktivität hin zu einem vernetzten Prozess, der Schlaf und Abfallbeseitigung unterstützt. Die Untersuchung von Resilienz und Verwundbarkeit dieser Neuronen könnte neue präventive Strategien gegen Demenz eröffnen.“
Das Verständnis, wie Stress diese Neuronen beeinflusst, hat auch öffentliche Gesundheitsrelevanz. Chronischer Stress ist in modernen Gesellschaften weit verbreitet; sollte er selektiv die Zellen schwächen, die den zerebralen Blutfluss regulieren, könnten Stressreduktion, Schlafförderung und vaskulär protektive Interventionen einen Beitrag dazu leisten, die Hirngesundheit im Alter zu bewahren.
Zusammenfassend liefern die beschriebenen Tierstudien einen plausiblen Mechanismus, der vaskuläre Regulation, Schlafphysiologie und die Entfernung schädlicher Proteine verbindet. Die Identifikation von Typ-I-nNOS-Neuronen als möglichen Schlüsselspieler eröffnet neue Forschungswege und betont die Bedeutung integrativer Ansätze, die Vasculature, Neurone und Schlaf gleichermaßen betrachten. Weiterführende translational klinische Studien werden zeigen, inwieweit diese Erkenntnisse langfristig zur Prävention oder Behandlung neurodegenerativer Erkrankungen genutzt werden können.
Quelle: sciencealert

Kommentar hinterlassen